Atomic Force Microscopy Cantilever-Based Nanoindentation: Mekaniske egenskapsmålinger på nanoskala i luft og væske
Summary
Kvantifisering av kontaktområdet og kraften påført av et atomkraftmikroskop (AFM) sondespiss til en prøveoverflate muliggjør bestemmelse av mekaniske egenskaper på nanoskala. Beste praksis for å implementere AFM cantilever-basert nanoindentasjon i luft eller væske på myke og harde prøver for å måle elastisk modul eller andre nanomekaniske egenskaper diskuteres.
Abstract
Et atomkraftmikroskop (AFM) måler fundamentalt samspillet mellom en nanoskala AFM-sondespiss og prøveoverflaten. Hvis kraften påført av sondespissen og dens kontaktområde med prøven kan kvantifiseres, er det mulig å bestemme nanoskala mekaniske egenskaper (f.eks. Elastisk eller Youngs modul) av overflaten som undersøkes. En detaljert prosedyre for å utføre kvantitative AFM-utkragingsbaserte nanoindentasjonseksperimenter er gitt her, med representative eksempler på hvordan teknikken kan brukes til å bestemme elastiske moduler av et bredt utvalg av prøvetyper, alt fra kPa til GPa. Disse inkluderer levende mesenkymale stamceller (MSC) og kjerner i fysiologisk buffer, harpiksinnebygde dehydrerte loblolly furutverrsnitt og Bakken-skifer med varierende sammensetning.
I tillegg brukes AFM cantilever-basert nanoindentasjon til å undersøke bruddstyrken (dvs. gjennombruddskraft) av fosfolipid-dobbeltlag. Viktige praktiske hensyn som metodevalg og utvikling, sondevalg og kalibrering, interesseområdeidentifikasjon, prøveheterogenitet, funksjonsstørrelse og sideforhold, spissslitasje, overflateruhet og dataanalyse og målestatistikk diskuteres for å hjelpe riktig implementering av teknikken. Endelig demonstreres samlokalisering av AFM-avledede nanomekaniske kart med elektronmikroskopiteknikker som gir ytterligere informasjon om elementær sammensetning.
Introduction
Å forstå de mekaniske egenskapene til materialer er en av de mest grunnleggende og essensielle oppgavene innen engineering. For analyse av bulkmaterialegenskaper er det mange metoder tilgjengelig for å karakterisere de mekaniske egenskapene til materialsystemer, inkludert strekktester1, kompresjonstester2 og tre- eller firepunkts bøyetester (bøye)3. Selv om disse mikroskalatestene kan gi uvurderlig informasjon om bulkmaterialegenskaper, utføres de vanligvis til svikt, og er derfor ødeleggende. I tillegg mangler de den romlige oppløsningen som er nødvendig for å nøyaktig undersøke mikro- og nanoskalaegenskapene til mange materielle systemer som er av interesse i dag, for eksempel tynne filmer, biologiske materialer og nanokompositter. For å begynne å løse noen av problemene med storskala mekanisk testing, hovedsakelig dens destruktive natur, ble mikrohardhetstester vedtatt fra mineralogi. Hardhet er et mål på motstanden til et materiale mot plastisk deformasjon under spesifikke forhold. Generelt bruker mikrohardhetstester en stiv sonde, vanligvis laget av herdet stål eller diamant, for å rykke inn i et materiale. Den resulterende fordypningsdybden og / eller området kan deretter brukes til å bestemme hardheten. Flere metoder har blitt utviklet, inkludert Vickers4, Knoop5 og Brinell6 hardhet; Hver gir et mål på materialhardhet i mikroskala, men under forskjellige forhold og definisjoner, og produserer som sådan bare data som kan sammenlignes med tester utført under de samme forholdene.
Instrumentert nanoindentasjon ble utviklet for å forbedre de relative verdiene oppnådd via de ulike mikrohardhetstestmetodene, forbedre den romlige oppløsningen som er mulig for analyse av mekaniske egenskaper, og muliggjøre analyse av tynne filmer. Det er viktig at ved å benytte metoden som først ble utviklet av Oliver og Pharr7, kan elastikken eller Youngs modul, E, av et prøvemateriale bestemmes via instrumentert nanoindentasjon. Videre, ved å bruke en Berkovich tresidig pyramidal nanoindenter-sonde (hvis ideelle spissområdefunksjon samsvarer med Vickers firesidige pyramideprobe)8, kan direkte sammenligning mellom nanoskala og mer tradisjonelle mikroskala hardhetsmålinger gjøres. Med veksten i populariteten til AFM, begynte AFM cantilever-basert nanoindentation å få oppmerksomhet også, spesielt for å måle de mekaniske egenskapene til mykere materialer. Som et resultat, som vist skjematisk i figur 1, er de to mest brukte teknikkene i dag for å forhøre og kvantifisere nanoskala mekaniske egenskaper instrumentert nanoindentasjon (figur 1A) og AFM utkragingsbasert nanoindentasjon (figur 1B) 9, hvorav sistnevnte er fokus for dette arbeidet.
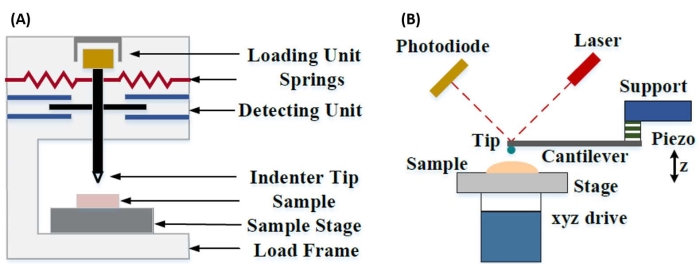
Figur 1: Sammenligning av instrumenterte og AFM utkragebaserte nanoindentasjonssystemer. Skjematiske diagrammer som viser typiske systemer for å gjennomføre (A) instrumentert nanoindentasjon og (B) AFM utkragingsbasert nanoindentasjon. Denne figuren ble modifisert fra Qian et al.51. Forkortelse: AFM = atomkraftmikroskopi. Klikk her for å se en større versjon av denne figuren.
Både instrumentert og AFM utkragingsbasert nanoindentasjon benytter en stiv sonde for å deformere en prøveoverflate av interesse og overvåke den resulterende kraften og forskyvningen som en funksjon av tid. Vanligvis spesifiseres enten den ønskede belastningen (dvs. kraft) eller (Z-piezo) forskyvningsprofilen av brukeren via programvaregrensesnittet og styres direkte av instrumentet, mens den andre parameteren måles. Den mekaniske egenskapen som oftest oppnås fra nanoindentasjonseksperimenter er den elastiske modulen (E), også referert til som Youngs modul, som har trykkenheter. Den elastiske modulen til et materiale er en grunnleggende egenskap knyttet til bindingsstivheten og er definert som forholdet mellom strekk- eller trykkspenning (σ, den påførte kraften per arealenhet) til aksial belastning (ε, proporsjonal deformasjon langs innrykksaksen) under elastisk (dvs. reversibel eller midlertidig) deformasjon før utbruddet av plastisk deformasjon (ligning [1]):
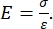 (1)
(1)
Det skal bemerkes at fordi mange materialer (spesielt biologiske vev) faktisk er viskoelastiske, består den (dynamiske eller komplekse) modulen i virkeligheten av både elastiske (lagring, i fase) og viskøse (tap, ute av fase) komponenter. I praksis er det som måles i et nanoindentasjonseksperiment den reduserte modulen, E *, som er relatert til den sanne prøvemodulen av interesse, E, som vist i ligning (2):
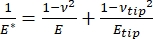 (2)
(2)
Hvor E-spiss og ν-spiss er henholdsvis den elastiske modulen og Poissons forhold mellom nanoindenterspissen, og ν er det estimerte Poisson-forholdet mellom prøven. Poissons forhold er det negative forholdet mellom den tverrgående og aksiale belastningen, og indikerer dermed graden av tverrgående forlengelse av en prøve ved å bli utsatt for aksial belastning (f.eks. under nanoindentasjonsbelastning), som vist i ligning (3):
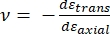 (3)
(3)
Konverteringen fra redusert til faktisk modul er nødvendig fordi a) noe av den aksiale belastningen som formidles av indenterspissen, kan konverteres til tverrgående belastning (dvs. prøven kan deformeres via ekspansjon eller sammentrekning vinkelrett på belastningsretningen), og b) innrykksspissen ikke er uendelig hard, og dermed resulterer innrykk av prøven i en viss (liten) mengde deformasjon av spissen. Merk at i tilfelle hvor E-spissen>> E ( dvs. indenterspissen er mye hardere enn prøven, noe som ofte er sant når du bruker en diamantsonde), forenkles forholdet mellom den reduserte og faktiske prøvemodulen sterkt til E ≈ E * (1 – v2). Mens instrumentert nanoindentasjon er overlegen når det gjelder nøyaktig kraftkarakterisering og dynamisk område, er AFM utkragingsbasert nanoindentasjon raskere, gir størrelsesordener større kraft og forskyvningsfølsomhet, muliggjør høyere oppløsning avbildning og forbedret innrykk lokalisering, og kan samtidig sonde nanoskala magnetiske og elektriske egenskaper9. Spesielt er AFM cantilever-basert nanoindentasjon overlegen for kvantifisering av mekaniske egenskaper ved nanoskala av myke materialer (f.eks. Polymerer, geler, lipid-dobbeltlag og celler eller andre biologiske materialer), ekstremt tynne (sub-μm) filmer (hvor substrateffekter kan spille inn avhengig av innrykksdybde) 10,11 og suspenderte todimensjonale (2D) materialer12,13,14 som grafen 15,16, glimmer 17, sekskantet boritrid (h-BN)18, eller overgangsmetall dichalcogenides (TMDC; f.eks. MoS2)19. Dette skyldes dens utsøkte kraft (sub-nN) og forskyvningsfølsomhet (sub-nm), noe som er viktig for nøyaktig å bestemme det første kontaktpunktet og forbli innenfor det elastiske deformasjonsområdet.
I AFM utkragingsbasert nanoindentasjon aktiveres forskyvning av en AFM-sonde mot prøveoverflaten av et kalibrert piezoelektrisk element (figur 1B), med den fleksible utkragingen som til slutt bøyes på grunn av den resistive kraften som oppleves ved kontakt med prøveoverflaten. Denne bøyningen eller avbøyningen av utkragingen overvåkes vanligvis ved å reflektere en laser fra baksiden av utkragingen og inn i en fotodetektor (posisjonsfølsom detektor [PSD]). Sammen med kunnskapen om utkragingsstivhet (i nN/nm) og avbøyningsfølsomhet (i nm/V), er det mulig å konvertere denne målte utkrageavbøyningen (i V) til kraften (i nN) som påføres prøven. Etter kontakt gir forskjellen mellom Z-piezo-bevegelsen og utkragingsavbøyningen prøveinnrykksdybden. Kombinert med kunnskapen om spissområdefunksjonen gjør dette det mulig å beregne kontaktområdet for spissprøven. Hellingen til kontaktdelene av de resulterende kraftavstands- eller kraftforskyvningskurvene (F-D) kan da passe ved hjelp av en passende kontaktmekanikkmodell (se dataanalysedelen av diskusjonen) for å bestemme prøvens nanomekaniske egenskaper. Mens AFM cantilever-basert nanoindentation har noen klare fordeler over instrumentert nanoindentation som beskrevet ovenfor, presenterer det også flere praktiske implementeringsutfordringer, for eksempel kalibrering, spissslitasje og dataanalyse, som vil bli diskutert her. En annen potensiell ulempe med AFM cantilever-basert nanoindentasjon er antagelsen om lineær elastisitet, da kontaktradiusen og innrykksdybdene må være mye mindre enn indenterradiusen, noe som kan være vanskelig å oppnå når man arbeider med nanoskala AFM-sonder og / eller prøver som viser betydelig overflateruhet.
Tradisjonelt har nanoindentasjon vært begrenset til individuelle steder eller små rutenettinnrykkeksperimenter, hvor et ønsket sted (dvs. interesseområde [ROI]) er valgt og et enkelt kontrollert innrykk, flere innrykk på ett sted atskilt med litt ventetid, og / eller et grovt rutenett av innrykk utføres med en hastighet i størrelsesorden Hz. Nylige fremskritt innen AFM tillater imidlertid samtidig oppkjøp av mekaniske egenskaper og topografi gjennom bruk av høyhastighets kraftkurvebaserte bildebehandlingsmoduser (referert til av forskjellige handelsnavn avhengig av systemprodusenten), hvor kraftkurver utføres med en kHz-hastighet under belastningskontroll, med maksimal spissprøvekraft brukt som bildesettpunkt. Point-and-shoot-metoder har også blitt utviklet, noe som gjør det mulig å skaffe seg et AFM-topografibilde etterfulgt av etterfølgende selektiv nanoindentasjon på interessepunkter i bildet, som gir nanoskala romlig kontroll over nanoinnrykkplassering. Selv om det ikke er hovedfokus for dette arbeidet, presenteres spesifikke utvalgte applikasjonseksempler på både kraftkurvebasert avbildning og punkt-og-skyt-utkragingsbasert nanoindentasjon i de representative resultatene, og kan brukes sammen med protokollen som er skissert nedenfor hvis tilgjengelig på den aktuelle AFM-plattformen som brukes. Spesielt skisserer dette arbeidet en generalisert protokoll for den praktiske implementeringen av AFM cantilever-basert nanoindentation på ethvert dyktig AFM-system og gir fire brukseksempler (to i luft, to i væske) av teknikken, inkludert representative resultater og en grundig diskusjon av nyansene, utfordringene og viktige hensyn for å lykkes med å bruke teknikken.
Protocol
Representative Results
Discussion
Prøve forberedelse
For nanoindentasjon i luft inkluderer vanlige prepareringsmetoder kryoseksjonering (f.eks. Vevsprøver), sliping og / eller polering etterfulgt av ultramikrotoming (f.eks. Harpiksinnebygde biologiske prøver), ionfresing eller fokusert ionstrålepreparasjon (f.eks. Halvleder-, porøse eller blandede hardhetsprøver som ikke kan poleres), mekanisk eller elektrokjemisk polering (f.eks. metalllegeringer) eller tynnfilmavsetning (f.eks. Atomlag eller kjemisk dampavsetning, molekylær …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Alle AFM-eksperimenter ble utført i Boise State University Surface Science Laboratory (SSL). SEM-karakterisering ble utført i Boise State Center for Materials Characterization (BSCMC). Forskning rapportert i denne publikasjonen om biodrivstoffråstoff ble støttet delvis av US Department of Energy, Office of Energy Efficiency and Renewable Energy, Bioenergy Technologies Office som en del av Feedstock Conversion Interface Consortium (FCIC), og under DOE Idaho Operations Office Contract DE-AC07-051ID14517. Cellemekanikkstudier ble støttet av National Institutes of Health (USA) under tilskudd AG059923, AR075803 og P20GM109095, og av National Science Foundation (USA) tilskudd 1929188 og 2025505. Modellen lipid bilayer systems arbeid ble støttet av National Institutes of Health (USA) under tilskudd R01 EY030067. Forfatterne takker Dr. Elton Graugnard for å produsere det sammensatte bildet vist i figur 11.
Materials
| Atomic force microscope | Bruker | Dimension Icon | Uses Nanoscope control software, including PeakForce Quantitative Nanomechanical Mapping (PF-QNM), FastForce Volume (FFV), and Point-and-Shoot Ramping experimental workspaces |
| AtomicJ | American Institute of Physics | https://doi.org/10.1063/1.4881683 | Flexible, powerful, free open source Java-based force curve analysis software package. Supports numerous contact mechanic models, such as Hertz, Sneddon DMT, JKR, Maugis, and cone or pyramid (including blunt and truncated). Also includes a variety of initial contact point estimation methods to choose from. Supports batch processing of data and subsequent statistical analysis (e.g., averages, standard deviations, histograms, goodness of fit, etc.). Literature citation is: P. Hermanowicz, M. Sarna, K. Burda, and H. Gabry , “AtomicJ: An open source software for analysis of force curves” Rev. Sci. Instrum. 85: 063703 (2014), https://doi.org/10.1063/1.4881683 , “AtomicJ: An open source software for analysis of force curves” Rev. Sci. Instrum. 85: 063703 (2014), https://doi.org/10.1063/1.4881683 |
| Buffer solution (PBS) | Fisher Chemical (NaCl), Sigma Aldrich (KCl), Fisher BioReagents (Na2HPO4 and KH2PO4) | S271 (>99% purity NaCl), P9541 (>99% purity KCl), BP332(>99% purity Na2HPO4), BP362 (>99% purity KH2PO4) | Phosphate buffered saline (PBS) was prepared in the laboratory as an aqueous solution consisting of 137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, and 1.8 mM KH2PO4 dissolved in ultrapure water. Reagents were measured out using an analytical balance, and glassware was cleaned with soap and water followed by autoclaving immediately prior to use. |
| Chloroform | |||
| Diamond tip AFM probe | Bruker | PDNISP | Pre-mounted factory-calibrated cube corner diamond (E = 1140 GPa) tip AFM probe (nominal R = 40 nm) with a stainless steel cantilever (nominal k = 225 N/m, f0 = 50 kHz). Spring constant is measured at the factory (k = 256 N/m for the probe, Serial #13435414, used here) and calibration data (including AFM images of indents showing probe geometry) is provided with the probe. |
| Diamond ultramicrotome blade | Diatome | Ultra 35° | 2.1 mm width. Also used a standard glass blade for intial rough cut of sample surface before transitioning to diamond blade for final surface preparation |
| Epoxy | Gorilla Glue | 26853-31-6 | Epoxy resin and hardner were mixed in a 1:1 ratio, a small drop was placed on a stainless steel sample puck (Ted Pella), and V1 grade muscovite mica (Ted Pella) was attached to create an atomically flat surface for preparation of phospholipid membranes. |
| Ethanol | |||
| LR white resin, medium grade (catalyzed) | Electron Microscopy Sciences | 14381 | 500 mL bottle, Lot #150629 |
| Mesenchymal stem cells (MSCs) | N/A | N/A | MSCs for nanomechanical studies were primary cells harvested from 8-10 week old male C57BL/6 mice as described in Goelzer, M. et al. "Lamin A/C Is Dispensable to Mechanical Repression of Adipogenesis" Int J Mol Sci 22: 6580 (2021) doi:10.3390/ijms22126580 and Peister, A. et al. "Adult stem cells from bone marrow (MSCs) isolated from different strains of inbred mice vary in surface epitopes, rates of proliferation, and differentiation potential" Blood 103: 1662-1668 (2004), doi:10.1182/blood-2003-09-3070. |
| Modulus standards | Bruker | PFQNM-SMPKIT-12M | Used HOPG (E = 18 GPa) and PS (E = 2.7 GPa). Also contains 2x PDMS (Tack 0, E = 2.5 MPa; Tack 4, E = 3.5 MPa), PS-LDPE (E = 2.0/0.2 GPa), fused silica (E = 72.9 GPa), sapphire (E – 345 GPa), and tip characterization (titanium roughness) sample. All samples come pre-mounted on a 12 mm diameter steel disc (sample puck). |
| Muscovite mica | Ted Pella | 50-12 | 12 mm diameter, V1 grade muscovite mica |
| Nanscope Analysis | Bruker | Version 2.0 | Free AFM image processing and analysis software package, but designed for, and proprietary/limited to Bruker AFMs; similar functionality is available from free, platform-independent AFM image processing and analysis software packages such as Gwyddion, WSxM, and others. Has built-in capabilities for force curve analysis, but AtomicJ is more flexible/full featured (e.g., more built-in contact mechanics models to choose from, statistical analysis of force curve fitting results, etc.) for force curve analysis and handles batch processing of force curves. |
| Phospholipids: POPC, Cholesterol (ovine) | Avanti Polar Lipids | POPC: CAS # 26853-31-6, Cholesterol: CAS # 57-88-5 | POPC lipid dissolved in chloroform (25 mg/mL) was obtained from vendor and used without further purification. Cholesterol powder from the same vendor was dissolved in chloroform (20 mg/mL). |
| Probe holder (fluid, lipid bilayers) | Bruker | MTFML-V2 | Specific to the particular AFM used; MTFML-V2 is a glass probe holder for scanning in fluid on a MultiMode AFM. |
| Probe holder (fluid, MSCs) | Bruker | FastScan Bio Z-scanner | Used with Dimension FastScan head (XY flexure scanners). Serial number MXYPOM5-1B154. |
| Probe holder (standard, ambient) | Bruker | DAFMCH | Specific to the particular AFM used; DAFMCH is the standard contact and tapping mode probe holder for the Dimension Icon AFM, suitable for nanoindentation (PF-QNM, FFV, and point-and-shoot ramping) |
| Sample Puck | Ted Pella | 16218 | Product number is for 15 mm diameter stainless steel sample puck. Also available in 6 mm, 10 mm, 12 mm, and 20 mm diameters at https://www.tedpella.com/AFM_html/AFM.aspx#anchor842459 |
| Sapphire substrate | Bruker | PFQNM-SMPKIT-12M | Extremely hard surface (E = 345 GPa) for measuring deflection sensitivity of probes (want all of the deflection to come from the probe, not the substrate). Part of the PF-QNM/modulus standards kit. |
| Scanning electron microscope | Hitachi | S-3400N-II | Located at Boise State. Used to perform co-localized SEM/EDS on all samples except additively manufactured (AM) Ti-6Al-4V. |
| Silicon AFM probes (standard) | NuNano | Scout 350 | Standard tapping mode silicon probe with reflective aluminum backside coating; k = 42 N/m (nominal), f0 = 350 kHz. Nominal R = 5 nm. Also available uncoated or with reflective gold backside coating. Probes with similar specifications are available from other manufacturers (e.g., Bruker TESPA-V2). |
| Silicon AFM probes (stiff) | Bruker | RTESPA-525, RTESPA-525-30 | Rotated tip etched silicon probes with reflective aluminum backside coating; k = 200 N/m (nominal), f0 = 525 kHz. Nominal R = 8 nm for RTESPA-525, R = 30 nm for RTESPA-525-30. Spring constant of each RTESPA-525-30 is measured individually at the factory via laser Doppler vibrometry and supplied with the probe. |
| Silicon carbide grit paper (abrasive discs) | Allied | 50-10005 | 120 grit |
| Silicon nitride AFM probes (soft, large radius hemispherical tip) | Bruker | MLCT-SPH-5UM, MLCT-SPH-5UM-DC | Also MLCT-SPH-1UM-DC. New product line of factory-calibrated (probe radius and spring constants of all cantilevers) large radius (R = 1 or 5 mm) hemispherical tip (at the end of a 23 mm long cylindrical shaft) probes. DC = drift compensation coating. 6 cantilevers/probe (A-F). Nominal spring constants: A, k = 0.07 N/m; B, k = 0.02 N/m; C, k = 0.01 N/m; D, k = 0.03 N/m; E, k = 0.1 N/m; F, k = 0.6 N/m. |
| Silicon nitride AFM probes (soft, medium sharp tip) | Bruker | DNP | 4 cantilevers/probe (A-d). Nominal spring constants: A, k = 0.35 N/m; B, k = 0.12 N/m; C, k = 0.24 N/m; D, k = 0.06 N/m. Nominal radii of curvature, R = 10 nm. |
| Silicon nitride AFM probes (soft, sharp tip) | Bruker | ScanAsyst-Air | Nominal values: resonance frequency, f0 = 70 kHz; spring constant, k = 0.4 N/m; radius of curvature, R = 2 nm. Designed for force curve based AFM imaging. |
| Superglue | Henkel | Loctite 495 | Cyanoacrylate based instant adhesive. Lots of roughly equivalent products are readily available. |
| Syringe pump | New Era Pump Systems | NE1000US | One channel syringe pump system with infusion and withdrawal capacity |
| Tip characterization standard | Bruker | PFQNM-SMPKIT-12M | Titanium (Ti) roughness standard. Part of the PF-QNM/modulus standards kit. |
| Ultrahigh purity nitrogen (UHP N2), 99.999% | Norco | SPG TUHPNI – T | T size compressed gas cylinder of ultrahigh purity (99.999%) nitrogen for drying samples |
| Ultramicrotome | Leica | EM UC6 | Equipped with a glass blade (standard, for intial sample preparation) and a diamond blade (for final preparation) |
| Ultrapure water | Thermo Fisher | Barnstead Nanopure Model 7146 | Model has been discontinued, but equivalent products are available. Produces ≥18.2 MΩ*cm ultrapure water with 1-5 ppb TOC (total organic content), per inline UV monitoring. Includes 0.2 µm particulate filter, ion exchange columns, and UV oxidation chamber. |
| Variable Speed Grinder | Buehler | EcoMet 3000 | Used with silicon carbide grit papers during hand polishing. |
| Vibration isolation table (active) | Herzan | TS-140 | Used with Bruker MultiMode AFM. Sits on a TMC 65-531 vibration isolation table. Bruker Dimension Icon AFM utilizes strictly passive vibration isolation (comes from manufacturer with custom acoustic hood, air table, and granite slab). |
| Vibration isolation table (passive) | TMC | 65-531 | 35" x 30" vibration isolation table with optional air damping (disabled). Used with Bruker MultiMode AFM. Herzan TS-140 "Table Stable" active vibration control table is located on top. |
References
- Hart, E. W. Theory of the tensile test. Acta Metallurgica. 15 (2), 351-355 (1967).
- Fell, J. T., Newton, J. M. Determination of tablet strength by the diametral-compression test. Journal of Pharmaceutical Sciences. 59 (5), 688-691 (1970).
- Babiak, M., Gaff, M., Sikora, A., Hysek, &. #. 3. 5. 2. ;. Modulus of elasticity in three- and four-point bending of wood. Composite Structures. 204, 454-465 (2018).
- Song, S., Yovanovich, M. M. Relative contact pressure-Dependence on surface roughness and Vickers microhardness. Journal of Thermophysics and Heat Transfer. 2 (1), 43-47 (1988).
- Hays, C., Kendall, E. G. An analysis of Knoop microhardness. Metallography. 6 (4), 275-282 (1973).
- Hill, R., Storåkers, B., Zdunek, A. B. A theoretical study of the Brinell hardness test. Proceedings of the Royal Society of London. A. Mathematical and Physical Sciences. 423 (1865), 301-330 (1989).
- Oliver, W. C., Pharr, G. M. An improved technique for determining hardness and elastic modulus using load and displacement sensing indentation experiments. Journal of Materials Research. 7 (6), 1564-1583 (1992).
- Sakharova, N. A., Fernandes, J. V., Antunes, J. M., Oliveira, M. C. Comparison between Berkovich, Vickers and conical indentation tests: A three-dimensional numerical simulation study. International Journal of Solids and Structures. 46 (5), 1095-1104 (2009).
- Cohen, S. R., Kalfon-Cohen, E. Dynamic nanoindentation by instrumented nanoindentation and force microscopy: a comparative review. Beilstein Journal of Nanotechnology. 4 (1), 815-833 (2013).
- Saha, R., Nix, W. D. Effects of the substrate on the determination of thin film mechanical properties by nanoindentation. Acta Materialia. 50 (1), 23-38 (2002).
- Tsui, T. Y., Pharr, G. M. Substrate effects on nanoindentation mechanical property measurement of soft films on hard substrates. Journal of Materials Research. 14 (1), 292-301 (1999).
- Cao, G., Gao, H. Mechanical properties characterization of two-dimensional materials via nanoindentation experiments. Progress in Materials Science. 103, 558-595 (2019).
- Castellanos-Gomez, A., Singh, V., vander Zant, H. S. J., Steele, G. A. Mechanics of freely-suspended ultrathin layered materials. Annalen der Physik. 527 (1-2), 27-44 (2015).
- Cao, C., Sun, Y., Filleter, T. Characterizing mechanical behavior of atomically thin films: A review. Journal of Materials Research. 29 (3), 338-347 (2014).
- Lee, C., Wei, X., Kysar, J. W., Hone, J. Measurement of the elastic properties and intrinsic strength of monolayer graphene. Science. 321 (5887), 385-388 (2008).
- Elibol, K., et al. Visualising the strain distribution in suspended two-dimensional materials under local deformation. Scientific Reports. 6 (1), 28485 (2016).
- Castellanos-Gomez, A., et al. Mechanical properties of freely suspended atomically thin dielectric layers of mica. Nano Research. 5 (8), 550-557 (2012).
- Song, L., et al. Large scale growth and characterization of atomic hexagonal boron nitride layers. Nano Letters. 10 (8), 3209-3215 (2010).
- Castellanos-Gomez, A., et al. Elastic properties of freely suspended MoS2 nanosheets. Advanced Materials. 24 (6), 772-775 (2012).
- D’Costa, N. P., Hoh, J. H. Calibration of optical lever sensitivity for atomic force microscopy. Review of Scientific Instruments. 66 (10), 5096-5097 (1995).
- Wu, Y., et al. Evaluation of elastic modulus and hardness of crop stalks cell walls by nano-indentation. Bioresource Technology. 101 (8), 2867-2871 (2010).
- Barns, S., et al. Investigation of red blood cell mechanical properties using AFM indentation and coarse-grained particle method. BioMedical Engineering OnLine. 16 (1), 140 (2017).
- Hermanowicz, P., Sarna, M., Burda, K., Gabryś, H. AtomicJ: An open source software for analysis of force curves. Review of Scientific Instruments. 85 (6), 063703 (2014).
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: a critical overview. Tribology Letters. 65 (1), 23 (2016).
- Tiwari, A. . Nanomechanical Analysis of High Performance Materials. , (2015).
- Aggarwal, R. L., Ramdas, A. K. . Physical Properties of Diamond and Sapphire. , (2019).
- Boyd, E. J., Uttamchandani, D. Measurement of the anisotropy of Young’s modulus in single-crystal silicon. Journal of Microelectromechanical Systems. 21 (1), 243-249 (2012).
- Harding, J. W., Sneddon, I. N. The elastic stresses produced by the indentation of the plane surface of a semi-infinite elastic solid by a rigid punch. Mathematical Proceedings of the Cambridge Philosophical Society. 41 (1), 16-26 (2008).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis-I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129 (3), 430-440 (2006).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis-II: Adhesion-influenced indentation of soft, elastic materials. Journal of Biomechanical Engineering. 129 (6), 904-912 (2007).
- Haile, S., Palmer, M., Otey, A. Potential of loblolly pine: switchgrass alley cropping for provision of biofuel feedstock. Agroforestry Systems. 90 (5), 763-771 (2016).
- Lu, X., et al. Biomass logistics analysis for large scale biofuel production: Case study of loblolly pine and switchgrass. Bioresource Technology. 183, 1-9 (2015).
- Susaeta, A., Lal, P., Alavalapati, J., Mercer, E., Carter, D. Economics of intercropping loblolly pine and switchgrass for bioenergy markets in the southeastern United States. Agroforestry Systems. 86 (2), 287-298 (2012).
- Garcia, R. Nanomechanical mapping of soft materials with the atomic force microscope: methods, theory and applications. Chemical Society Reviews. 49 (16), 5850-5884 (2020).
- Derjaguin, B. V., Muller, V. M., Toporov, Y. P. Effect of contact deformations on the adhesion of particles. Journal of Colloid and Interface Science. 53 (2), 314-326 (1975).
- Ciesielski, P. N., et al. Engineering plant cell walls: tuning lignin monomer composition for deconstructable biofuel feedstocks or resilient biomaterials. Green Chemistry. 16 (5), 2627-2635 (2014).
- Liu, K., Ostadhassan, M., Zhou, J., Gentzis, T., Rezaee, R. Nanoscale pore structure characterization of the Bakken shale in the USA. Fuel. 209, 567-578 (2017).
- Maryon, O. O., et al. Co-localizing Kelvin probe force microscopy with other microscopies and spectroscopies: selected applications in corrosion characterization of alloys. JoVE. (184), e64102 (2022).
- Eliyahu, M., Emmanuel, S., Day-Stirrat, R. J., Macaulay, C. I. Mechanical properties of organic matter in shales mapped at the nanometer scale. Marine and Petroleum Geology. 59, 294-304 (2015).
- Li, C., et al. Nanomechanical characterization of organic matter in the Bakken formation by microscopy-based method. Marine and Petroleum Geology. 96, 128-138 (2018).
- Bouzid, T., et al. The LINC complex, mechanotransduction, and mesenchymal stem cell function and fate. Journal of Biological Engineering. 13 (1), 68 (2019).
- Dupont, S., et al. Role of YAP/TAZ in mechanotransduction. Nature. 474 (7350), 179-183 (2011).
- Wang, S., et al. CCM3 is a gatekeeper in focal adhesions regulating mechanotransduction and YAP/TAZ signalling. Nature Cell Biology. 23 (7), 758-770 (2021).
- Sen, B., et al. Mechanical strain inhibits adipogenesis in mesenchymal stem cells by stimulating a durable β-catenin signal. Endocrinology. 149 (12), 6065-6075 (2008).
- Sen, B., et al. mTORC2 regulates mechanically induced cytoskeletal reorganization and lineage selection in marrow-derived mesenchymal stem cells. Journal of Bone and Mineral Research. 29 (1), 78-89 (2014).
- Sen, B., et al. Mechanically induced nuclear shuttling of β-catenin requires co-transfer of actin. Stem Cells. 40 (4), 423-434 (2022).
- Newberg, J., et al. Isolated nuclei stiffen in response to low intensity vibration. Journal of Biomechanics. 111, 110012 (2020).
- Ding, Y., Xu, G. -. K., Wang, G. -. F. On the determination of elastic moduli of cells by AFM based indentation. Scientific Reports. 7 (1), 45575 (2017).
- Khadka, N. K., Timsina, R., Rowe, E., O’Dell, M., Mainali, L. Mechanical properties of the high cholesterol-containing membrane: An AFM study. Biochimica et Biophysica Acta. Biomembranes. 1863 (8), 183625 (2021).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surface Science Reports. 61 (10), 429-444 (2006).
- Qian, L., Zhao, H. Nanoindentation of soft biological materials. Micromachines. 9 (12), 654 (2018).
- Pittenger, B., Yablon, D. Improving the accuracy of nanomechanical measurements with force-curve-based AFM techniques. Bruker Application Notes. 149, (2017).
- Vorselen, D., Kooreman, E. S., Wuite, G. J. L., Roos, W. H. Controlled tip wear on high roughness surfaces yields gradual broadening and rounding of cantilever tips. Scientific Reports. 6 (1), 36972 (2016).
- Bhaskaran, H., et al. Ultralow nanoscale wear through atom-by-atom attrition in silicon-containing diamond-like carbon. Nature Nanotechnology. 5 (3), 181-185 (2010).
- Giannazzo, F., Schilirò, E., Greco, G., Roccaforte, F. Conductive atomic force microscopy of semiconducting transition metal dichalcogenides and heterostructures. Nanomaterials. 10 (4), 803 (2020).
- Melitz, W., Shen, J., Kummel, A. C., Lee, S. Kelvin probe force microscopy and its application. Surface Science Reports. 66 (1), 1-27 (2011).
- Kazakova, O., et al. Frontiers of magnetic force microscopy. Journal of Applied Physics. 125 (6), 060901 (2019).
- Kim, H. -. J., Yoo, S. -. S., Kim, D. -. E. Nano-scale wear: A review. International Journal of Precision Engineering and Manufacturing. 13 (9), 1709-1718 (2012).
- Heath, G. R., et al. Localization atomic force microscopy. Nature. 594 (7863), 385-390 (2021).
- Strahlendorff, T., Dai, G., Bergmann, D., Tutsch, R. Tip wear and tip breakage in high-speed atomic force microscopes. Ultramicroscopy. 201, 28-37 (2019).
- Lantz, M. A., et al. Wear-resistant nanoscale silicon carbide tips for scanning probe applications. Advanced Functional Materials. 22 (8), 1639-1645 (2012).
- Khurshudov, A. G., Kato, K., Koide, H. Wear of the AFM diamond tip sliding against silicon. Wear. 203, 22-27 (1997).
- Villarrubia, J. S. Algorithms for scanned probe microscope image simulation, surface reconstruction, and tip estimation. Journal of Research of the National Institute of Standards and Technology. 102 (4), 425 (1997).
- Kain, L., et al. Calibration of colloidal probes with atomic force microscopy for micromechanical assessment. Journal of the Mechanical Behavior of Biomedical Materials. 85, 225-236 (2018).
- Slattery, A. D., Blanch, A. J., Quinton, J. S., Gibson, C. T. Accurate measurement of Atomic Force Microscope cantilever deflection excluding tip-surface contact with application to force calibration. Ultramicroscopy. 131, 46-55 (2013).
- Dobrovinskaya, E. R., Lytvynov, L. A., Pishchik, V. . Sapphire: Material, Manufacturing, Applications. , (2009).
- te Riet, J., et al. Interlaboratory round robin on cantilever calibration for AFM force spectroscopy. Ultramicroscopy. 111 (12), 1659-1669 (2011).
- Pratt, J. R., Shaw, G. A., Kumanchik, L., Burnham, N. A. Quantitative assessment of sample stiffness and sliding friction from force curves in atomic force microscopy. Journal of Applied Physics. 107 (4), 044305 (2010).
- Slattery, A. D., Blanch, A. J., Quinton, J. S., Gibson, C. T. Calibration of atomic force microscope cantilevers using standard and inverted static methods assisted by FIB-milled spatial markers. Nanotechnology. 24 (1), 015710 (2012).
- Higgins, M. J., et al. Noninvasive determination of optical lever sensitivity in atomic force microscopy. Review of Scientific Instruments. 77 (1), 013701 (2006).
- Lévy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13 (1), 33-37 (2001).
- Sikora, A. Quantitative normal force measurements by means of atomic force microscopy towards the accurate and easy spring constant determination. Nanoscience and Nanometrology. 2 (1), 8-29 (2016).
- Ohler, B. Cantilever spring constant calibration using laser Doppler vibrometry. Review of Scientific Instruments. 78 (6), 063701 (2007).
- Gates, R. S., Pratt, J. R. Accurate and precise calibration of AFM cantilever spring constants using laser Doppler vibrometry. Nanotechnology. 23 (37), 375702 (2012).
- Cleveland, J. P., Manne, S., Bocek, D., Hansma, P. K. A nondestructive method for determining the spring constant of cantilevers for scanning force microscopy. Review of Scientific Instruments. 64 (2), 403-405 (1993).
- Sader, J. E., Chon, J. W. M., Mulvaney, P. Calibration of rectangular atomic force microscope cantilevers. Review of Scientific Instruments. 70 (10), 3967-3969 (1999).
- Sader, J. E., et al. Spring constant calibration of atomic force microscope cantilevers of arbitrary shape. Review of Scientific Instruments. 83 (10), 103705 (2012).
- Sader, J. E. Frequency response of cantilever beams immersed in viscous fluids with applications to the atomic force microscope. Journal of Applied Physics. 84 (1), 64-76 (1998).
- Sader, J. E., Pacifico, J., Green, C. P., Mulvaney, P. General scaling law for stiffness measurement of small bodies with applications to the atomic force microscope. Journal of Applied Physics. 97 (12), 124903 (2005).
- Mendels, D. -. A., et al. Dynamic properties of AFM cantilevers and the calibration of their spring constants. Journal of Micromechanics and Microengineering. 16 (8), 1720-1733 (2006).
- Gao, S., Brand, U. In-situ nondestructive characterization of the normal spring constant of AFM cantilevers. Measurement Science and Technology. 25 (4), 044014 (2014).
- Gibson, C. T., Watson, G. S., Myhra, S. Determination of the spring constants of probes for force microscopy/spectroscopy. Nanotechnology. 7 (3), 259-262 (1996).
- Gates, R. S., Pratt, J. R. Prototype cantilevers for SI-traceable nanonewton force calibration. Measurement Science and Technology. 17 (10), 2852-2860 (2006).
- Neumeister, J. M., Ducker, W. A. Lateral, normal, and longitudinal spring constants of atomic force microscopy cantilevers. Review of Scientific Instruments. 65 (8), 2527-2531 (1994).
- Kim, M. S., Choi, I. M., Park, Y. K., Kang, D. I. Atomic force microscope probe calibration by use of a commercial precision balance. Measurement. 40 (7), 741-745 (2007).
- Kim, M. -. S., Choi, J. -. H., Park, Y. -. K., Kim, J. -. H. Atomic force microscope cantilever calibration device for quantified force metrology at micro- or nano-scale regime: the nano force calibrator (NFC). Metrologia. 43 (5), 389-395 (2006).
- Tian, Y., et al. A novel method and system for calibrating the spring constant of atomic force microscope cantilever based on electromagnetic actuation. Review of Scientific Instruments. 89 (12), 125119 (2018).
- Clifford, C. A., Seah, M. P. The determination of atomic force microscope cantilever spring constants via dimensional methods for nanomechanical analysis. Nanotechnology. 16 (9), 1666-1680 (2005).
- Chen, B. -. Y., Yeh, M. -. K., Tai, N. -. H. Accuracy of the spring constant of atomic force microscopy cantilevers by finite element method. Analytical Chemistry. 79 (4), 1333-1338 (2007).
- Mick, U., Eichhorn, V., Wortmann, T., Diederichs, C., Fatikow, S. Combined nanorobotic AFM/SEM system as novel toolbox for automated hybrid analysis and manipulation of nanoscale objects. 2010 IEEE International Conference on Robotics and Automation. , 4088-4093 (2010).
- Kim, M. -. S., Choi, J. -. H., Kim, J. -. H., Park, Y. -. K. Accurate determination of spring constant of atomic force microscope cantilevers and comparison with other methods. Measurement. 43 (4), 520 (2010).
- Zhang, G., Wei, Z., Ferrell, R. E. Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation. Applied Clay Science. 43 (2), 271-281 (2009).
- Bobko, C. P., Ortega, J. A., Ulm, F. -. J. Comment on "Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation by G. Zhang, Z. Wei and R.E. Ferrell. Applied Clay Science. 46 (4), 425-428 (2009).
- Zhang, G., Wei, Z., Ferrell, R. E. Reply to the Comment on "Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation" by G. Zhang, Z. Wei and R. E. Ferrell. Applied Clay Science. 46 (4), 429-432 (2009).
- Jin, D. W., et al. Thermal stability and Young’s modulus of mechanically exfoliated flexible mica. Current Applied Physics. 18 (12), 1486-1491 (2018).
- Xiao, J., et al. Anisotropic friction behaviour of highly oriented pyrolytic graphite. Carbon. 65, 53-62 (2013).
- Hertz, H. Ueber die Berührung fester elastischer Körper. Journal für die reine und angewandte Mathematik. 1882 (92), 156-171 (1882).
- Johnson, K. L., Kendall, K., Roberts, A. D., Tabor, D. Surface energy and the contact of elastic solids. Proceedings of the Royal Society of London. A. Mathematical and Physical Sciences. 324 (1558), 301-313 (1971).
- Muller, V. M., Derjaguin, B. V., Toporov, Y. P. On two methods of calculation of the force of sticking of an elastic sphere to a rigid plane. Colloids and Surfaces. 7 (3), 251-259 (1983).
- Maugis, D. Adhesion of spheres: The JKR-DMT transition using a dugdale model. Journal of Colloid and Interface Science. 150 (1), 243-269 (1992).
- Muller, V. M., Yushchenko, V. S., Derjaguin, B. V. On the influence of molecular forces on the deformation of an elastic sphere and its sticking to a rigid plane. Journal of Colloid and Interface Science. 77 (1), 91-101 (1980).
- Muller, V. M., Yushchenko, V. S., Derjaguin, B. V. General theoretical consideration of the influence of surface forces on contact deformations and the reciprocal adhesion of elastic spherical particles. Journal of Colloid and Interface Science. 92 (1), 92-101 (1983).
- Johnson, K. L., Greenwood, J. A. An adhesion map for the contact of elastic spheres. Journal of Colloid and Interface Science. 192 (2), 326-333 (1997).
- Shi, X., Zhao, Y. -. P. Comparison of various adhesion contact theories and the influence of dimensionless load parameter. Journal of Adhesion Science and Technology. 18 (1), 55-68 (2004).

