Атомно-силовая микроскопия Наноиндентирование на основе кантилеверов: измерения механических свойств на наноуровне в воздухе и жидкости
Summary
Количественная оценка площади контакта и силы, приложенной наконечником зонда атомно-силового микроскопа (АСМ) к поверхности образца, позволяет определять наноразмерные механические свойства. Обсуждаются лучшие практики реализации наноиндентирования на основе консолей АСМ в воздухе или жидкости на мягких и твердых образцах для измерения модуля упругости или других наномеханических свойств.
Abstract
Атомно-силовой микроскоп (АСМ) фундаментально измеряет взаимодействие между наноразмерным наконечником зонда АСМ и поверхностью образца. Если сила, приложенная наконечником зонда, и площадь его контакта с образцом могут быть количественно определены, можно определить наноразмерные механические свойства (например, упругость или модуль Юнга) исследуемой поверхности. Здесь представлена подробная процедура проведения количественных экспериментов по наноиндентированию на основе кантилеверов на основе АСМ с репрезентативными примерами того, как этот метод может быть применен для определения модулей упругости самых разных типов образцов, начиная от кПа и заканчивая ГПа. К ним относятся живые мезенхимальные стволовые клетки (МСК) и ядра в физиологическом буфере, залитые смолой обезвоженные поперечные сечения сосны и сланцы Баккена различного состава.
Кроме того, наноиндентирование на основе консолей AFM используется для исследования прочности на разрыв (т.е. силы прорыва) фосфолипидных бислоев. Обсуждаются важные практические соображения, такие как выбор и разработка метода, выбор и калибровка зонда, идентификация интересующей области, гетерогенность образца, размер элемента и соотношение сторон, износ наконечника, шероховатость поверхности, а также анализ данных и статистика измерений, чтобы помочь правильной реализации метода. Наконец, продемонстрирована совместная локализация наномеханических карт, полученных на основе АСМ, с методами электронной микроскопии, которые предоставляют дополнительную информацию об элементном составе.
Introduction
Понимание механических свойств материалов является одной из наиболее фундаментальных и важных задач в машиностроении. Для анализа свойств сыпучих материалов существует множество методов характеристики механических свойств систем материалов, включая испытания на растяжение 1, испытания на сжатие2 и испытанияна трех- или четырехточечный изгиб (изгиб)3. Хотя эти микромасштабные испытания могут предоставить бесценную информацию о свойствах сыпучих материалов, они, как правило, проводятся до отказа и, следовательно, являются разрушительными. Кроме того, им не хватает пространственного разрешения, необходимого для точного исследования микро- и наноразмерных свойств многих материальных систем, представляющих интерес сегодня, таких как тонкие пленки, биологические материалы и нанокомпозиты. Чтобы начать решать некоторые проблемы крупномасштабных механических испытаний, главным образом их разрушительного характера, из минералогии были заимствованы испытания на микротвердость. Твердость – это мера сопротивления материала пластической деформации в определенных условиях. Как правило, в тестах на микротвердость используется жесткий зонд, обычно изготовленный из закаленной стали или алмаза, для вдавливания в материал. Полученная глубина вдавливания и/или площадь затем могут быть использованы для определения твердости. Было разработано несколько методов, в том числе твердость по Виккерсу4, Кнупу5 и Бринеллю6; Каждый из них обеспечивает меру твердости материала в микромасштабе, но при разных условиях и определениях, и как таковой дает только данные, которые можно сравнить с испытаниями, проведенными в тех же условиях.
Инструментальное наноиндентирование было разработано для улучшения относительных значений, полученных с помощью различных методов испытаний на микротвердость, улучшения пространственного разрешения, возможного для анализа механических свойств, и обеспечения анализа тонких пленок. Важно отметить, что, используя метод, впервые разработанный Оливером и Фарром7, упругость или модуль Юнга, E, образца материала может быть определен с помощью инструментального наноиндентирования. Кроме того, используя трехсторонний пирамидальный наноинденторный зонд Берковича (чья идеальная функция площади наконечника совпадает с функцией четырехстороннего пирамидального зонда Виккерса)8, можно провести прямое сравнение между наноразмерными и более традиционными микромасштабными измерениями твердости. С ростом популярности АСМ наноиндентирование на основе консоли АСМ также стало привлекать внимание, особенно для измерения механических свойств более мягких материалов. В результате, как схематично показано на рисунке 1, двумя наиболее часто используемыми сегодня методами для опроса и количественной оценки наноразмерных механических свойств являются инструментальное наноиндентирование (рис. 1A) и наноиндентирование на основе консоли AFM (рис. 1B)9, последний из которых находится в центре внимания этой работы.
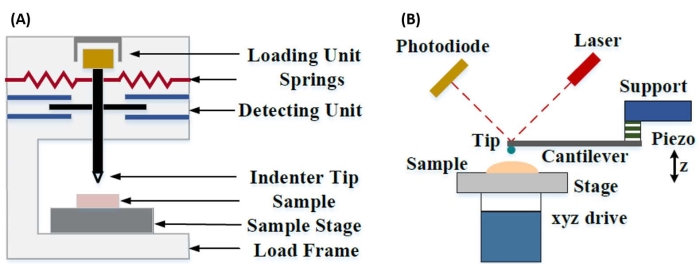
Рисунок 1: Сравнение инструментальных и консольных систем наноиндентирования на основе АСМ. Принципиальные схемы, изображающие типичные системы для проведения (А) инструментального наноиндентирования и (Б) наноиндентирования на основе АСМ на основе консоли. Эта цифра была изменена по сравнению с Qian et al.51. Аббревиатура: АСМ = атомно-силовая микроскопия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Как инструментальное, так и консольное наноиндентирование на основе АСМ используют жесткий зонд для деформации интересующей поверхности образца и контроля результирующей силы и смещения в зависимости от времени. Как правило, желаемый профиль нагрузки (т.е. силы) или (Z-пьезо) смещения задается пользователем через программный интерфейс и непосредственно управляется прибором, в то время как другой параметр измеряется. Механическим свойством, наиболее часто получаемым в результате экспериментов по наноиндентированию, является модуль упругости (E), также называемый модулем Юнга, который имеет единицы давления. Модуль упругости материала является фундаментальным свойством, относящимся к жесткости связи, и определяется как отношение растягивающего или сжимающего напряжения (σ, приложенная сила на единицу площади) к осевой деформации (ε, пропорциональная деформация вдоль оси вдавливания) во время упругой (т.е. обратимой или временной) деформации до начала пластической деформации (уравнение [1]):
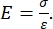 (1)
(1)
Следует отметить, что, поскольку многие материалы (особенно биологические ткани) на самом деле являются вязкоупругими, в действительности (динамический или сложный) модуль состоит как из упругих (хранение, в фазе), так и вязких (потеря, вне фазы) компонентов. На практике в эксперименте по наноиндентированию измеряется приведенный модуль Е *, который связан с истинным интересующим модулем выборки, Е, как показано в уравнении (2):
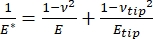 (2)
(2)
Где наконечник E и наконечник ν — модуль упругости и отношение Пуассона, соответственно, наконечника наноиндентора, а ν — расчетное отношение Пуассона образца. Коэффициент Пуассона представляет собой отрицательное отношение поперечной к осевой деформации и, следовательно, указывает степень поперечного удлинения образца при воздействии осевой деформации (например, при наноиндентификационной нагрузке), как показано в уравнении (3):
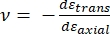 (3)
(3)
Преобразование из приведенного модуля в фактический необходимо, потому что: а) часть осевой деформации, создаваемой наконечником индентора, может быть преобразована в поперечную деформацию (т.е. образец может деформироваться за счет расширения или сжатия перпендикулярно направлению нагрузки), и б) наконечник индентора не является бесконечно твердым, и, таким образом, акт вдавливания образца приводит к некоторой (небольшой) величине деформации наконечника. Обратите внимание, что в случае, когда наконечник E >> E (т. е. наконечник индентора намного тверже образца, что часто верно при использовании алмазного зонда), соотношение между приведенным и фактическим модулем образца значительно упрощается до E ≈ E*(1 – v2). В то время как инструментальное наноиндентирование превосходит его с точки зрения точной характеристики силы и динамического диапазона, наноиндентирование на основе консоли АСМ происходит быстрее, обеспечивает на порядки большую чувствительность к силе и смещению, обеспечивает визуализацию с более высоким разрешением и улучшенное определение местоположения вдавливания, а также может одновременно исследовать наноразмерные магнитные и электрические свойства9. В частности, консольное наноиндентирование на основе АСМ превосходит количественное определение механических свойств на наноуровне мягких материалов (например, полимеров, гелей, липидных бислоев и клеток или других биологических материалов), чрезвычайно тонких (суб-мкм) пленок (где субсубтрейные эффекты могут вступать в игру в зависимости от глубины вдавливания)10,11 и взвешенных двумерных (2D) материалов12,13,14, таких как графен 15,16, слюда 17, гексагональный нитрид бора (h-BN)18 или дихалькогениды переходных металлов (TMDC; например, MoS2)19. Это связано с его исключительной чувствительностью к силе (sub-nN) и смещению (sub-nm), что важно для точного определения начальной точки контакта и сохранения в области упругой деформации.
При наноиндентировании на основе консолей АСМ смещение зонда АСМ к поверхности образца приводится в действие калиброванным пьезоэлектрическим элементом (рис. 1B), при этом гибкий кантилевер в конечном итоге изгибается из-за силы сопротивления, возникающей при контакте с поверхностью образца. Этот изгиб или отклонение кантилевера обычно контролируется путем отражения лазера от задней части кантилевера в фотодетектор (позиционно-чувствительный детектор [PSD]). В сочетании со знанием жесткости консоли (в нН/нм) и чувствительности к прогибу (в нм/В) можно преобразовать это измеренное консольное отклонение (в V) в силу (в нН), приложенную к образцу. После контакта разница между Z-пьезодвижением и прогибом консоли дает глубину вдавливания образца. В сочетании со знанием функции площади наконечника это позволяет рассчитать площадь контакта наконечника с образцом. Наклон контактных частей результирующих кривых «сила-расстояние» или «сила-смещение» (F-D) может быть затем подогнан с использованием соответствующей модели контактной механики (см. раздел «Анализ данных ») для определения наномеханических свойств образца. В то время как наноиндентирование на основе АСМ на основе консолей обладает некоторыми явными преимуществами по сравнению с инструментальным наноиндентированием, как описано выше, оно также представляет несколько практических проблем реализации, таких как калибровка, износ наконечника и анализ данных, которые будут обсуждаться здесь. Другим потенциальным недостатком наноиндентирования на основе кантилеверов на основе АСМ является предположение о линейной упругости, поскольку радиус контакта и глубина вдавливания должны быть намного меньше радиуса индентора, чего может быть трудно достичь при работе с наноразмерными зондами АСМ и/или образцами, демонстрирующими значительную шероховатость поверхности.
Традиционно наноиндентирование было ограничено отдельными местами или экспериментами по вдавливанию с небольшой сеткой, в которых выбирается желаемое местоположение (т.е. область интереса [ROI]) и выполняется один контролируемый отступ, несколько отступов в одном месте, разделенных некоторым временем ожидания, и/или грубая сетка отступов выполняется со скоростью порядка Гц. Тем не менее, последние достижения в области АСМ позволяют одновременно получать механические свойства и топографию за счет использования высокоскоростных режимов визуализации на основе кривых силы (называемых различными торговыми наименованиями в зависимости от производителя системы), в которых кривые силы проводятся с частотой кГц под управлением нагрузкой, при этом максимальная сила наконечника образца используется в качестве заданного значения изображения. Также были разработаны методы «наведи и стреляй», позволяющие получать топографическое изображение АСМ с последующим селективным наноиндентированием в точках интереса на изображении, обеспечивая наноразмерный пространственный контроль над местоположением наноиндентирования. Несмотря на то, что это не является основным направлением этой работы, конкретные избранные примеры применения как визуализации на основе кривой силы, так и наноиндентирования на основе консолей «наведи и стреляй» представлены в репрезентативных результатах и могут использоваться в сочетании с протоколом, изложенным ниже, если он доступен на конкретной используемой платформе АСМ. В частности, в этой работе описывается обобщенный протокол для практической реализации наноиндентирования на основе консолей АСМ на любой способной системе АСМ и приводятся четыре примера использования (два в воздухе, два в жидкости) метода, включая репрезентативные результаты и подробное обсуждение нюансов, проблем и важных соображений для успешного использования метода.
Protocol
Representative Results
Discussion
Пробоподготовка
Для наноиндентирования на воздухе распространенные методы подготовки включают криосекцию (например, образцов тканей), шлифовку и/или полировку с последующей ультрамикротомией (например, биологические образцы, залитые смолой), ионное измельчение или подгот?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Все эксперименты с АСМ проводились в Лаборатории поверхностных наук (SSL) Университета штата Бойсе. Характеристика SEM проводилась в Государственном центре характеристик материалов штата Бойсе (BSCMC). Исследования, представленные в этой публикации в отношении сырья для биотоплива, были частично поддержаны Министерством энергетики США, Управлением по энергоэффективности и возобновляемым источникам энергии, Управлением биоэнергетических технологий в рамках Консорциума интерфейса преобразования сырья (FCIC) и в соответствии с контрактом Операционного офиса Министерства энергетики Айдахо DE-AC07-051ID14517. Исследования клеточной механики были поддержаны Национальными институтами здравоохранения (США) в рамках грантов AG059923, AR075803 и P20GM109095, а также грантами Национального научного фонда (США) 1929188 и 2025505. Работа над модельными липидными бислойными системами была поддержана Национальными институтами здравоохранения (США) в рамках гранта R01 EY030067. Авторы благодарят доктора Элтона Грауннарда за создание составного изображения, показанного на рисунке 11.
Materials
| Atomic force microscope | Bruker | Dimension Icon | Uses Nanoscope control software, including PeakForce Quantitative Nanomechanical Mapping (PF-QNM), FastForce Volume (FFV), and Point-and-Shoot Ramping experimental workspaces |
| AtomicJ | American Institute of Physics | https://doi.org/10.1063/1.4881683 | Flexible, powerful, free open source Java-based force curve analysis software package. Supports numerous contact mechanic models, such as Hertz, Sneddon DMT, JKR, Maugis, and cone or pyramid (including blunt and truncated). Also includes a variety of initial contact point estimation methods to choose from. Supports batch processing of data and subsequent statistical analysis (e.g., averages, standard deviations, histograms, goodness of fit, etc.). Literature citation is: P. Hermanowicz, M. Sarna, K. Burda, and H. Gabry , “AtomicJ: An open source software for analysis of force curves” Rev. Sci. Instrum. 85: 063703 (2014), https://doi.org/10.1063/1.4881683 , “AtomicJ: An open source software for analysis of force curves” Rev. Sci. Instrum. 85: 063703 (2014), https://doi.org/10.1063/1.4881683 |
| Buffer solution (PBS) | Fisher Chemical (NaCl), Sigma Aldrich (KCl), Fisher BioReagents (Na2HPO4 and KH2PO4) | S271 (>99% purity NaCl), P9541 (>99% purity KCl), BP332(>99% purity Na2HPO4), BP362 (>99% purity KH2PO4) | Phosphate buffered saline (PBS) was prepared in the laboratory as an aqueous solution consisting of 137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, and 1.8 mM KH2PO4 dissolved in ultrapure water. Reagents were measured out using an analytical balance, and glassware was cleaned with soap and water followed by autoclaving immediately prior to use. |
| Chloroform | |||
| Diamond tip AFM probe | Bruker | PDNISP | Pre-mounted factory-calibrated cube corner diamond (E = 1140 GPa) tip AFM probe (nominal R = 40 nm) with a stainless steel cantilever (nominal k = 225 N/m, f0 = 50 kHz). Spring constant is measured at the factory (k = 256 N/m for the probe, Serial #13435414, used here) and calibration data (including AFM images of indents showing probe geometry) is provided with the probe. |
| Diamond ultramicrotome blade | Diatome | Ultra 35° | 2.1 mm width. Also used a standard glass blade for intial rough cut of sample surface before transitioning to diamond blade for final surface preparation |
| Epoxy | Gorilla Glue | 26853-31-6 | Epoxy resin and hardner were mixed in a 1:1 ratio, a small drop was placed on a stainless steel sample puck (Ted Pella), and V1 grade muscovite mica (Ted Pella) was attached to create an atomically flat surface for preparation of phospholipid membranes. |
| Ethanol | |||
| LR white resin, medium grade (catalyzed) | Electron Microscopy Sciences | 14381 | 500 mL bottle, Lot #150629 |
| Mesenchymal stem cells (MSCs) | N/A | N/A | MSCs for nanomechanical studies were primary cells harvested from 8-10 week old male C57BL/6 mice as described in Goelzer, M. et al. "Lamin A/C Is Dispensable to Mechanical Repression of Adipogenesis" Int J Mol Sci 22: 6580 (2021) doi:10.3390/ijms22126580 and Peister, A. et al. "Adult stem cells from bone marrow (MSCs) isolated from different strains of inbred mice vary in surface epitopes, rates of proliferation, and differentiation potential" Blood 103: 1662-1668 (2004), doi:10.1182/blood-2003-09-3070. |
| Modulus standards | Bruker | PFQNM-SMPKIT-12M | Used HOPG (E = 18 GPa) and PS (E = 2.7 GPa). Also contains 2x PDMS (Tack 0, E = 2.5 MPa; Tack 4, E = 3.5 MPa), PS-LDPE (E = 2.0/0.2 GPa), fused silica (E = 72.9 GPa), sapphire (E – 345 GPa), and tip characterization (titanium roughness) sample. All samples come pre-mounted on a 12 mm diameter steel disc (sample puck). |
| Muscovite mica | Ted Pella | 50-12 | 12 mm diameter, V1 grade muscovite mica |
| Nanscope Analysis | Bruker | Version 2.0 | Free AFM image processing and analysis software package, but designed for, and proprietary/limited to Bruker AFMs; similar functionality is available from free, platform-independent AFM image processing and analysis software packages such as Gwyddion, WSxM, and others. Has built-in capabilities for force curve analysis, but AtomicJ is more flexible/full featured (e.g., more built-in contact mechanics models to choose from, statistical analysis of force curve fitting results, etc.) for force curve analysis and handles batch processing of force curves. |
| Phospholipids: POPC, Cholesterol (ovine) | Avanti Polar Lipids | POPC: CAS # 26853-31-6, Cholesterol: CAS # 57-88-5 | POPC lipid dissolved in chloroform (25 mg/mL) was obtained from vendor and used without further purification. Cholesterol powder from the same vendor was dissolved in chloroform (20 mg/mL). |
| Probe holder (fluid, lipid bilayers) | Bruker | MTFML-V2 | Specific to the particular AFM used; MTFML-V2 is a glass probe holder for scanning in fluid on a MultiMode AFM. |
| Probe holder (fluid, MSCs) | Bruker | FastScan Bio Z-scanner | Used with Dimension FastScan head (XY flexure scanners). Serial number MXYPOM5-1B154. |
| Probe holder (standard, ambient) | Bruker | DAFMCH | Specific to the particular AFM used; DAFMCH is the standard contact and tapping mode probe holder for the Dimension Icon AFM, suitable for nanoindentation (PF-QNM, FFV, and point-and-shoot ramping) |
| Sample Puck | Ted Pella | 16218 | Product number is for 15 mm diameter stainless steel sample puck. Also available in 6 mm, 10 mm, 12 mm, and 20 mm diameters at https://www.tedpella.com/AFM_html/AFM.aspx#anchor842459 |
| Sapphire substrate | Bruker | PFQNM-SMPKIT-12M | Extremely hard surface (E = 345 GPa) for measuring deflection sensitivity of probes (want all of the deflection to come from the probe, not the substrate). Part of the PF-QNM/modulus standards kit. |
| Scanning electron microscope | Hitachi | S-3400N-II | Located at Boise State. Used to perform co-localized SEM/EDS on all samples except additively manufactured (AM) Ti-6Al-4V. |
| Silicon AFM probes (standard) | NuNano | Scout 350 | Standard tapping mode silicon probe with reflective aluminum backside coating; k = 42 N/m (nominal), f0 = 350 kHz. Nominal R = 5 nm. Also available uncoated or with reflective gold backside coating. Probes with similar specifications are available from other manufacturers (e.g., Bruker TESPA-V2). |
| Silicon AFM probes (stiff) | Bruker | RTESPA-525, RTESPA-525-30 | Rotated tip etched silicon probes with reflective aluminum backside coating; k = 200 N/m (nominal), f0 = 525 kHz. Nominal R = 8 nm for RTESPA-525, R = 30 nm for RTESPA-525-30. Spring constant of each RTESPA-525-30 is measured individually at the factory via laser Doppler vibrometry and supplied with the probe. |
| Silicon carbide grit paper (abrasive discs) | Allied | 50-10005 | 120 grit |
| Silicon nitride AFM probes (soft, large radius hemispherical tip) | Bruker | MLCT-SPH-5UM, MLCT-SPH-5UM-DC | Also MLCT-SPH-1UM-DC. New product line of factory-calibrated (probe radius and spring constants of all cantilevers) large radius (R = 1 or 5 mm) hemispherical tip (at the end of a 23 mm long cylindrical shaft) probes. DC = drift compensation coating. 6 cantilevers/probe (A-F). Nominal spring constants: A, k = 0.07 N/m; B, k = 0.02 N/m; C, k = 0.01 N/m; D, k = 0.03 N/m; E, k = 0.1 N/m; F, k = 0.6 N/m. |
| Silicon nitride AFM probes (soft, medium sharp tip) | Bruker | DNP | 4 cantilevers/probe (A-d). Nominal spring constants: A, k = 0.35 N/m; B, k = 0.12 N/m; C, k = 0.24 N/m; D, k = 0.06 N/m. Nominal radii of curvature, R = 10 nm. |
| Silicon nitride AFM probes (soft, sharp tip) | Bruker | ScanAsyst-Air | Nominal values: resonance frequency, f0 = 70 kHz; spring constant, k = 0.4 N/m; radius of curvature, R = 2 nm. Designed for force curve based AFM imaging. |
| Superglue | Henkel | Loctite 495 | Cyanoacrylate based instant adhesive. Lots of roughly equivalent products are readily available. |
| Syringe pump | New Era Pump Systems | NE1000US | One channel syringe pump system with infusion and withdrawal capacity |
| Tip characterization standard | Bruker | PFQNM-SMPKIT-12M | Titanium (Ti) roughness standard. Part of the PF-QNM/modulus standards kit. |
| Ultrahigh purity nitrogen (UHP N2), 99.999% | Norco | SPG TUHPNI – T | T size compressed gas cylinder of ultrahigh purity (99.999%) nitrogen for drying samples |
| Ultramicrotome | Leica | EM UC6 | Equipped with a glass blade (standard, for intial sample preparation) and a diamond blade (for final preparation) |
| Ultrapure water | Thermo Fisher | Barnstead Nanopure Model 7146 | Model has been discontinued, but equivalent products are available. Produces ≥18.2 MΩ*cm ultrapure water with 1-5 ppb TOC (total organic content), per inline UV monitoring. Includes 0.2 µm particulate filter, ion exchange columns, and UV oxidation chamber. |
| Variable Speed Grinder | Buehler | EcoMet 3000 | Used with silicon carbide grit papers during hand polishing. |
| Vibration isolation table (active) | Herzan | TS-140 | Used with Bruker MultiMode AFM. Sits on a TMC 65-531 vibration isolation table. Bruker Dimension Icon AFM utilizes strictly passive vibration isolation (comes from manufacturer with custom acoustic hood, air table, and granite slab). |
| Vibration isolation table (passive) | TMC | 65-531 | 35" x 30" vibration isolation table with optional air damping (disabled). Used with Bruker MultiMode AFM. Herzan TS-140 "Table Stable" active vibration control table is located on top. |
References
- Hart, E. W. Theory of the tensile test. Acta Metallurgica. 15 (2), 351-355 (1967).
- Fell, J. T., Newton, J. M. Determination of tablet strength by the diametral-compression test. Journal of Pharmaceutical Sciences. 59 (5), 688-691 (1970).
- Babiak, M., Gaff, M., Sikora, A., Hysek, &. #. 3. 5. 2. ;. Modulus of elasticity in three- and four-point bending of wood. Composite Structures. 204, 454-465 (2018).
- Song, S., Yovanovich, M. M. Relative contact pressure-Dependence on surface roughness and Vickers microhardness. Journal of Thermophysics and Heat Transfer. 2 (1), 43-47 (1988).
- Hays, C., Kendall, E. G. An analysis of Knoop microhardness. Metallography. 6 (4), 275-282 (1973).
- Hill, R., Storåkers, B., Zdunek, A. B. A theoretical study of the Brinell hardness test. Proceedings of the Royal Society of London. A. Mathematical and Physical Sciences. 423 (1865), 301-330 (1989).
- Oliver, W. C., Pharr, G. M. An improved technique for determining hardness and elastic modulus using load and displacement sensing indentation experiments. Journal of Materials Research. 7 (6), 1564-1583 (1992).
- Sakharova, N. A., Fernandes, J. V., Antunes, J. M., Oliveira, M. C. Comparison between Berkovich, Vickers and conical indentation tests: A three-dimensional numerical simulation study. International Journal of Solids and Structures. 46 (5), 1095-1104 (2009).
- Cohen, S. R., Kalfon-Cohen, E. Dynamic nanoindentation by instrumented nanoindentation and force microscopy: a comparative review. Beilstein Journal of Nanotechnology. 4 (1), 815-833 (2013).
- Saha, R., Nix, W. D. Effects of the substrate on the determination of thin film mechanical properties by nanoindentation. Acta Materialia. 50 (1), 23-38 (2002).
- Tsui, T. Y., Pharr, G. M. Substrate effects on nanoindentation mechanical property measurement of soft films on hard substrates. Journal of Materials Research. 14 (1), 292-301 (1999).
- Cao, G., Gao, H. Mechanical properties characterization of two-dimensional materials via nanoindentation experiments. Progress in Materials Science. 103, 558-595 (2019).
- Castellanos-Gomez, A., Singh, V., vander Zant, H. S. J., Steele, G. A. Mechanics of freely-suspended ultrathin layered materials. Annalen der Physik. 527 (1-2), 27-44 (2015).
- Cao, C., Sun, Y., Filleter, T. Characterizing mechanical behavior of atomically thin films: A review. Journal of Materials Research. 29 (3), 338-347 (2014).
- Lee, C., Wei, X., Kysar, J. W., Hone, J. Measurement of the elastic properties and intrinsic strength of monolayer graphene. Science. 321 (5887), 385-388 (2008).
- Elibol, K., et al. Visualising the strain distribution in suspended two-dimensional materials under local deformation. Scientific Reports. 6 (1), 28485 (2016).
- Castellanos-Gomez, A., et al. Mechanical properties of freely suspended atomically thin dielectric layers of mica. Nano Research. 5 (8), 550-557 (2012).
- Song, L., et al. Large scale growth and characterization of atomic hexagonal boron nitride layers. Nano Letters. 10 (8), 3209-3215 (2010).
- Castellanos-Gomez, A., et al. Elastic properties of freely suspended MoS2 nanosheets. Advanced Materials. 24 (6), 772-775 (2012).
- D’Costa, N. P., Hoh, J. H. Calibration of optical lever sensitivity for atomic force microscopy. Review of Scientific Instruments. 66 (10), 5096-5097 (1995).
- Wu, Y., et al. Evaluation of elastic modulus and hardness of crop stalks cell walls by nano-indentation. Bioresource Technology. 101 (8), 2867-2871 (2010).
- Barns, S., et al. Investigation of red blood cell mechanical properties using AFM indentation and coarse-grained particle method. BioMedical Engineering OnLine. 16 (1), 140 (2017).
- Hermanowicz, P., Sarna, M., Burda, K., Gabryś, H. AtomicJ: An open source software for analysis of force curves. Review of Scientific Instruments. 85 (6), 063703 (2014).
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: a critical overview. Tribology Letters. 65 (1), 23 (2016).
- Tiwari, A. . Nanomechanical Analysis of High Performance Materials. , (2015).
- Aggarwal, R. L., Ramdas, A. K. . Physical Properties of Diamond and Sapphire. , (2019).
- Boyd, E. J., Uttamchandani, D. Measurement of the anisotropy of Young’s modulus in single-crystal silicon. Journal of Microelectromechanical Systems. 21 (1), 243-249 (2012).
- Harding, J. W., Sneddon, I. N. The elastic stresses produced by the indentation of the plane surface of a semi-infinite elastic solid by a rigid punch. Mathematical Proceedings of the Cambridge Philosophical Society. 41 (1), 16-26 (2008).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis-I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129 (3), 430-440 (2006).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis-II: Adhesion-influenced indentation of soft, elastic materials. Journal of Biomechanical Engineering. 129 (6), 904-912 (2007).
- Haile, S., Palmer, M., Otey, A. Potential of loblolly pine: switchgrass alley cropping for provision of biofuel feedstock. Agroforestry Systems. 90 (5), 763-771 (2016).
- Lu, X., et al. Biomass logistics analysis for large scale biofuel production: Case study of loblolly pine and switchgrass. Bioresource Technology. 183, 1-9 (2015).
- Susaeta, A., Lal, P., Alavalapati, J., Mercer, E., Carter, D. Economics of intercropping loblolly pine and switchgrass for bioenergy markets in the southeastern United States. Agroforestry Systems. 86 (2), 287-298 (2012).
- Garcia, R. Nanomechanical mapping of soft materials with the atomic force microscope: methods, theory and applications. Chemical Society Reviews. 49 (16), 5850-5884 (2020).
- Derjaguin, B. V., Muller, V. M., Toporov, Y. P. Effect of contact deformations on the adhesion of particles. Journal of Colloid and Interface Science. 53 (2), 314-326 (1975).
- Ciesielski, P. N., et al. Engineering plant cell walls: tuning lignin monomer composition for deconstructable biofuel feedstocks or resilient biomaterials. Green Chemistry. 16 (5), 2627-2635 (2014).
- Liu, K., Ostadhassan, M., Zhou, J., Gentzis, T., Rezaee, R. Nanoscale pore structure characterization of the Bakken shale in the USA. Fuel. 209, 567-578 (2017).
- Maryon, O. O., et al. Co-localizing Kelvin probe force microscopy with other microscopies and spectroscopies: selected applications in corrosion characterization of alloys. JoVE. (184), e64102 (2022).
- Eliyahu, M., Emmanuel, S., Day-Stirrat, R. J., Macaulay, C. I. Mechanical properties of organic matter in shales mapped at the nanometer scale. Marine and Petroleum Geology. 59, 294-304 (2015).
- Li, C., et al. Nanomechanical characterization of organic matter in the Bakken formation by microscopy-based method. Marine and Petroleum Geology. 96, 128-138 (2018).
- Bouzid, T., et al. The LINC complex, mechanotransduction, and mesenchymal stem cell function and fate. Journal of Biological Engineering. 13 (1), 68 (2019).
- Dupont, S., et al. Role of YAP/TAZ in mechanotransduction. Nature. 474 (7350), 179-183 (2011).
- Wang, S., et al. CCM3 is a gatekeeper in focal adhesions regulating mechanotransduction and YAP/TAZ signalling. Nature Cell Biology. 23 (7), 758-770 (2021).
- Sen, B., et al. Mechanical strain inhibits adipogenesis in mesenchymal stem cells by stimulating a durable β-catenin signal. Endocrinology. 149 (12), 6065-6075 (2008).
- Sen, B., et al. mTORC2 regulates mechanically induced cytoskeletal reorganization and lineage selection in marrow-derived mesenchymal stem cells. Journal of Bone and Mineral Research. 29 (1), 78-89 (2014).
- Sen, B., et al. Mechanically induced nuclear shuttling of β-catenin requires co-transfer of actin. Stem Cells. 40 (4), 423-434 (2022).
- Newberg, J., et al. Isolated nuclei stiffen in response to low intensity vibration. Journal of Biomechanics. 111, 110012 (2020).
- Ding, Y., Xu, G. -. K., Wang, G. -. F. On the determination of elastic moduli of cells by AFM based indentation. Scientific Reports. 7 (1), 45575 (2017).
- Khadka, N. K., Timsina, R., Rowe, E., O’Dell, M., Mainali, L. Mechanical properties of the high cholesterol-containing membrane: An AFM study. Biochimica et Biophysica Acta. Biomembranes. 1863 (8), 183625 (2021).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surface Science Reports. 61 (10), 429-444 (2006).
- Qian, L., Zhao, H. Nanoindentation of soft biological materials. Micromachines. 9 (12), 654 (2018).
- Pittenger, B., Yablon, D. Improving the accuracy of nanomechanical measurements with force-curve-based AFM techniques. Bruker Application Notes. 149, (2017).
- Vorselen, D., Kooreman, E. S., Wuite, G. J. L., Roos, W. H. Controlled tip wear on high roughness surfaces yields gradual broadening and rounding of cantilever tips. Scientific Reports. 6 (1), 36972 (2016).
- Bhaskaran, H., et al. Ultralow nanoscale wear through atom-by-atom attrition in silicon-containing diamond-like carbon. Nature Nanotechnology. 5 (3), 181-185 (2010).
- Giannazzo, F., Schilirò, E., Greco, G., Roccaforte, F. Conductive atomic force microscopy of semiconducting transition metal dichalcogenides and heterostructures. Nanomaterials. 10 (4), 803 (2020).
- Melitz, W., Shen, J., Kummel, A. C., Lee, S. Kelvin probe force microscopy and its application. Surface Science Reports. 66 (1), 1-27 (2011).
- Kazakova, O., et al. Frontiers of magnetic force microscopy. Journal of Applied Physics. 125 (6), 060901 (2019).
- Kim, H. -. J., Yoo, S. -. S., Kim, D. -. E. Nano-scale wear: A review. International Journal of Precision Engineering and Manufacturing. 13 (9), 1709-1718 (2012).
- Heath, G. R., et al. Localization atomic force microscopy. Nature. 594 (7863), 385-390 (2021).
- Strahlendorff, T., Dai, G., Bergmann, D., Tutsch, R. Tip wear and tip breakage in high-speed atomic force microscopes. Ultramicroscopy. 201, 28-37 (2019).
- Lantz, M. A., et al. Wear-resistant nanoscale silicon carbide tips for scanning probe applications. Advanced Functional Materials. 22 (8), 1639-1645 (2012).
- Khurshudov, A. G., Kato, K., Koide, H. Wear of the AFM diamond tip sliding against silicon. Wear. 203, 22-27 (1997).
- Villarrubia, J. S. Algorithms for scanned probe microscope image simulation, surface reconstruction, and tip estimation. Journal of Research of the National Institute of Standards and Technology. 102 (4), 425 (1997).
- Kain, L., et al. Calibration of colloidal probes with atomic force microscopy for micromechanical assessment. Journal of the Mechanical Behavior of Biomedical Materials. 85, 225-236 (2018).
- Slattery, A. D., Blanch, A. J., Quinton, J. S., Gibson, C. T. Accurate measurement of Atomic Force Microscope cantilever deflection excluding tip-surface contact with application to force calibration. Ultramicroscopy. 131, 46-55 (2013).
- Dobrovinskaya, E. R., Lytvynov, L. A., Pishchik, V. . Sapphire: Material, Manufacturing, Applications. , (2009).
- te Riet, J., et al. Interlaboratory round robin on cantilever calibration for AFM force spectroscopy. Ultramicroscopy. 111 (12), 1659-1669 (2011).
- Pratt, J. R., Shaw, G. A., Kumanchik, L., Burnham, N. A. Quantitative assessment of sample stiffness and sliding friction from force curves in atomic force microscopy. Journal of Applied Physics. 107 (4), 044305 (2010).
- Slattery, A. D., Blanch, A. J., Quinton, J. S., Gibson, C. T. Calibration of atomic force microscope cantilevers using standard and inverted static methods assisted by FIB-milled spatial markers. Nanotechnology. 24 (1), 015710 (2012).
- Higgins, M. J., et al. Noninvasive determination of optical lever sensitivity in atomic force microscopy. Review of Scientific Instruments. 77 (1), 013701 (2006).
- Lévy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13 (1), 33-37 (2001).
- Sikora, A. Quantitative normal force measurements by means of atomic force microscopy towards the accurate and easy spring constant determination. Nanoscience and Nanometrology. 2 (1), 8-29 (2016).
- Ohler, B. Cantilever spring constant calibration using laser Doppler vibrometry. Review of Scientific Instruments. 78 (6), 063701 (2007).
- Gates, R. S., Pratt, J. R. Accurate and precise calibration of AFM cantilever spring constants using laser Doppler vibrometry. Nanotechnology. 23 (37), 375702 (2012).
- Cleveland, J. P., Manne, S., Bocek, D., Hansma, P. K. A nondestructive method for determining the spring constant of cantilevers for scanning force microscopy. Review of Scientific Instruments. 64 (2), 403-405 (1993).
- Sader, J. E., Chon, J. W. M., Mulvaney, P. Calibration of rectangular atomic force microscope cantilevers. Review of Scientific Instruments. 70 (10), 3967-3969 (1999).
- Sader, J. E., et al. Spring constant calibration of atomic force microscope cantilevers of arbitrary shape. Review of Scientific Instruments. 83 (10), 103705 (2012).
- Sader, J. E. Frequency response of cantilever beams immersed in viscous fluids with applications to the atomic force microscope. Journal of Applied Physics. 84 (1), 64-76 (1998).
- Sader, J. E., Pacifico, J., Green, C. P., Mulvaney, P. General scaling law for stiffness measurement of small bodies with applications to the atomic force microscope. Journal of Applied Physics. 97 (12), 124903 (2005).
- Mendels, D. -. A., et al. Dynamic properties of AFM cantilevers and the calibration of their spring constants. Journal of Micromechanics and Microengineering. 16 (8), 1720-1733 (2006).
- Gao, S., Brand, U. In-situ nondestructive characterization of the normal spring constant of AFM cantilevers. Measurement Science and Technology. 25 (4), 044014 (2014).
- Gibson, C. T., Watson, G. S., Myhra, S. Determination of the spring constants of probes for force microscopy/spectroscopy. Nanotechnology. 7 (3), 259-262 (1996).
- Gates, R. S., Pratt, J. R. Prototype cantilevers for SI-traceable nanonewton force calibration. Measurement Science and Technology. 17 (10), 2852-2860 (2006).
- Neumeister, J. M., Ducker, W. A. Lateral, normal, and longitudinal spring constants of atomic force microscopy cantilevers. Review of Scientific Instruments. 65 (8), 2527-2531 (1994).
- Kim, M. S., Choi, I. M., Park, Y. K., Kang, D. I. Atomic force microscope probe calibration by use of a commercial precision balance. Measurement. 40 (7), 741-745 (2007).
- Kim, M. -. S., Choi, J. -. H., Park, Y. -. K., Kim, J. -. H. Atomic force microscope cantilever calibration device for quantified force metrology at micro- or nano-scale regime: the nano force calibrator (NFC). Metrologia. 43 (5), 389-395 (2006).
- Tian, Y., et al. A novel method and system for calibrating the spring constant of atomic force microscope cantilever based on electromagnetic actuation. Review of Scientific Instruments. 89 (12), 125119 (2018).
- Clifford, C. A., Seah, M. P. The determination of atomic force microscope cantilever spring constants via dimensional methods for nanomechanical analysis. Nanotechnology. 16 (9), 1666-1680 (2005).
- Chen, B. -. Y., Yeh, M. -. K., Tai, N. -. H. Accuracy of the spring constant of atomic force microscopy cantilevers by finite element method. Analytical Chemistry. 79 (4), 1333-1338 (2007).
- Mick, U., Eichhorn, V., Wortmann, T., Diederichs, C., Fatikow, S. Combined nanorobotic AFM/SEM system as novel toolbox for automated hybrid analysis and manipulation of nanoscale objects. 2010 IEEE International Conference on Robotics and Automation. , 4088-4093 (2010).
- Kim, M. -. S., Choi, J. -. H., Kim, J. -. H., Park, Y. -. K. Accurate determination of spring constant of atomic force microscope cantilevers and comparison with other methods. Measurement. 43 (4), 520 (2010).
- Zhang, G., Wei, Z., Ferrell, R. E. Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation. Applied Clay Science. 43 (2), 271-281 (2009).
- Bobko, C. P., Ortega, J. A., Ulm, F. -. J. Comment on "Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation by G. Zhang, Z. Wei and R.E. Ferrell. Applied Clay Science. 46 (4), 425-428 (2009).
- Zhang, G., Wei, Z., Ferrell, R. E. Reply to the Comment on "Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation" by G. Zhang, Z. Wei and R. E. Ferrell. Applied Clay Science. 46 (4), 429-432 (2009).
- Jin, D. W., et al. Thermal stability and Young’s modulus of mechanically exfoliated flexible mica. Current Applied Physics. 18 (12), 1486-1491 (2018).
- Xiao, J., et al. Anisotropic friction behaviour of highly oriented pyrolytic graphite. Carbon. 65, 53-62 (2013).
- Hertz, H. Ueber die Berührung fester elastischer Körper. Journal für die reine und angewandte Mathematik. 1882 (92), 156-171 (1882).
- Johnson, K. L., Kendall, K., Roberts, A. D., Tabor, D. Surface energy and the contact of elastic solids. Proceedings of the Royal Society of London. A. Mathematical and Physical Sciences. 324 (1558), 301-313 (1971).
- Muller, V. M., Derjaguin, B. V., Toporov, Y. P. On two methods of calculation of the force of sticking of an elastic sphere to a rigid plane. Colloids and Surfaces. 7 (3), 251-259 (1983).
- Maugis, D. Adhesion of spheres: The JKR-DMT transition using a dugdale model. Journal of Colloid and Interface Science. 150 (1), 243-269 (1992).
- Muller, V. M., Yushchenko, V. S., Derjaguin, B. V. On the influence of molecular forces on the deformation of an elastic sphere and its sticking to a rigid plane. Journal of Colloid and Interface Science. 77 (1), 91-101 (1980).
- Muller, V. M., Yushchenko, V. S., Derjaguin, B. V. General theoretical consideration of the influence of surface forces on contact deformations and the reciprocal adhesion of elastic spherical particles. Journal of Colloid and Interface Science. 92 (1), 92-101 (1983).
- Johnson, K. L., Greenwood, J. A. An adhesion map for the contact of elastic spheres. Journal of Colloid and Interface Science. 192 (2), 326-333 (1997).
- Shi, X., Zhao, Y. -. P. Comparison of various adhesion contact theories and the influence of dimensionless load parameter. Journal of Adhesion Science and Technology. 18 (1), 55-68 (2004).

