Introduction
methyltransferase Phosphatidylethanolamine אנזימים (PEMT) לזרז את הקובץ המצורף קוולנטיים של קבוצות מתיל אחד או יותר באמצעות -adenosylmethionine S (SAM) כתורם קבוצה מתיל על PE, monomethyl-PE או דימתיל-PE לתת monomethyl-PE, דימתיל-PE ו / או phosphatidylcholine (PC). אנזימים אלה הם כמעט בכל מקום בתאים של בעלי חיים ופטריות. ניתן גם למצוא אותם בכמה צמחים 1 וכ -10% מחיידקים, במיוחד אלה שאינטראקציה עם אאוקריוטים 2.
PEMTs רלוונטי לביולוגיה של התא לא רק על ידי תרומה לייצור של מחשב, אשר הוא ברמת שומנים בדם העיקרית בתאים של בעלי חיים, אלא גם על ידי מילוי תפקודים תאיים חשובים נוספים. ביונקים, PEMTs באים לידי ביטוי בעיקר בכבד שבו הם נדרשים להפרשה נורמלית של ליפופרוטאין בצפיפות נמוכה מאוד, והם גם תורמים להשמנה יתר הנגרם דיאטה 3, טרשת עורקים 4, ואינסולין להתנגדאהה 5. בנוסף, PEMT יונקים גם באו לידי ביטוי בתאי שומן, אם כי לרמות נמוכות יותר, ולהשתתף בתצהיר שומן 6, 7. תפקיד PEMT בהתפתחות סרטן 8, 9 אפופטוזיס, ו- 10 צמיחת תאים גם הוכח. בחיידקים, אנזימי PEMT הוכחו להיות חשוב לצמיחה נורמלית של תאי 2, ארסיות 2, וסימביוזה עם צמח המארח 11.
המטרה והרציונל של הפרוטוקול הנוכחי הוא למדוד פעילות PEMT מתמציות תא שלמות ללא הצורך לטהר את האנזים. שני פרוטוקולים שונים פותחו כדי למדוד את פעילות PEMT. אחד הראשון והנפוץ ביותר מודד את העברת קבוצה מתיל tritiated מSAM רדיואקטיבי על PE, אשר הוא הנושא של מאמר זה. פרוטוקול זה פותח במקור כדי למדוד את פעילות PEMT משמרים 12 ותאי יונקים (כבד) 13 כדי לקבל understanding של ביוסינתזה מחשב בתאים אלה, כמו גם כדי לקבוע את הספציפיות של אנזימים אלה. מאוחר יותר, בטכניקה זו יושמה לסוגי תאים אחרים, כגון חיידקים 2 (באמצעות ערך ה- pH בסיסי עבור assay למרות 15) וטפילי protozoan 14. טכניקה זו יכולה לשמש עם תמציות תא שלמות, כמו גם אנזים מטוהר, וניתן ליישם פוטנציאלי לכל מערכת תמצית תא. Assay רדיואקטיבי שאינו גם תוכנן שמסתמך על הכימות האנזימטית של -adenosylhomocysteine S, מוצר transmethylation של SAM 16. Assay האחרון עשוי להיות נוח יותר כפי שהוא אינו כרוך בקרינה רדיואקטיבית, אבל זה מתאים רק לאנזימים מטוהרים.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
הכנת תמצית 1. תא
- לגדול תאי שושנת יריחו בבקבוק סטרילי פלסטיק האטומים עם כובע הדוק אוויר ב 26 מעלות צלזיוס במדיום עשוי 1x M199 בתוספת 20 מ"מ HEPES pH7.4, 100 U / פניצילין מיליליטר, 100 מיקרוגרם / מיליליטר סטרפטומיצין, 5 מיקרוגרם / מיליליטר heme , 0.35 גר '/ L Naco 2 H, 0.1 אדנין מ"מ, ו -2 מיקרוגרם / מיליליטר biopterin בלי ללחוץ. קציר התאים על ידי צנטריפוגה ב 1500 גרם במשך 5 דקות ב 4 מעלות צלזיוס, כאשר הם מגיעים צפיפות תאים של 1-2 x 10 7 / מיליליטר.
- בטל supernatant עם טפטפת ולשטוף את התאים על ידי resuspending התא גלולה עם pipet סרולוגיות במחצית של תרבות הנפח של פוספט הקר שנאגרו (137 מ"מ NaCl, 2.7 מ"מ KCl, 10 מ"מ Na 2 4 HPO, 1.8 מ"מ KH 2 4 PO, pH7.4). השלך supernatants תא לפי הנחיות בטיחות BL2.
- תאי צנטריפוגה שוב ב 1500 גרם במשך 5 דקות ב 4 מעלות צלזיוס. בטל supernatant עם טפטפת. המשך to השלב הבא או הצמד להקפיא את התא גלולה בחנקן נוזלי לאחסון לטווח ארוך ב -80 מעלות צלזיוס (עד שלושה חודשים).
- הכן מאגר תמוגה 2x (0.5 M סוכרוז, 0.1 מ 'TrisHCl, pH7.5, 2 מ"מ EDTA, ומעכב פרוטאז 2x קוקטייל) ולשמור אותו על 4 מעלות צלזיוס על קרח.
- Resuspend התא גלולה (טרי או קפוא) בנפח שווה של חיץ תמוגה 2x. להוסיף נפח 1x של חרוזי זכוכית. וורטקס במרץ ב 4 מעלות צלזיוס במשך 10 דקות.
- הוסף 2 כרכים של חיץ תמוגה 1x ומערבבים. תמציות תא צנטריפוגה ב 1500 XG ב 4 מעלות צלזיוס במשך 10 דקות עד גלולה תאים וגרעינים רצופים.
- מעבירים את supernatant עם pipet לתוך צינור צנטריפוגות מגניב טרי ולשמור תמציות תא על קרח עד להשלמת הניסוי.
2. לקבוע את ריכוז החלבון של תמצית הנייד באמצעות ערכת הערכת חלבון כמו Bicinchoninic החומצה Assay
- פתרון להכין את חומצת bicinchoninic (BCA) (1 מיליליטר / צינור) על ידי ערבוב BCA והנחושת (II) שלulfate ביחס של 49: 1 (V / V).
- הכן את הסטנדרטים החלבון של 0, 10, 20, 30, 40, 50, ו -60 מיקרוגרם / מיליליטר ידי דילול 10 מ"ג / פתרון מניות אלבומין בסרום שור (BSA) מיליליטר לתוך 1 מיליליטר aliquots של פתרון BCA.
- הוסף 2 μl של תמציות תאים ב 1 מיליליטר של פתרון BCA בכפילויות. דגירה סטנדרטים ודגימות חלבון במשך 10 דקות באמבט מים C מראש חימם 60 °.
- להעברת דגימות קרח במשך 3 דקות. מדוד את הספיגה של הסטנדרטים ודגימות החלבון עם ספקטרופוטומטר באורך גל של 562 ננומטר.
- חשב את ריכוז החלבון של תמציות התא באמצעות התקן כהתייחסות כמתואר בפרוטוקול של היצרן BSA. לדלל תמציות תא לריכוז חלבון של 10 מ"ג / מיליליטר עם חיץ תמוגה 1x.
3. אנזימתי Assay ב200 μl לכל צינור
הערה: קח את השלבים הבאים במנדף כימי.
- בדוק כל דגימה בשני עותקים ב15 מיליליטרצינור חרוטי. הכן 20 μl 1 M TrisHCl pH 7.5 לכל צינור ולשמור אותו על קרח. להכין 2 מיליליטר של כלורופורם / מתנול (1: 1 (V / V); עצירת פתרון) ב RT עבור כל צינור.
- Pipet 20 μl של 1 M TrisHCl pH 7.5 בכל צינור חרוטי 15 מיליליטר על קרח.
- פעל לפי הנחיות בטיחות קרינה מכאן והלאה. הוסף את המקבילה של 0.06 מיקרומטר (0.2 μCi) S - [Methyl- H 3] adenosyl-L-מתיונין ו -50 מיקרומטר SAM הקר לכל צינור לסך של 50.06 מיקרומטר של SAM. להוסיף x μl של מים קרים שבו x = 200 (20 (לחיץ) + 20 (לתמציות תא) + נפח של SAM הקר ורדיואקטיבי) לכל צינור.
- העבר את כל צינור חרוטי לאמבטית מים 30 מעלות צלזיוס מראש חימם. הוסף לכל צינור 20 μl של תמציות תא (שווה ערך של 200 מיקרוגרם של חלבון) כדי להתחיל את התגובה. דגירה לזמן הרצוי (0-45 דקות).
- לעצור את התגובה על ידי הוספת 2 מיליליטר של כלורופורם / מתנול (1: 1; / V V; פתרון עצירה) על צינור אחד. העבר את צינור חרוטי לRT (20-256; ג).
4. שומנים הפקה
הערה: קח את השלבים הבאים במנדף כימי.
- להוסיף 700 μl של מים לכל צינור המכיל מדגם התגובה האנזימטית. וורטקס במרץ למשך 30 שניות. צנטריפוגה ב 1500 XG במשך 5 דקות על RT להפריד אורגנית מהשלב המים.
- מעבירים את השלב האורגני הנמוך לתוך צינור חרוטי 15 מיליליטר חדש עם טפטפת. הוסף 1 מיליליטר של מים לכל "שלב תחתון" המכיל צינור ומערבולת במרץ למשך 30 שניות. צנטריפוגה שוב ב 1500 XG במשך 5 דקות להפריד אורגנית מהשלב המים.
- מעבירים את השלב האורגני הנמוך לתוך צינור נצנץ עם טפטפת. דגימות יבשים תחת זרם של N 2. השלך שלבי מים המכילים SAM-רדיואקטיבי שולב אינו וצינורות חרוטי רדיואקטיבי לפי הנחיות קרינה.
- הוסף 2 מיליליטר / שפופרת של נוזל נצנץ. מדוד את הרדיואקטיביות שולבה עם cou נצנץnter על פי הפרוטוקול של היצרנים והשימוש של המכשיר.
- לחשב את הפעילות האנזימטית בnmol / חלבון מ"ג באמצעות המשוואה הכללית הבאה:
[ריכוז מוחלט (רדיואקטיבי וקר) של SAM (מ"מ)] ערך לדקה x 10 x 3 x 5 פעילות ספציפית של SAM רדיואקטיבי (Ci / mmol) x [הריכוז של SAM רדיואקטיבי (מ"מ)]
הערה: הפרוטוקול לעיל ניתן לשנות לריכוז תלוי SAM או assay PEMT תלוי חלבון. עבור assay האנזימטית התלוי ריכוז SAM, הזמן נשמר (15 דקות, שהוא בטווח ליניארי) קבועות וכמויות שונות של SAM הקר מתווספים assay ואילו עבור assay החלבון התלוי PEMT, ריכוז SAM (בחרנו 0.05 מ"מ) וזמן נשמרים (15 דקות) קבועות. גם את ה- pH של המאגר ניתן לשנות בהתאם לצורך, אם יש לי כמה אנזימים PEMT ערך ה- pH אופטימלי שונה.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
איור 1 מציג assay PEMT התלוי זמן, שבוצע עם תמצית כל תא שושנת יריחו כמקור אנזים באמצעות PE אנדוגני כמצע. כמות הרדיואקטיביות בשלב האורגני הייתה לכמת ידי ספירת נצנץ. מספרים וכתוצאה מכך נוצלו כדי לחשב את הסכום של קבוצות מתיל tritiated מועברות על גבי PE. פעילות PEMT הייתה ליניארי לכ 20 דקות. לאחר מכן הוא הגיע לרמה בסביבות 30 דקות, לאחר שזה נשאר קבוע לעוד 15 דקות. כצפוי, פעילות PEMT לא זוהתה כאשר אין תמציות תא נוספו לassay (איור 2). יתר על כן, פעילות זו בוטלה בנוכחות ברומיד octadecyltrimethylammonium 100 מיקרומטר, שהוא מעכב של ל ' methyltransferases PE הגדול Lmj PEM1 וLmj PEM2 14. פעילות PEMT הייתה גם dependen ריכוז חלבוןלא, ופעילות זו הייתה באופן ליניארי פרופורציונלית לכמות החלבון להחיל עבור assay האנזימטית (איור 3). לבסוף, assay PEMT התלוי ריכוז SAM בוצע, שבריכוזים הולכים וגדל של SAM נבדקו (איור 4). פעילות PEMT הגיעה לרמה הריכוז בSAM של כ 0.5 מ"מ. בסך הכל, ארבעת מבחני אלה מראים כי פעילות PEMT היא ספציפית וניתן למדידה מתמציות תא שלמות ללא הצורך לטהר את האנזים (ים).
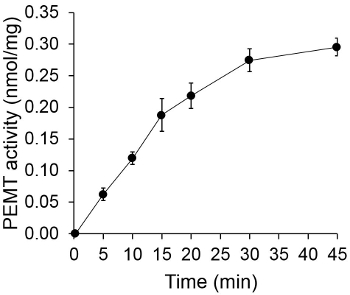
איור 1. זמן assay PEMT התלוי. Assay האנזימטית בוצע פעמיים בכפולות עם 0.2 מ"ג של תמציות תא כל שושנת יריחו כפונקציה של זמן. פעילות PEMT מיוצגת כקבוצות מתיל nmol מועברות על גבי PE למ"ג של חלבון ועמ 'שעה אה. ל" O "זמן, תמציות תא היו מעורבות ראשון עם 2 מיליליטר של תמיסה לעצור עשויה כלורופורם / מתנול (1: 1, לפי נפח) לפני שהוסיפו לפתרון assay המכיל SAM. סטיות תקן מוצגות.
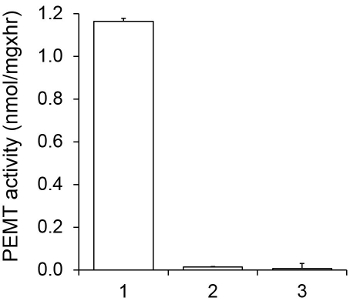
איור 2. ספציפי של PEMT פעילות. Assay PEMT בוצע פעמיים בשני עותקים במשך 15 דקות בנוכחות של 0.05 מ"מ SAM. תמצית חלבון 1, מ"ג 0.2; 2, לא תמצית תא; 3, 0.2 חלבון מ"ג ו -0.1 מ"מ ברומיד octadecyltrimethylammonium. סטיות תקן מוצגות.
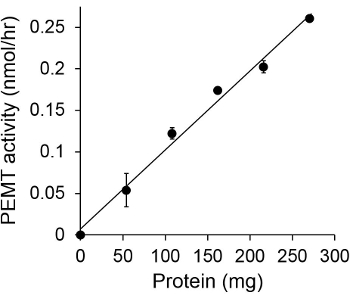
assay PEMT התלוי 3. חלבון איור. assay האנזימטית בוצע פעמיים בלשכפל בהעדר ('O' נקודה) או נוכחות של כמויות שונות של חלבוני שושנת יריחו עם 0.05 מ"מ SAM במשך 15 דקות. סטיות תקן מוצגות.
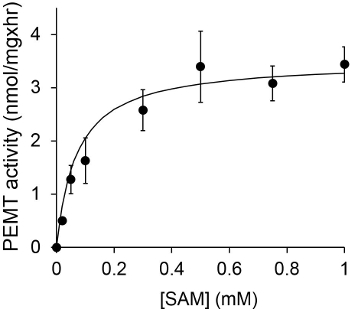
איור 4. assay PEMT בוצע פעמיים בכפולה עם 0.2 מ"ג של תמציות תא שושנת יריחו כל בנוכחות ריכוזים השונים של SAM במשך 15 דקות. סטיות התקן מוצגות.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
assay זה פשוט, מהיר PEMT מאפשר כימות של צורות מפוגלים של PE שנובע מהעברה של קבוצות מתיל רדיואקטיביים מSAM על PE באמצעות תמצית תא כולו כמקור חלבון. הוא מהיר, רגיש, לשחזור, ומתאים גם לאנזימים מטוהרים 17. ניתן להוסיף Monomethyl- או דימתיל-PE לassay אם methyltransferase של עניין הוא ספציפי למצעים אלה ולא לPE 12,13,18,19. אם נעשה שימוש באנזים PEMT מטוהר, ניתן להוסיף PE לassay. הגבלה של פרוטוקול זה היא שassay אינו מזהה את מוצרי תגובות (monomethyl-PE, דימתיל-PE, או מחשב). עם זאת, זהותו של תוצרי התגובה (monomethyl-PE, דימתיל-PE, PC) יכולה עוד להיות מנותחת על ידי כרומטוגרפיה שכבה אחת ממדית דקה כמתואר ב20,21. יתר על כן, חלק מהמוצרים הפגומים SAM כגון -adenosylhomocysteine S ו5'-methylthioadenosine עלול לעכב ב פעילות PEMTעיכוב משוב y. עם זאת, שושנת יריחו בעל hydrolase -adenosylhomocysteine S 22, שדבק S -adenosylhomocysteine לאדנין ו-ribosylhomocysteine S, וphosphorylase methylthioadenosine, אשר מייצר אדנין וmethylthioribose-1-פוספט 23. עם זאת, זה לא ידוע אם hydrolase -adenosylhomocysteine S ופעילויות phosphorylase methylthioadenosine גבוהים מספיק כדי לעכל ביעילות -adenosylhomocysteine S וmethylthioadenosine, בהתאמה, כך שאף עיכוב של פעילות PEMT מתרחש. במקרה S hydrolase -adenosylhomocysteine ו / או אנזים מטבולי 5'-methylthioadenosine נעדרים בתא של עניין, תוספת של האנזימים המטוהרים, רקומביננטי המתאימים ניתן להוסיף לassay כדי להקל על עיכוב משוב על ידי מוצרים פגומים SAM 24,25, 26.
ישנם ארבעה שלבים קריטיים בפרוטוקול זה: I)אבקת מעכבי פרוטאז קוקטייל יש להוסיף למאגר תמוגה רק לפני השימוש (שלב 1.1); ii) כל תא תמציות הן להיות מנוצלת בשעות הבאות לאחר הכנה (לאחר שלב 1.4); iii) במהלך שלבי מיצוי שומנים (שלבים 4.2 ו -4.4), זהירות צריכה להיות מיושמת שלא להעביר כל שלב הביניים או מים, המכיל את SAM tritiated העודף, וiv) לaliquot S רדיואקטיבי - [Methyl- 3 ח] adenosyl-L-מתיונין ומגיב קרים מועד קבלתם כמחזורים חוזרים ונשנים של הקפאה ולהפשיר להשפיל אותו ל5'-methylthioadenosine ולקטון homoserine אחרי הידרוליזה לאדנין וS -pentosylmethionine 26,27,28, אשר עשוי להסביר חוסר פעילות PEMT מדידה. תמציות תא כל רעות יכולות להיות גם אחראית לכל פעילות האנזימטית. במקרה זה, את האיכות של תמצית התא יכולה להיות מוערכת על ידי מדידה אחרת פעילות האנזימטית ידועה. אחרון, חוסר פעילות PEMT רשאי להסתמך על PEMT enתֶסֶס להיות ספציפי לmonomethyl-PE או דימתיל-PE ולא PE. תוספת של monomethyl-PE ו / או מצעי דימתיל-PE לassay יכולה לשחזר את פעילות PEMT.
אלטרנטיבה, assay methyltransferase התלוי SAM לא רדיואקטיבי פותח, המסתמך על הכימות האנזימטית של הומוציסטאין, מוצרי transmethylation של SAM 29. פרוטוקול זה יושם בהצלחה למדידת פעילות methyltransferase הספציפית PE 16. למרבה הצער, assay זה מתאים רק לאנזים מטוהר ולא לתמצית תא כולו, ולא לחשוף את זהותו של תוצרי תגובה או.
הפרוטוקול הנוכחי אולי יכול להיות מיושם על כל סוג תא. בנוסף, assay זה יכול לשמש כדי לבדוק תרופות פוטנציאליות ספציפיות לPEMT של עניין בהקשר של בדיקת תרכובות אנטי-מיקרוביאלי חדשים להילחם בזיהומים חיידקיים או הרפוי רומן נגד טרשת עורקים מושרה דיאטה, השמנת יתר, ועמידות לאינסולין.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
אין ניגוד העניינים הצהיר
Materials
| Name | Company | Catalog Number | Comments |
| S-[Methyl-3H]adenosyl-L-methionine (specific activity of 5-15 Ci/mMole) | Perkin Elmer | NET155050UC | Aliquot the reagent and freeze at -20 °C; follow radiation safety guidelines while using this reagent |
| Protease inhibitor cocktail | Roche Life Sciences | 11836170001 | dilute it fresh |
| Glass beads, acid washed, 425-600 mm | Sigma Aldrich | G8772 | |
| Bicinchoninic acid solution | Sigma Aldrich | B9643 | |
| Copper (II) sulfate | Sigma Aldrich | C2284 | |
| Scintillation counter MicroBeta2 with 1-detector | Perkin Elmer | 2450-0010 | |
| Spectrophotometer Biomate 3 | Thermo Scientific | 840208300 | |
| BSA stock solution (10 mg/ml) | New England Biolabs | B9001S | |
| Scintillation liquid | Research Product International Corp | 111198 | |
| S-(5'-Adenosyl)-L-methionine chloride (hydrochloride) | Cayman Chemicals | 13956 | dilute the reagent in 20 mM HCl and freeze aliquots at -80 °C |
References
- Keogh, M. R., Courtney, P. D., Kinney, A. J., Dewey, R. E. Functional characterization of phospholipid N-.methyltransferases from Arabidopsis and soybean. J Biol Chem. 284 (23), 15439-15447 (2009).
- Geiger, O., Lopez-Lara, I. M., Sohlenkamp, C. Phosphatidylcholine biosynthesis and function in bacteria. Biochim Biophys Acta. 1831 (3), 503-513 (2013).
- Gao, X., et al. Decreased lipogenesis in white adipose tissue contributes to the resistance to high fat diet-induced obesity in phosphatidylethanolamine N-.methyltransferase-deficient mice. Biochim Biophys Acta. 1851 (2), 152-162 (2015).
- Zhao, Y., et al. Lack of phosphatidylethanolamine N-.methyltransferase alters plasma VLDL phospholipids and attenuates atherosclerosis in mice. Arterioscler Thromb Vasc Biol. 29 (9), 1349-1355 (2009).
- Vance, D. E. Phospholipid methylation in mammals: from biochemistry to physiological function. Biochim Biophys Acta. 1838 (6), 1477-1487 (2014).
- Nishimaki-Mogami, T., Suzuki, K., Takahashi, A. The role of phosphatidylethanolamine methylation in the secretion of very low density lipoproteins by cultured rat hepatocytes: rapid inhibition of phosphatidylethanolamine methylation by bezafibrate increases the density of apolipoprotein B48-containing lipoproteins. Biochim Biophys Acta. 1304 (1), 21-31 (1996).
- Noga, A. A., Zhao, Y., Vance, D. E. An unexpected requirement for phosphatidylethanolamine N-.methyltransferase in the secretion of very low density lipoproteins. J Biol Chem. 277 (44), 42358-42365 (2002).
- Li, D., et al. Epigenetic repression of phosphatidylethanolamine N-.methyltransferase (PEMT) in BRCA1-mutated breast cancer. Oncotarget. 5 (5), 1315-1325 (2014).
- Cui, Z., Houweling, M., Vance, D. E. Suppression of rat hepatoma cell growth by expression of phosphatidylethanolamine N-.methyltransferase-2. J Biol Chem. 269 (40), 24531-24533 (1994).
- Cui, Z., Shen, Y. J., Vance, D. E. Inverse correlation between expression of phosphatidylethanolamine.N-.methyltransferase-2 and growth rate of perinatal rat livers. Biochim Biophys Acta. 1346 (1), 10-16 (1997).
- Minder, A. C., de Rudder, K. E., Narberhaus, F., Fischer, H. M., Hennecke, H., Geiger, O. Phosphatidylcholine levels in.Bradyrhizobium japonicum. membranes are critical for an efficient symbiosis with the soybean host plant. Mol Microbiol. 39 (5), 1186-1198 (2001).
- Kodaki, T., Yamashita, S. Yeast phosphatidylethanolamine methylation pathway. Cloning and characterization of two distinct methyltransferase genes. J Biol Chem. 262 (32), 15428-15435 (1987).
- Tanaka, Y., Amano, F., Maeda, M., Nishijima, M., Akamatsu, Y. Purification and properties of phosphatidyl-N-.monomethylethanolamine N-.methyltransferase, the enzyme catalyzing the second and the third steps in the phosphatidylethanolamine N-.methyltransferase system, from mouse liver microsomes. Jpn J Med Sci Biol. 43 (3), 59-73 (1990).
- Bibis, S. S., Dahlstrom, K., Zhu, T., Zufferey, R. Characterization of Leishmania major phosphatidylethanolamine methyltransferases LmjPEM1 and LmjPEM2 and their inhibition by choline analogs. Mol Biochem Parasitol. 196 (2), 90-99 (2014).
- deRudder, K. E., Thomas-Oates, J. E., Geiger, O. Rhizobium meliloti. mutants deficient in phospholipid N-.methyltransferase still contain phosphatidylcholine. J Bacteriol. 179 (22), 6921-6928 (1997).
- Aktas, M., Narberhaus, F. In vitro characterization of the enzyme properties of the phospholipid N-.methyltransferase PmtA from Agrobacterium tumefaciens. J Bacteriol. 191 (7), 2033-2041 (2009).
- Ridgway, N. D., Vance, D. E. Phosphatidylethanolamine N-.methyltransferase from rat liver. Methods Enzymol. 209, 366-374 (1992).
- Gaynor, P. M., Carman, G. M. Phosphatidylethanolamine methyltransferase and phospholipid methyltransferase activities from Saccharomyces cerevisiae. Enzymological and kinetic properties. Biochim Biophys Acta. 1045 (2), 156-163 (1990).
- Arondel, V., Benning, C., Somerville, C. R. Isolation and functional expression in Escherichia coli. of a gene encoding phosphatidylethanolamine methyltransferase (EC 2.1.1.17) from Rhodobacter sphaeroides. J Biol Chem. 268 (21), 16002-16008 (1993).
- Wessel, M., Klusener, S., Godeke, J., Fritz, C., Hacker, S., Narberhaus, F. Virulence of Agrobacterium tumefaciens. requires phosphatidylcholine in the bacterial membrane. Mol Microbiol. 62 (3), 906-915 (2006).
- Klusener, S., Aktas, M., Thormann, K. M., Wessel, M., Narberhaus, F. Expression and physiological relevance of Agrobacterium tumefaciens. phosphatidylcholine biosynthesis genes. J Bacteriol. 191 (1), 365-374 (2009).
- Henderson, D. M., et al. Cloning of the gene encoding Leishmania donovani.S.-adenosylhomocysteine hydrolase, a potential target for antiparasitic chemotherapy. Mol Biochem Parasitol. 53 (1-2), 169-183 (1992).
- Koszalka, G. W., Krenitsky, T. A. 5'-Methylthioadenosine (MTA) phosphorylase from promastigote of Leishmania donovani. Purine and Pyrimidine Metabolism in Man V, Adv Exp Med Biol. Nyhan, W. L., Thompson, L. F., Watts, R. W. E. 131, Springer US. 559-563 (1986).
- Biastoff, S., Teuber, M., Zhou, Z. S., Dräger, B. Colorimetric activity measurement of a recombinant putrescine N.-methyltransferase from Datura stramonium. Planta Med. 72 (12), 1136-1141 (2006).
- Hendricks, C. L., Ross, J. R., Pichersky, E., Noel, J. P., Zhou, Z. S. An enzyme-coupled colorimetric assay for S.-adenosylmethionine-dependent methyltransferases. Anal Biochem. 326 (1), 100-105 (2004).
- Cannon, L. M., Butler, F. N., Wan, W., Zhou, Z. S. A stereospecific colorimetric assay for (S.,S.)-adenosylmethionine quantification based on thiopurine methyltransferase-catalyzed thiol methylation. Anal Biochem. 308 (2), 358-363 (2002).
- Hoffman, J. L. Chromatographic analysis of the chiral and covalent instability of S.-adenosyl-L-methionine. Biochemistry. 25 (15), 4444-4449 (1986).
- Wu, S. E., Huskey, W. P., Borchardt, R. T., Schowen, R. L. Chiral instability at sulfur of S.-adenosylmethionine. Biochemistry. 22 (12), 2828-2832 (1983).
- Dorgan, K. M., et al. An enzyme-coupled continuous spectrophotometric assay for S.-adenosylmethionine-dependent methyltransferases. Anal Biochem. 350 (2), 249-255 (2006).



