Summary
यहां, एक विधि को स्थिर एंटीजन के लिए रेडियोलेबल एंटीबॉडी के बाध्यकारी आत्मीयता (केडी) को निर्धारित करने के लिए वर्णित किया गया है। केडी संतुलन पृथक्करण स्थिरांक है जिसे संतृप्ति बाध्यकारी प्रयोग से इसके एंटीजन के लिए विभिन्न सांद्रता में रेडियोलेबल एंटीबॉडी के कुल, विशिष्ट और गैर-विशिष्ट बंधन को मापकर निर्धारित किया जा सकता है।
Abstract
बाध्यकारी आत्मीयता (केडी) का निर्धारण रेडियोलेबल एंटीबॉडी (आरएबी) के लक्षण वर्णन का एक महत्वपूर्ण पहलू है। आमतौर पर, बाध्यकारी आत्मीयता को संतुलन पृथक्करण स्थिरांक, केडी द्वारा दर्शाया जाता है, और एंटीबॉडी की एकाग्रता के रूप में गणना की जा सकती है जिस पर आधे एंटीबॉडी बाध्यकारी साइटों को संतुलन पर कब्जा कर लिया जाता है। इस विधि को किसी भी रेडियोलेबल एंटीबॉडी या अन्य प्रोटीन और पेप्टाइड मचानों के लिए सामान्यीकृत किया जा सकता है। सेल-आधारित तरीकों के विपरीत, स्थिर एंटीजन का विकल्प एंटीबॉडी के दीर्घकालिक भंडारण के बाद बाध्यकारी संबंधों को मान्य करने के लिए विशेष रूप से उपयोगी है, द्वि-विशिष्ट एंटीबॉडी निर्माणों में फ्रैगमेंट एंटीजन-बाइंडिंग क्षेत्र (फैब) हथियारों के बाध्यकारी संबंधों को अलग करना, और यह निर्धारित करना कि क्या विभिन्न सेल लाइनों के बीच एंटीजन अभिव्यक्ति में परिवर्तनशीलता है। इस विधि में एक ब्रेकेबल 96-वेल प्लेट पर निर्दिष्ट कुओं के लिए एंटीजन की एक निश्चित मात्रा को स्थिर करना शामिल है। फिर, गोजातीय सीरम एल्ब्यूमिन (बीएसए) के साथ सभी कुओं में गैर-विशिष्ट बाध्यकारी को अवरुद्ध कर दिया गया था। बाद में, आरएबी को सभी कुओं के लिए एक एकाग्रता ढाल में जोड़ा गया था। सांद्रता की एक श्रृंखला को आरएबी को संतृप्ति तक पहुंचने की अनुमति देने के लिए चुना गया था, यानी, एंटीबॉडी की एकाग्रता जिस पर सभी एंटीजन लगातार आरएबी द्वारा बंधे होते हैं। immobilized एंटीजन के बिना नामित कुओं में, rAb के nonspecific बंधन निर्धारित किया जा सकता है। immobilized एंटीजन के साथ कुओं में कुल बंधन से nonspecific बाइंडिंग घटाकर, एंटीजन के लिए rAb के विशिष्ट बंधन निर्धारित किया जा सकता है। आरएबीके के डी की गणना परिणामी संतृप्ति बाइंडिंग वक्र से की गई थी। एक उदाहरण के रूप में, बाध्यकारी आत्मीयता को रेडियोलेबल अमिवंतमाब का उपयोग करके निर्धारित किया गया था, जो एपिडर्मल ग्रोथ फैक्टर रिसेप्टर (ईजीएफआर) और साइटोप्लाज्मिक मेसेनकाइमल-एपिथेलियल संक्रमण (सीएमईटी) प्रोटीन के लिए एक द्विविशिष्ट एंटीबॉडी है।
Introduction
रेडियोलेबल एंटीबॉडी (आरएबी) का दवा में विभिन्न प्रकार के उपयोग हैं। जबकि अधिकांश का उपयोग ऑन्कोलॉजी में इमेजिंग और चिकित्सीय एजेंटों के रूप में किया जाता है, रुमेटोलॉजी से संबंधित सूजन, कार्डियोलॉजी और न्यूरोलॉजी1 के लिए इमेजिंग अनुप्रयोग हैं। इमेजिंग आरएबीएस में घावों का पता लगाने के लिए उच्च संवेदनशीलता होती है और उपचार के लिए रोगी के चयन में सहायता करने की क्षमताहोती है 2,3,4,5। वे अपने संबंधित एंटीजन के लिए उनकी विशिष्टता के कारण चिकित्सा के लिए भी उपयोग किए जाते हैं। Theranostics के रूप में जाना जाता है एक रणनीति में, एक ही rAb इमेजिंग और उपचार दोनों के लिए प्रयोग किया जाता है6.
आदर्श रूप से, रेडियोलेबलिंग के लिए चुना गया एंटीबॉडी पहले से ही गैर-रेडियोलेबल विधियों का उपयोग करके उच्च बाध्यकारी आत्मीयता और विशिष्टता के लिए साबित हुआ है। एंटीबॉडी के रेडियोलेबलिंग को रेडियोन्यूक्लाइड के साथ एंटीबॉडी के प्रत्यक्ष रासायनिक संशोधन के माध्यम से प्राप्त किया जा सकता है जो स्थिर सहसंयोजक बांड (जैसे रेडियोआयोडीन) बनाता है, या अप्रत्यक्ष रूप से चेलेटर के साथ संयुग्मन के माध्यम से जो बाद में रेडियोधातुओं 7,8 के लिए समन्वय करते हैं। प्रत्यक्ष रेडियोलेबलिंग जैसे कि रेडियोआयोडीन के साथ विशेष रूप से एंटीबॉडी पर टायरोसिन और हिस्टिडीन अवशेषों को संशोधित करता है। यदि ये अवशेष एंटीजन बाइंडिंग के लिए महत्वपूर्ण हैं, तो यह रेडियोसंयुग्मन बाध्यकारी आत्मीयता को बदल देगा। इसके विपरीत, संयुग्मन और एंटीबॉडी के अप्रत्यक्ष रेडियोलेबलिंग के लिए कई स्थापित प्रोटोकॉल हैं। उदाहरण के लिए, एंटीबॉडी के पीईटी इमेजिंग के लिए ज़िरकोनियम -89 (89Zr) को बांधने के लिए उपयोग किया जाने वाला एक सामान्य चेलेटर पी-आइसोथियोसाइनाटोबेंजिल-डेस्फेरिओक्सामाइन (डीएफओ) है, जो एंटीबॉडी 9,10 के लाइसिन अवशेषों के लिए बेतरतीब ढंग से संयुग्मित होता है। यदि एंटीजन-बाइंडिंग क्षेत्र में लाइसिन अवशेष हैं, तो इन साइटों पर संयुग्मन स्टेरिक रूप से एंटीजन बाइंडिंग में बाधा डाल सकता है और इसलिए एंटीबॉडी-एंटीजन बाइंडिंग से समझौता कर सकता है। इस प्रकार, एंटीबॉडी के अप्रत्यक्ष या प्रत्यक्ष रेडियोलेबलिंग के लिए उपयोग की जाने वाली विभिन्न रेडियोसंयुग्मन विधियां संभावित रूप से प्रभाव डाल सकती हैं, जिसे एंटीबॉडी रेडियोकॉन्जुगेट की क्षमता के रूप में परिभाषित किया गया है ताकि इसके एंटीजन 7,11 को बांधा जा सके। साइट-विशिष्ट संयुग्मन विधियां इस सीमा को दरकिनार कर सकती हैं, लेकिन इन तकनीकों को कार्बोहाइड्रेट अवशेषों 12,13,14,15,16 पर एंजाइमेटिक प्रतिक्रियाओं में अतिरिक्त सिस्टीन अवशेषों या विशेषज्ञता को शामिल करने के लिए एंटीबॉडी इंजीनियरिंग की आवश्यकता होती है। एक बार जब एक एंटीबॉडी रेडियोलेबल हो जाता है, तो यह परीक्षण करना महत्वपूर्ण है कि क्या आरएबी के लक्षण वर्णन के हिस्से के रूप में अस्पष्टता को बनाए रखा जाता है। अस्पष्टता को मापने का एक तरीका आरएबी की बाध्यकारी आत्मीयता को निर्धारित करना है।
इस प्रोटोकॉल का उद्देश्य एक स्थापित रेडियोलिगैंड संतृप्ति परख का उपयोग करके आरएबीएस के लिए बाध्यकारी आत्मीयता का निर्धारण करने के लिए एक प्रक्रिया का वर्णन करना है ताकि आरएबी-एंटीजन बाइंडिंग को निर्धारित किया जा सके। बाध्यकारी प्रवृत्ति को चित्र 1 में रेखांकित किया गया है। एंटीजन बाउंड की मात्रा बढ़ जाएगी क्योंकि अधिक आरएबी को स्थिर एंटीजन की एक निश्चित मात्रा में जोड़ा जाता है। एक बार जब सभी एंटीजन-बाइंडिंग साइटों को संतृप्त कर दिया जाता है, तो एक पठार तक पहुंच जाएगा, और अधिक आरएबीएस जोड़ने से बाध्य एंटीजन की मात्रा पर कोई प्रभाव नहीं पड़ेगा। इस मॉडल में, संतुलन पृथक्करण स्थिरांक (केडी) एंटीबॉडी की एकाग्रता है जो एंटीजन रिसेप्टर्स 17 के आधे हिस्से पर कब्जा करलेता है। केडी का प्रतिनिधित्व करता है कि एक एंटीबॉडी एक उच्च बाध्यकारी आत्मीयता के अनुरूप कम केडी के साथ अपने लक्ष्य को कितनी अच्छी तरह से बांधता है। यह पहले बताया गया था कि एक आदर्श आरएबी में 1 नैनोमोलर या उससे कम18 का केडी होना चाहिए। हालांकि, अधिक हाल ही में आरएबीएस को कम नैनोमोलर रेंज में केडी के साथ विकसित किया गया है, और नॉनवेसिव इमेजिंग अनुप्रयोगों 19,20,21,22 के लिए उपयुक्त माना जाता है। एक और पैरामीटर जिसे आरएबीएस के रेडियोलिगैंड संतृप्ति परख में निर्धारित किया जा सकता है, वह बीअधिकतम है, जो एंटीजन-बाइंडिंग की अधिकतम मात्रा से मेल खाता है। बीअधिकतम का उपयोग एंटीजन अणुओं की संख्या की गणना करने के लिए किया जा सकता है यदि आवश्यक हो।

चित्रा 1: प्रतिनिधि संतृप्ति बाध्यकारी वक्र. एंटीजन बाउंड का प्रतिशत एंटीजन की एक निश्चित मात्रा में जोड़े गए एंटीबॉडी की बढ़ती सांद्रता के खिलाफ प्लॉट किया गया है। पॉप-आउट विभिन्न बिंदुओं पर बाध्यकारी का प्रदर्शन करते हैं। क्रमशः KD और Bअधिकतम के अनुरूप एकाग्रता और बाइंडिंग को दिखाया गया है। यह आंकड़ा BioRender.com के साथ बनाया गया था। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
यह परख radiolabled bispecific एंटीबॉडी के लिए विशेष रूप से महत्वपूर्ण है प्रत्येक टुकड़ा एंटीजन बाध्यकारी क्षेत्र (फैब) उनके संबंधित एंटीजन के साथ बाध्यकारी bispecific एंटीबॉडी बाध्यकारी के हाथ के लिए कश्मीरडी निर्धारित करने के लिए. इस प्रोटोकॉल का उपयोग प्रत्येक फैब आर्म के केडी को अलग-अलग स्थिर एंटीजन पर निर्धारित करने के लिए किया जा सकता है ताकि स्वतंत्र रूप से यह चिह्नित किया जा सके कि क्या इसके संबंधित एंटीजन के लिए प्रत्येक फैब आर्म की बाध्यकारी आत्मीयता रेडियोकंजीकरण के बाद प्रभावित हुई थी। इस प्रोटोकॉल को रेडियोलेबल अमिवंतमाब के उपयोग से प्रदर्शित किया जाता है, जो एपिडर्मल ग्रोथ फैक्टर रिसेप्टर (ईजीएफआर) और साइटोप्लाज्मिक मेसेनकाइमल-एपिथेलियल संक्रमण (सीएमईटी) प्रोटीन19 के लिए एक द्विविशिष्ट एंटीबॉडी है। रेडियोलेबल सिंगल-आर्म एंटीबॉडी, जहां एक फैब आर्म ईजीएफआर (α-ईजीएफआर) या सीएमईटी (α-सीएमईटी) को बांधता है और दूसरा फैब आर्म एक आइसोटाइप नियंत्रण है, का उपयोग उदाहरण19 के रूप में भी किया गया था। यह प्रोटोकॉल एक ज्ञात एंटीजन के साथ किसी भी रेडियोलेबल एंटीबॉडी के लिए भी उपयुक्त है जिसे स्थिर किया जा सकता है। इस प्रोटोकॉल में, आरएबी की एक कमजोर पड़ने वाली श्रृंखला को आरएबी के प्रत्येक फैब हाथ के लिए विशिष्ट निर्दिष्ट कुओं में स्थिर एंटीजन की एक निश्चित मात्रा में जोड़ा जाता है। आरएबी को उन कुओं में भी जोड़ा जाता है जिन्हें केवल गोजातीय सीरम एल्ब्यूमिन (बीएसए) के साथ अवरुद्ध किया गया है, एंटीजन के बिना, गैर-विशिष्ट बंधन निर्धारित करने के लिए। विशिष्ट बाइंडिंग निर्धारित करने के लिए, immobilized antigen के लिए nonspecific बाइंडिंग को कुल rAb बाइंडिंग से घटाया जाता है। परिणामी संतृप्ति बाइंडिंग वक्र का उपयोग तब KD को निर्धारित करने के लिए किया जाता है, जैसा कि ऊपर वर्णित है।
इस विधि का एक लाभ एंटीजन के स्रोत के रूप में सेल लाइनों का उपयोग करने की तुलना में शुद्ध एंटीजन का उपयोग करते समय उच्च पुनरुत्पादन है, यह देखते हुए कि एंटीजन अभिव्यक्ति का स्तर सेल संस्कृति के दौरान प्रभावित हो सकता है और विभिन्न सेल लाइनों में एंटीजन अभिव्यक्ति के चर स्तर होते हैं। रेडियोलेबल द्वि-विशिष्ट एंटीबॉडी के मामले में, सेल लाइनें जो केवल दूसरे के बिना एंटीजन में से एक को व्यक्त करती हैं, उपलब्ध नहीं हो सकती हैं, जो व्यक्तिगत फैब हथियारों की बाध्यकारी आत्मीयता की विशेषता को बहुत चुनौतीपूर्ण बना देगी। विशेष रूप से, गैर-रेडियोलेबल विधियों पर रेडियोलिगैंड संतृप्ति परख विधि का मुख्य लाभ आरएबी के असंबद्ध अंश के योगदान के बिना आरएबी के बाध्यकारी आत्मीयता का विशिष्ट लक्षण वर्णन है। लेखकों के सर्वोत्तम ज्ञान के लिए, वर्तमान में अपने माता-पिता के असंयुग्मित एंटीबॉडी से आरएबी को अलग करने के लिए कोई शुद्धिकरण तकनीक नहीं है। चेलेटर और रेडियोन्यूक्लाइड के अपेक्षाकृत छोटे आकार को देखते हुए, आरएबी के समग्र आणविक वजन में उनका योगदान आकार बहिष्करण क्रोमैटोग्राफी में महत्वहीन है। इस प्रकार, किसी भी रेडियोलेबलिंग तकनीक से उत्पन्न उत्पाद लगभग हमेशा आरएबी और इसके माता-पिता के असंयुग्मित एंटीबॉडी का मिश्रण होता है। रेडियोलेबल संतृप्ति परख का उपयोग कर बाध्यकारी आत्मीयता की विशेषता यह सुनिश्चित करती है कि परीक्षण किया जा रहा उत्पाद पूरी तरह से आरएबी है।
Subscription Required. Please recommend JoVE to your librarian.
Protocol
नोट:: प्रोटोकॉल के ग्राफ़िकल प्रतिनिधित्व के लिए चित्र 2 को देखें।

चित्रा 2: प्रोटोकॉल की योजनाबद्ध। पंक्ति और स्तंभ लेबल को ब्रेक करने योग्य 96-वेल प्लेट की स्थापना के लिए एक गाइड के रूप में इंगित किया गया है। प्रत्याशित बाइंडिंग एंटीजन और बीएसए के लिए एक उदाहरण में अच्छी तरह से दिखाया गया है। घुमावदार तीर आरएबी को नामित करता है जिसे केवल बीएसए के साथ कुओं से धोए जाने की उम्मीद है। यह आंकड़ा BioRender.com के साथ बनाया गया था। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
1. बफर तैयारी
- स्थिरीकरण बफर के 50 mL तैयार करें (50 mM Na2CO3 का जलीय घोल; pH = 9.0)।
- वजन कागज पर NaHCO3 के 191 मिलीग्राम और Na 2 CO3 के 23.9 मिलीग्राम वजन और एक 50 मिलीलीटर शंक्वाकार ट्यूब के लिए स्थानांतरण। 40 मिली लीटर 18 MΩ पानी और भंवर को भंग करने के लिए जोड़ें। 18 MΩ पानी के साथ कुल आयतन को 50 mL तक लाने से पहले यदि आवश्यक हो तो pH को 9.0 पर समायोजित करें।
- पीबीएस के 200 मिलीलीटर और फिर 250 मिलीलीटर की बोतल के लिए 100 μL Tween-20 जोड़कर लगभग 200 मिलीलीटर धोने के बफर (फॉस्फेट-बफ़र्ड लवण (पीबीएस) जिसमें 0.05% ट्वीन -20 होता है) तैयार करें।
- बाइंडिंग बफर के 50 मिलीलीटर तैयार करें (पीबीएस जिसमें 0.05% ट्वीन -20, और 0.1% गोजातीय सीरम एल्ब्यूमिन (बीएसए) शामिल हैं)।
- वजन कागज पर बीएसए के 50 मिलीग्राम वजन और एक 50 मिलीलीटर शंक्वाकार ट्यूब के लिए स्थानांतरण। पीबीएस के 50 मिलीलीटर जोड़ें और फिर ट्यूब में Tween-20 के 25 μL जोड़ें। भंवर धीरे से मिश्रण करने के लिए.
- ब्लॉकिंग बफर के 50 मिलीलीटर (पीबीएस में 3% बीएसए) तैयार करें।
- वजन कागज पर बीएसए के 1.5 ग्राम वजन और एक 50 मिलीलीटर शंक्वाकार ट्यूब के लिए स्थानांतरण। पीबीएस के 50 मिलीलीटर जोड़ें, और मिश्रण करने के लिए धीरे से भंवर।
नोट:: सभी buffers सर्वोत्तम परिणामों के लिए 4 °C पर 1 सप्ताह तक के लिए संग्रहीत करने के लिए अनुशंसित हैं।
- वजन कागज पर बीएसए के 1.5 ग्राम वजन और एक 50 मिलीलीटर शंक्वाकार ट्यूब के लिए स्थानांतरण। पीबीएस के 50 मिलीलीटर जोड़ें, और मिश्रण करने के लिए धीरे से भंवर।
2. एंटीजन immobilization
- 5 μg / mL की एकाग्रता तक पहुंचने के लिए स्थिरीकरण बफर में एंटीजन को पतला करें।
- एक 8 x 3 सरणी में एक ब्रेक करने योग्य 96-अच्छी तरह से, फ्लैट-बॉटम प्लेट के 24 कुओं के नीचे एंटीजन के प्रति कुएं 100 μL जोड़ें (पंक्तियों के लिए कॉलम 1-3 ए-एच)। प्लेट को सीलिंग टेप से ढंक दें।
नोट: सुनिश्चित करें कि अच्छी तरह से प्लेट की सतह मिश्रित हाइड्रोफोबिक और हाइड्रोफिलिक डोमेन के सोखना को अधिकतम करने के लिए इलाज किया गया था। ये प्रीट्रीटेड प्लेटें व्यावसायिक रूप से उपलब्ध हैं। - रात भर में 4 डिग्री सेल्सियस पर इनक्यूबेट करें।
- अगले दिन, प्लेट 3x को धोने के बफर के साथ धोएं।
- तरल के निपटान के लिए सिंक में प्लेट को तेजी से उलटें और अतिरिक्त तरल को हटाने के लिए कागज के तौलिए के ढेर पर प्लेट को टैप करें।
- एक multichannel पिपेट का उपयोग करते हुए, एंटीजन युक्त कुओं के लिए धोने बफर के प्रति अच्छी तरह से 300 μL जोड़ें। 2.4.1 में वर्णित के रूप में तरल निकालें। धोने के चरण को कुल तीन बार दोहराएं।
3. बीएसए के साथ nonspecific साइटों के अवरुद्ध
- एक multichannel पिपेट का उपयोग करते हुए, 24 एंटीजन-लेपित कुओं और 96-वेल प्लेट के 24 खाली कुओं (पंक्तियों A-H के लिए कॉलम 1-6) के 24 खाली कुओं में बफर को अवरुद्ध करने के प्रति कुएं 300 μL जोड़ें।
- परिवेश के तापमान पर 1 घंटे के लिए प्लेट को इनक्यूबेट करें।
- वाशिंग बफर के प्रति कुएं में 300 μL के साथ प्लेट को कुल तीन बार धोएं। प्लेट धोने के विस्तृत विवरण के लिए चरण 2.4 देखें।
4. सीरियल dilutions और rAb समाधान के अलावा
चेतावनी: निम्नलिखित चरणों में रेडियोधर्मिता शामिल है। चरण केवल विकिरण सुरक्षा प्रशिक्षण वाले लोगों द्वारा किया जाना चाहिए। शोधकर्ताओं को दस्ताने को दोगुना करना चाहिए और पर्याप्त परिरक्षण के साथ कदम उठाना चाहिए।
- पसंद की विधि का उपयोग करके जांच के तहत आरएबी को संश्लेषित करें। एक उदाहरण के रूप में उपयोग किए जाने वाले आरएबीएस को पहले19 वर्णित के रूप में संश्लेषित किया गया था।
नोट: यह प्रोटोकॉल एक बार रेडियोलेबल होने के बाद एक rAb के लक्षण वर्णन पर केंद्रित है। - बाइंडिंग बफर में rAb के 8 x 3-गुना सीरियल dilutions (प्लेट पर पंक्तियों A-H के लिए नामित) करें।
नोट:: सीरियल dilutions की सांद्रता प्रत्येक rAb के लिए अलग-अलग होगा। विवरण चर्चा अनुभाग में चर्चा की गई है। यदि तनुकरण कारक बदलता है, तो प्रत्येक कमजोर पड़ने के लिए आवश्यक मात्रा को 1) प्रत्येक कुएं में आरएबी के बंधन के लिए पर्याप्त मात्रा सुनिश्चित करने के लिए पुनर्गणना की जानी चाहिए, 2) निम्नलिखित कमजोर पड़ने को सीडिंग करना, और 3) गामा गिनती के लिए एक आरएबी मानक समाधान को एलीकोट करना ताकि प्रत्येक कुएं में जोड़े गए कुल आरएबी की रेडियोधर्मिता को मापा जा सके।- पहली एकाग्रता ( ए के रूप में लेबल) का 1.2 मिलीलीटर समाधान बनाने के लिए आवश्यक स्टॉक आरएबी की मात्रा की गणना करें।
- B, C, D, लेबल microcentrifuge ट्यूबों के लिए बाध्यकारी बफर के 800 μL जोड़ें ... एच के लिए। 1.2 mL माइनस मात्रा बाइंडिंग बफ़र के चरण 4.2.1 में परिकलित एक microcentrifuge ट्यूब लेबल A करने के लिए जोड़ें।
- ट्यूब A के लिए 4.2.1 में परिकलित स्टॉक rAb की मात्रा जोड़ें। भंवर धीरे से मिश्रण करने के लिए और फिर ट्यूब के तल पर सभी तरल इकट्ठा करने के लिए एक मिनी microcentrifuge का उपयोग कर नीचे स्पिन.
- ट्यूब A से ट्यूब B तक 400 μL जोड़ें। भंवर मिश्रण करने के लिए और फिर एक मिनी microcentrifuge का उपयोग कर नीचे स्पिन. B से C, C से D, ..., G से H तक जोड़ने को दोहराएँ।
- एंटीजन के साथ स्थिर तीन कुओं और केवल बीएसए के साथ अवरुद्ध तीन कुओं में प्रत्येक कमजोर पड़ने के प्रति अच्छी तरह से 100 μL जोड़ें। उदाहरण के लिए, कुओं A1-A3 (एंटीजन) और A4-A6 (BSA) में कमजोर पड़ने वाले A को जोड़ें।
- माइक्रोसेंट्रीफ्यूज ट्यूबों में प्रत्येक कमजोर पड़ने का 100 μL जोड़ें , जिसे एक std - H std लेबल किया गया है। गामा काउंटर में परख किया जा करने के लिए rAb मानकों के रूप में इन ट्यूबों को बचाने के लिए।
- कोमल रॉकिंग के साथ 37 डिग्री सेल्सियस पर 1 घंटे के लिए प्लेट को इनक्यूबेट करें।
5. धोना प्लेटों और परख रेडियोधर्मिता
- प्रत्येक अच्छी तरह से के लिए माइक्रोसेंट्रीफ्यूज ट्यूब (A1 से A6, B1 से B6 तक) लेबल ... H1-H6) के माध्यम से। रंग-कोड नमूनों के लिए दो अलग-अलग रंगीन मार्करों का उपयोग करें यदि वांछित-एंटीजन के साथ लेपित कुओं के लिए एक और केवल बीएसए के साथ कुओं के लिए एक।
- एक वैक्यूम एस्पिरेटर का उपयोग करके प्रत्येक अच्छी तरह से आरएबी को एस्पिरेट करें।
- एक multichannel पिपेट का उपयोग करते हुए, प्रत्येक अच्छी तरह से धोने बफर के 300 μL जोड़ें। धोने बफर aspirate. धोने को कुल पांच बार दोहराएं।
- कुओं को उचित सूक्ष्मकेंद्रीय ट्यूबों में अलग करें।
- गामा काउंटर का उपयोग करके ट्यूबों में रेडियोधर्मिता की गणना करें। पहले एंटीजन (H1, H2, H3 से A1, A2, A3) के साथ ट्यूबों की गणना करें, और फिर केवल BSA (H4, H5, H6 से A4, A5, A6) के साथ उन लोगों की गणना करें। हस्तक्षेप को कम करने के लिए, अलग-अलग समय पर प्रत्येक कमजोर पड़ने (एच एसटीडी से ए एसटीडी) के लिए मानकों की गणना करें।
6. डेटा विश्लेषण
नोट:: पूरक फ़ाइलों में डेटा का विश्लेषण और प्लॉटिंग के लिए संगत स्प्रेडशीट और सांख्यिकीय विश्लेषण टेम्पलेट्स होते हैं.
- स्प्रेडशीट में, प्रत्येक नमूने के लिए कुल, विशिष्ट और गैर-विशिष्ट बाइंडिंग की गणना करें (पूरक फ़ाइल के रूप में संलग्न स्प्रेडशीट टेम्पलेट देखें)।
- उपयुक्त मानक के सीपीएम द्वारा विभाजित नमूने (गामा काउंटर से प्राप्त) की गणना प्रति मिनट (सीपीएम) की गणना के रूप में "बाउंड गतिविधि" की गणना करें। "% बाउंड" की गणना बाउंड गतिविधि समय 100 के रूप में करें.
- "Total Bound, mol/L" की गणना "% बाउंड" को rAb की सांद्रता (mol/L) के साथ गुणा करके करें। लीटर (0.0001 एल) में जोड़े गए आरएबी की मात्रा के साथ "टोटल बाउंड, मोल / एल" को गुणा करके "टोटल बाउंड, मोल" की गणना करें।
- एंटीजन dilutions से BSA dilutions के "Total Bound, mol" को घटाकर "विशिष्ट बाइंडिंग, mol" की गणना करें जैसे कि A1 जोड़े A4 के साथ, A2 के साथ A5, A3 के साथ A6, B1 के साथ B4, आदि।
- प्रत्येक अच्छी तरह से "कुल बाइंडिंग, मोल" से "विशिष्ट बाइंडिंग, मोल" को घटाकर "Nonspecific Binding, mol" की गणना करें।
- सांख्यिकीय विश्लेषण प्लॉटिंग सॉफ़्टवेयर में, y-अक्ष पर x-अक्ष बनाम बाइंडिंग (mol) पर जोड़ा गया (nmol/L) rAb की सांद्रता को प्लॉट करें। कुल बाइंडिंग, विशिष्ट बाइंडिंग, और गैर-विशिष्ट बाइंडिंग में प्लॉट करने के लिए अलग-अलग समूह बनाएँ. उपयोग किए गए सॉफ़्टवेयर में निम्नलिखित पैरामीटर का चयन करके एक nonlinear फ़िट विश्लेषण करें (सामग्री की तालिका; एक पूरक फ़ाइल के रूप में संलग्न सांख्यिकीय विश्लेषण टेम्पलेट देखें)।
- नया विश्लेषण का चयन करें. XY विश्लेषण के अंतर्गत, Nonlinear प्रतिगमन (वक्र फ़िट) का चयन करें। सुनिश्चित करें कि सभी डेटा का चयन विश्लेषण करें के अंतर्गत किया गया है जो डेटा सेट करता है? और तब ठीक का चयन करें.
- मॉडल टैब पर , बाइंडिंग - संतृप्ति के तहत, एक साइट - विशिष्ट बाइंडिंग का चयन करें। कॉन्फिडेंस टैब पर , 'अस्पष्ट' फिट बैठता है की पहचान करें का चयन करें। अन्य सभी पैरामीटर को डिफ़ॉल्ट के रूप में छोड़ दें और ठीक का चयन करें।
नोट:: यह कुल, विशिष्ट, और nonspecific बाइंडिंग के लिए KD और Bmax परिकलित करेगा। विशिष्ट बाइंडिंग का KD एंटीजन से बंधे rAb के nmol/L में KD है।
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
इस विधि में संतृप्ति बाध्यकारी परख के आधार पर एक rAb के लिए बाध्यकारी आत्मीयता (केडी) की गणना करता है जहां rAb के विभिन्न सांद्रता immobilized एंटीजन की एक निश्चित राशि के लिए जोड़ा गया था. बाध्यकारी वक्र को लॉगरिदमिक विकास का पालन करना चाहिए जहां यह शुरू में खड़ी होती है और फिर एंटीजन संतृप्त होने के रूप में पठार होती है। यह सुनिश्चित करने के लिए कि निर्धारित केडी सटीक है, आरएबी की सांद्रता संतृप्ति तक पहुंचने के लिए पर्याप्त उच्च होनी चाहिए। इस परख के लिए, radiolabled एंटीबॉडी DFO करने के लिए संयुग्मित थे और 89Zr के साथ radiolabled, के रूप में पहले19 वर्णित. चित्रा 3 प्रतिनिधि संतृप्ति बाध्यकारी भूखंडों को दर्शाता है। रेडियोलेबल amivantamab, एपिडर्मल ग्रोथ फैक्टर रिसेप्टर (ईजीएफआर) और साइटोप्लाज्मिक मेसेनकाइमल-एपिथेलियल संक्रमण (सीएमईटी) प्रोटीन के लिए एक द्वि-विशिष्ट एंटीबॉडी, ईजीएफआर (चित्रा 3 ए) और सीएमईटी (चित्रा 3 बी) प्रोटीन19 के लिए बाध्य था। संतृप्ति बाध्यकारी भूखंडों को ईजीएफआर (चित्रा 3 सी) और सीएमईटी (चित्रा 3 डी) प्रोटीन19 से बंधे एकल-हाथ रेडियोलेबल फैब्स के लिए भी दिखाया गया है। सभी उप-आकृतियों में, nonlinear प्रतिगमन घटता घटता से कम से कम outliers के साथ कमजोर पड़ने श्रृंखला के प्रतिनिधि थे. विशिष्ट बाइंडिंग कुल बाइंडिंग के अधिकांश से मेल खाती है। जबकि nonspecific बाध्यकारी कम समग्र था, rAb की उच्च सांद्रता अधिक nonspecific बाध्यकारी प्रदर्शित, इस परख में nonspecific बाध्यकारी के लिए एक संभावित सीमा का संकेत. rAbs के बाध्यकारी संबंध अपेक्षित नैनोमोलर रेंज में थे। 8.4 ± 1.7 nM और 4.2 ± 1.5 nM के KD मान क्रमशः एकल-भुजा α-EGFR और α-cMET के लिए, क्रमशः 9.9 ± 2.1 nM और 16.9 ± EGFR और cMET के लिए 5.9 nM के KD मानों के साथ लक्ष्य एंटीजन के लिए एक समान आत्मीयता प्रदर्शित करते हैं।
रेडियोलेबल α-सीएमईटी के बाइंडिंग के लिए सबऑप्टिमल प्रयोगों को स्थिर सीएमईटी प्रोटीन के लिए चित्र 4 में दिखाया गया है ताकि अनुकूलन की आवश्यकता वाले पैरामीटर के परिणामों को प्रदर्शित किया जा सके। चित्रा 4A में, जोड़ा गया आरएबी की एकाग्रता सीमा बहुत कम थी, और संतृप्ति तक नहीं पहुंचा गया था, जैसा कि बाध्यकारी वक्र द्वारा इंगित किया गया था जो एक पठार तक नहीं पहुंच रहा था। इन स्थितियों के परिणामस्वरूप आरएबी की एकाग्रता का एक रैखिक प्लॉट जोड़ा गया बनाम बाध्य आरएबी। चूंकि डेटा nonlinear प्रतिगमन मॉडल फिट नहीं है, KD मान सांख्यिकीय विश्लेषण में "अस्पष्ट" होने के लिए निर्धारित किया गया था। चित्रा 4 बी में, रेडियोलेबल α-सीएमईटी के लिए बहुत अधिक सांद्रता का उपयोग किया गया था। संतृप्ति तक पहुंच गया था जैसा कि बाध्यकारी वक्र के क्षैतिज पठार द्वारा इंगित किया गया था। हालांकि, nonspecific बाध्यकारी उल्लेखनीय रूप से कुल बाध्यकारी के लिए योगदान देता है। इन स्थितियों के परिणामस्वरूप 4.8 - 44.2 एनएम के बड़े 95% आत्मविश्वास अंतराल के साथ 14.9 एनएम के केडी डी मान द्वारा इंगित अनिश्चितता की एक उच्च मात्रा होती है। इस प्रकार, आरएबी की एकाग्रता सीमा को अनुकूलित करना, जैसा कि चित्र 3 डी में दिखाया गया है, अधिक सटीक केडी मान प्रदान करेगा। संतृप्ति बाध्यकारी वक्र प्रतिक्रिया कैनेटीक्स के लिए माइकलिस-मेंटेन समीकरण पर आधारित है। एक वक्र एक अच्छा फिट है जब बिंदुओं को यादृच्छिक रूप से प्रतिगमन रेखा17 के आसपास वितरित किया जाता है। एक संकीर्ण विश्वास अंतराल इंगित करता है कि KD मान सटीक है।

चित्रा 3: संतृप्ति बाध्यकारी भूखंडों KD निर्धारित करने के लिए। [89Zr]Zr-DFO-amivantamab से (A) EGFR और (B) cMET प्रोटीन, (C) [89Zr]Zr-DFO-α-EGFR से EGFR प्रोटीन के लिए, और (D) [89Zr]Zr-DFO-α-cMET को बाध्यकारी आत्मीयता की गणना करने के लिए cMET प्रोटीन के लिए बाध्यकारी वक्र। त्रुटि पट्टियाँ प्रत्येक एकाग्रता के लिए बाध्य 89Zr-लेबल एंटीबॉडी के मानक विचलन का प्रतिनिधित्व करती हैं। माध्य ± KD और Bअधिकतम के एसडी को प्रत्येक स्थिति के लिए तीन स्वतंत्र प्रयोगों से दिखाया गया है। इस आंकड़े Cavaliere et al19 से अनुमति के साथ पुन: उपयोग किया जाता है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
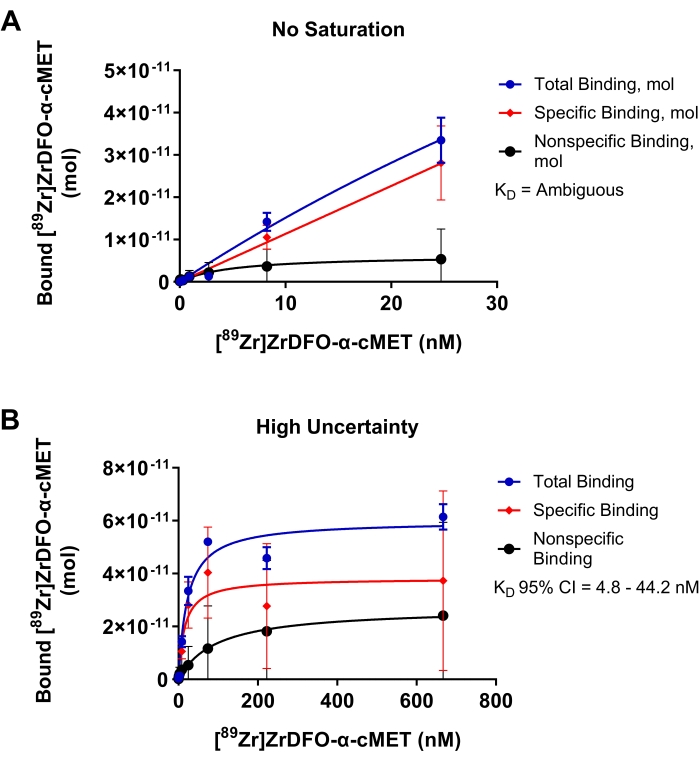
चित्रा 4: संतृप्ति बाइंडिंग प्लॉट जहां केडी को सटीक रूप से निर्धारित नहीं किया जा सकता है। [89Zr] Zr-DFO-α-cMET को cMET प्रोटीन के लिए बाध्य करना। त्रुटि पट्टियाँ बाउंड [89Zr]Zr-DFO-α-cMET के मानक विचलन का प्रतिनिधित्व करती हैं. (ए) [89Zr] Zr-DFO-α-cMET की सांद्रता बहुत कम है और संतृप्ति तक नहीं पहुंचा है। KD की गणना नहीं की जा सकती क्योंकि वक्र रैखिक है और nonlinear प्रतिगमन मॉडल में फिट नहीं होता है। (बी) विशिष्ट बंधन के लिए उच्च अनिश्चितता को केडी (4.8-44.2 एनएम) के लिए व्यापक 95% विश्वास अंतराल (सीआई) द्वारा इंगित किया गया है। आरएबी की उच्च सांद्रता के कारण उच्च गैर-विशिष्ट बंधन भी है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
पूरक फ़ाइलें. कृपया इस फ़ाइल को डाउनलोड करने के लिए यहाँ क्लिक करें।
Subscription Required. Please recommend JoVE to your librarian.
Discussion
आरएबीएस के विकास के हिस्से के रूप में, यह सुनिश्चित करना महत्वपूर्ण है कि एक आरएबी विशेष रूप से उच्च बाध्यकारी आत्मीयता के साथ अपने लक्ष्य को बांधता है। बाध्यकारी आत्मीयता का निर्धारण सूचित कर सकते हैं अगर rAb की अस्पष्टता radioligand संतृप्ति परख immobilized एंटीजन का उपयोग कर के माध्यम से radioconjugation से प्रभावित होता है. बीएसए के लिए आरएबी बाइंडिंग का निर्धारण गैर-विशिष्ट बाध्यकारी को मापने के लिए किया जा सकता है ताकि स्थिर एंटीजन के लिए विशिष्ट बंधन को अधिक सटीक रूप से मापा जा सके। यह विधि KD की गणना करने और बाइंडिंग आत्मीयता निर्धारित करने के लिए एक संतृप्ति बाइंडिंग वक्र उत्पन्न करने के लिए rAb के विभिन्न सांद्रता के बंधन का परीक्षण करती है।
इस परख करने के लिए, एक जांच के तहत rAb के लिए एंटीजन होना चाहिए. एंटीजन को एपिटोप की आवश्यकता होती है जिससे एंटीबॉडी बांधता है। उन स्थितियों में जहां उपन्यास एंटीबॉडी में अज्ञात बाध्यकारी एपिटोप होते हैं, बाध्यकारी आत्मीयता निर्धारित करने के गैर-रेडियोलेबल तरीके अधिक उपयुक्त हो सकते हैं। प्रयोग शुरू करने से पहले, एक साहित्य खोज की सिफारिश की जाती है। ब्याज है कि पहले एलिसा में इस्तेमाल किया गया है के एंटीजन आधारित assays इस परख के लिए प्रभावी होने की संभावना है.
रेडियोन्यूक्लाइड के आधे जीवन और गामा काउंटर की संवेदनशीलता के आधार पर, मानकों को रेडियोधर्मिता के स्तर तक क्षय करने में समय लग सकता है जो गामा काउंटर की मात्रात्मक सीमा के भीतर है। यदि गामा काउंटर के लिए रेडियोधर्मिता का स्तर बहुत अधिक होने का अनुमान है, तो मानक नमूनों को पतला करें और फिर डेटा विश्लेषण में कमजोर पड़ने वाले कारक से गुणा करें। यह कदम एंटीबॉडी एकत्रीकरण या गिरावट की संभावना से बचने के लिए प्रयोग के दिन किया जाना चाहिए जिसके परिणामस्वरूप असंगत मानक समाधान और गलत पठन हो सकता है।
एक उचित आकार की संतृप्ति वक्र उत्पन्न करना चुनी गई कमजोर पड़ने की श्रृंखला पर आधारित है। इस प्रक्रिया के लिए परीक्षण और त्रुटि की आवश्यकता होगी। आरएबीएस की सांद्रता को सामान्य बनाने में असमर्थता प्रोटोकॉल की एक सीमा है, क्योंकि सभी आरएबीएस से उनके एंटीजन के लिए अलग-अलग बाध्यकारी समानताएं होने की उम्मीद है। इस प्रोटोकॉल को प्रत्येक rAb के लिए ऑप्टिमाइज़ किया जाना चाहिए। एक बार अनुकूलित होने के बाद, प्रोटोकॉल को विशिष्ट आरएबी के लिए पुन: प्रस्तुत करने योग्य होना चाहिए। एकाग्रता और कमजोर पड़ने वाले कारक दोनों की सीमा को वक्र के आकार के आधार पर समायोजित करने की आवश्यकता हो सकती है। एंटीबॉडी बाइंडिंग के लिए अपेक्षित नैनोमोलर रेंज को देखते हुए, इस रेंज के व्यापक संभव प्रतिनिधित्व के साथ शुरू होने से भविष्य के परीक्षणों के लिए ब्याज की एक संकीर्ण एकाग्रता सीमा पर ज़ूम करने की अनुमति मिलेगी। आठ सीरियल dilutions के बजाय, सोलह बाध्यकारी की सीमा को समझने के लिए अधिक डेटा अंक प्रदान करेगा। यदि असंयुग्मित एंटीबॉडी के केडी को जाना जाता है, तो पहली बार अध्ययन को डिजाइन करते समय सीमा की मध्य एकाग्रता के रूप में उस मूल्य का उपयोग करने की सिफारिश की जाती है। सामग्री की उपलब्धता के आधार पर, विभिन्न एकाग्रता श्रेणियों और कमजोर पड़ने वाले कारकों के साथ कई चल रहे परीक्षणहोने से प्रोटोकॉल को अपेक्षाकृत तेजी से अनुकूलित किया जा सकता है। संतृप्ति तक पहुँचने के लिए इनक्यूबेशन समय समायोजित किया जा सकता है। इसके अतिरिक्त, यदि संतृप्ति पर भी बाइंडिंग कम है, तो के डी की सटीक गणना करने के लिए सिग्नल की पर्याप्त सीमा नहीं हो सकतीहै। immobilized एंटीजन की एकाग्रता को अनुकूलित करने की आवश्यकता हो सकती है। अधिकतम बाध्यकारी संकेत निर्धारित करने के लिए स्थिर एंटीजन की विभिन्न सांद्रता और आरएबी की स्टॉक एकाग्रता के साथ एक प्रारंभिक अध्ययन किया जा सकता है।
Radioligand संतृप्ति परख एक स्थापित विधि है और इस तरह के प्रवाह cytometry या सतह plasmon अनुनाद (SPR) के रूप में अन्य गैर radiolabled तरीकों के साथ तुलना में कई लाभ है, rAbs के बाध्यकारी आत्मीयता का निर्धारण करने के लिए. गैर-रेडियोलेबल एंटीबॉडी का पता लगाने का उपयोग करने वाली विधियां संयुग्मित और असंयुग्मित एंटीबॉडी दोनों से मिलकर एक मिश्रित नमूने की बाध्यकारी आत्मीयता को निर्धारित करती हैं। रेडियोलिगैंड संतृप्ति परख में, पंजीकृत एकमात्र संकेत रेडियोलेबल एंटीबॉडी संयुग्मन का है, जो रेडियोलेबल प्रजातियों के लिए अधिक सटीक केडी प्रदान करता है जो बायोमेडिकल एप्लिकेशन को प्रभावित करेगा। यह विचार रेडियोलिगैंड संतृप्ति परख और गैर-रेडियोलेबल तकनीकों से उन लोगों को व्यावहारिक रूप से अतुलनीय रूप से प्रस्तुत करता है क्योंकि वे विभिन्न नमूनों को मापते हैं - आरएबी बनाम आरएबी प्लस माता-पिता के एंटीबॉडी। एक अध्ययन ने गैर-रेडियोलेबल एंटीबॉडी-चेलेटर संयुग्मन और स्थिर प्रोटीन पर एसपीआर का उपयोग करके माता-पिता के द्वि-विशिष्ट एंटीबॉडी की बाध्यकारी आत्मीयता की तुलना की। एंटीबॉडी-चेलेटर संयुग्म और माता-पिता के एंटीबॉडी के केडी मूल्यों के बीच पांच गुना अंतर था। एसपीआर और कई सेल लाइनों पर एक संतृप्ति परख के बीच पाए गए केडी मूल्यों में अंतर 10- से 1,000-गुना23 तक था। गैर-रेडियोलेबल एंटीबॉडी-चेलेटर संयुग्मित और असंयुग्मित एंटीबॉडी का मिश्रण है, जबकि संतृप्ति परख द्वारा निर्धारित केडी मान केवल रेडियोलेबल संयुग्मित एंटीबॉडी से होते हैं। उपयोग की जाने वाली सेल लाइनों के बीच एंटीजन अभिव्यक्ति में भी भिन्नता है। इस प्रकार, गैर-रेडियोलेबल तकनीकों का उपयोग रेडियोलिगैंड संतृप्ति परख को मान्य करने के लिए नहीं किया जा सकता है। हालांकि, एक बार जब आरएबी के केडी निर्धारित किया गया है, तो एंटीबॉडी17,21 के माता-पिता और संयुग्मित रूपों के बीच बंधन में अंतर निर्धारित करने के लिए एक प्रतिस्पर्धी बाध्यकारी परख का प्रदर्शन किया जा सकता है।
रेडियोलिगैंड संतृप्ति परख को स्थिर एंटीजन के बजाय कोशिकाओं के लिए आरएबी के संतृप्ति बंधन को निर्धारित करने के लिए विस्तारित किया जा सकता है। एक ही अवधारणाओं का उपयोग करते हुए, आरएबी की विभिन्न सांद्रता को कोशिकाओं की एक निश्चित संख्या में जोड़ा जा सकता है। प्रोटोकॉल में उल्लिखित डेटा विश्लेषण का उपयोग तब कोशिकाओं के लिए आरएबी की बाध्यकारी आत्मीयता को निर्धारित करने के लिए किया जा सकता है, जो ब्याज की सेल लाइन पर मौजूद एंटीजन अणुओं की संख्या की गणना करने के लिए बीअधिकतम भी निर्धारित करेगा। इस विधि को अन्य रेडियोलेबल प्रोटीन और पेप्टाइड मचानों के लिए भी सामान्यीकृत किया जा सकता है ताकि उनके लक्ष्यों के लिए उनके विशिष्ट बंधन को निर्धारित किया जा सके। अंत में, यह प्रोटोकॉल स्थिर प्रोटीन एंटीजन के लिए आरएबीएस की बाध्यकारी आत्मीयता को निर्धारित करने की प्रक्रिया का वर्णन करता है। यह प्रक्रिया अचल प्रतिजन में जोड़ने के लिए आरएबी के सीरियल dilutions बनाने के लिए बुनियादी प्रयोगशाला तकनीकों का उपयोग करती है। सबसे चुनौतीपूर्ण पहलू एक उचित आकार संतृप्ति बाध्यकारी वक्र उत्पन्न करने के लिए आरएबी की सांद्रता निर्धारित करना है। इस प्रक्रिया को व्यक्तिगत rAbs के लिए परख के विकास में परीक्षण और त्रुटि की आवश्यकता होती है, लेकिन फिर एक बार स्थापित होने के बाद पुन: प्रस्तुत करने योग्य होगा। परिकलित केडी का उपयोग इमेजिंग या थेरेपी अनुप्रयोगों के साथ आगे बढ़ने के लिए, या एंटीबॉडी-चेलेट संयुग्मन प्रतिक्रिया को परिष्कृत करने के लिए एक मानदंड के रूप में एक मानदंड के रूप में किया जा सकता है।
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
लेखकों के हितों का कोई टकराव नहीं है।
Acknowledgments
लेखकों ने एंटीबॉडी प्रदान करने के लिए जेनसेन फार्मास्यूटिकल्स में [89Zr] Zr-oxalate और डॉ शेरी मूर्स के उत्पादन के लिए 3 डी इमेजिंग को धन्यवाद दिया।
Materials
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
References
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Research. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P. Radioligand binding assays and their analysis. in Receptor Binding Techniques. Davenport, A. P. , Humana Press. 31-77 (2012).
- Davenport, A. P., Russell, F. D. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. Mather, S. J. , Springer. Netherlands. 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).



