מקור: חנה ל. קאבול1,ארווין ה. סופריאטנה1,ג'ון ג'יי בויל2 וקרייג ג'יי גורגן1
1 בית הספר וולדון להנדסה ביו-רפואית, אוניברסיטת פרדו, מערב לאפייט, אינדיאנה
2 הנדסת מכונות ומדעי החומרים, אוניברסיטת וושינגטון בסנט לואיס, סנט לואיס, מיזורי
ההתנהגות המכנית של רקמות רכות, כגון כלי דם, עור, גידים ואיברים אחרים, מושפעת מאוד מהרכב האלסטין והקולגן שלהם, המספקים גמישות וכוח. כיוון הסיבים של חלבונים אלה תלוי בסוג הרקמה הרכה ויכול לנוע בין כיוון מועדף אחד לרשתות רשת מורכבות, אשר יכול להשתנות ברקמה חולה. לכן, רקמות רכות לעתים קרובות להתנהג אניזוטרופית ברמת התא והאיברים, יצירת צורך באפיון תלת מימדי. פיתוח שיטה להערכה אמינה של שדות זנים בתוך רקמות או מבנים ביולוגיים מורכבים חשוב לאפיין ולהבין באופן מכני מחלות. זן מייצג כיצד רקמות רכות מעוותות יחסית לאורך זמן, וניתן לתאר אותה מתמטית באמצעות הערכות שונות.
רכישת נתוני תמונה לאורך זמן מאפשרת להעריך עיוות ומתח. עם זאת, כל שיטות ההדמיה הרפואית מכילות כמות מסוימת של רעש, מה שמגביר את הקושי ומדייק להגביר את זן vivo. הטכניקה המתוארת כאן מתגברת בהצלחה על בעיות אלה באמצעות שיטת הערכת עיוות ישירה (DDE) לחישוב שדות מאמץ תלת-ממדי משתנים מרחבית מנתוני תמונה נפחית.
שיטות הערכת המתח הנוכחיות כוללות מתאם תמונה דיגיטלית (DIC) ומתאם אמצעי אחסון דיגיטלי. למרבה הצער, DIC יכול רק להעריך במדויק את המתח ממישור דו-ממדי, מה שמגביל מאוד את היישום של שיטה זו. בעוד שימושי, שיטות 2D כגון DIC מתקשים לכמת מתח באזורים שעוברים עיוות 3D. הסיבה לכך היא שתנועה מחוץ למטוס יוצרת שגיאות עיוות. מתאם אמצעי אחסון דיגיטלי הוא שיטה ישימה יותר המחלקת את נתוני אמצעי האחסון ההתחלתיים לאזורים ומוצאת את האזור הדומה ביותר של אמצעי האחסון המעוות, ובכך מפחיתה את השגיאה מחוץ למישור. עם זאת, שיטה זו מוכיחה להיות רגיש רעש ודורש הנחות על המאפיינים המכניים של החומר.
הטכניקה המודגמת כאן מבטלת בעיות אלה באמצעות שיטת DDE, ובכך הופכת אותה לשימושית מאוד בניתוח נתוני הדמיה רפואית. יתר על כן, הוא חזק עד גבוה או זן מקומי. כאן אנו מתארים את הרכישה של נתוני אולטרסאונד 4D מגודרים, נפחיים, ההמרה שלהם לפורמט ניתן לניתוח, ושימוש בקוד Matlab מותאם אישית להערכת עיוות תלת-ממדי וזני גרין-לגראנז ' תואמים, פרמטר המתאר טוב יותר עיוותים גדולים. טנזור זן גרין-לגראנז' מיושם בשיטות רבות להערכת זן תלת-ממדי מכיוון שהוא מאפשר לחשב את F מתוך פחות ריבועים Fit (LSF) של העקירות. המשוואה שלהלן מייצגת את טנסור זן גרין-לגראנז', E, שבו F ואני מייצגים את שיפוע העיוות וטנסור הזהות מסדר שני, בהתאמה.
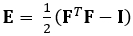 (1)
(1)
Biomedical Engineering
