Diffusion Tensor Imagem por Ressonância Magnética na Análise de Doenças Neurodegenerativas
Summary
Tensor de difusão (DTI), basicamente, serve como uma ferramenta baseada em ressonância magnética para identificar<em> In vivo</em> A microestrutura do cérebro e processos patológicos devido a desordens neurológicas dentro da matéria branca cerebral. Análises baseadas DTI permite a aplicação de doenças cerebrais, tanto ao nível do grupo e em Dados sujeitos individuais.
Abstract
Técnicas de imagem tensor de difusão (DTI) fornecer informações sobre os processos microestruturais da substância branca cerebral (WM) in vivo. Os atuais aplicativos são projetados para investigar as diferenças de padrões de envolvimento WM em diferentes doenças cerebrais, doenças neurodegenerativas, especialmente pelo uso de diferentes análises DTI em comparação com os controles.
Análise de dados DTI é realizada de uma forma variada, ou seja, comparação voxelwise de difusão métricas regionais baseadas em direção como anisotropia fracionada (FA), juntamente com acompanhamento de fibra (FT), acompanhado de estatísticas da anisotropia fracionada tractwise (AGT) no nível do grupo, a fim para identificar diferenças na FA ao longo estruturas WM, visando a definição de padrões regionais de WM alterações no nível do grupo. Transformação em um espaço padrão estereotáxica é um pré-requisito para estudos em grupo e exige que os dados completos de processamento para preservar directional inter-dependências. As aplicações atuais mostram abordagens técnicas otimizadas para esta preservação de informações quantitativas e direcional durante a normalização espacial em análises de dados em nível de grupo. Nesta base, as técnicas de FT pode ser aplicado para o grupo de dados em média, a fim de quantificar a informação métricas definidas pela FT. Além disso, a aplicação de métodos de DTI, isto é, diferenças de FA-mapas após alinhamento estereotáxico, numa análise longitudinal a um sujeito individual com base revelar informações sobre a progressão de desordens neurológicas. Melhora ainda mais a qualidade dos resultados baseados DTI podem ser obtidos durante o pré-processamento através da aplicação de uma eliminação controlada de instruções de gradiente com elevados níveis de ruído.
Em resumo, o DTI é utilizado para definir um WM pathoanatomy distinta de diversas doenças cerebrais, a combinação do conjunto de análise DTI cérebro baseado e baseado trato.
Introduction
Imagem tensor de difusão no cérebro humano
A matéria (WM) tratos branca no sistema nervoso central consistem de axónios densamente empacotados em adição a vários tipos de neuroglia e outras pequenas populações de células. A membrana axonal, bem como as fibras de proteína bem alinhadas dentro de um axónio limita a difusão de água perpendicular à orientação das fibras, provocando a difusão de água no cérebro anisotrópica WM 1. Bainhas de mielina em torno dos axônios também podem contribuir para a anisotropia tanto intra e extracelular de água 2.
A descrição quantitativa deste anisotropia pode ser detectado pelo tensor de difusão (DTI). DTI produz imagens de tecidos ponderados com as características microestruturais locais de difusão de água. As intensidades de imagem-em cada posição são atenuados, dependendo da intensidade e direcção do chamado gradiente de difusão magnética (representado emo valor-b), bem como sobre a microestrutura local no qual as moléculas de água difundir 3, o coeficiente de difusão D, a um valor escalar:
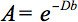
No entanto, na presença de anisotropia em WM, difusão já não pode ser caracterizado por um único coeficiente de escalar, mas requer um tensor  que, em primeira aproximação descreve mobilidade molecular ao longo de cada direção e correlação entre esses quatro direções. Anisotropia de difusão é causada principalmente pela orientação de feixes de fibras em WM e é influenciado por suas micro e macroestrutural recursos. Dos aspectos microestruturais, organização intraaxonal parece ser de grande influência sobre a anisotropia de difusão, além da densidade de uma fibraembalagem célula nd, o grau de mielinização e diâmetro das fibras individuais. Em uma escala macroscópica, a variabilidade na orientação de todas as extensões de WM em um voxel imagiologia influencia o seu grau de anisotropia 5.
que, em primeira aproximação descreve mobilidade molecular ao longo de cada direção e correlação entre esses quatro direções. Anisotropia de difusão é causada principalmente pela orientação de feixes de fibras em WM e é influenciado por suas micro e macroestrutural recursos. Dos aspectos microestruturais, organização intraaxonal parece ser de grande influência sobre a anisotropia de difusão, além da densidade de uma fibraembalagem célula nd, o grau de mielinização e diâmetro das fibras individuais. Em uma escala macroscópica, a variabilidade na orientação de todas as extensões de WM em um voxel imagiologia influencia o seu grau de anisotropia 5.
Em medições típicas de DTI, são as dimensões do voxel na ordem de milímetros. Assim, um voxel sempre contém a informação médio das moléculas de água no interior do volume de detecção que normalmente cobre várias axónios, bem como as moléculas de água circundantes. Apesar deste enquadramento multidirecional, DTI é sensível à orientação do maior eixo principal que se alinha com a direcção predominante axonal, ou seja, a contribuição axonal domina o sinal medido duas.
DTI fornece dois tipos de informações sobre a propriedade de difusão de água: em primeiro lugar, a extensão orientação independente de difusão anisotropia 5 e, segundo, a direção predominante de difusão de água em imagvoxels electrónicos, isto é, a orientação de difusão 6.
Os protocolos atuais são supostamente para fornecer um quadro de técnicas de análise de DTI para a comparação quantitativa dos grupos de sujeitos no nível do grupo, conforme descrito a seguir.
Quantificação de propriedades de difusão – parâmetros de análise
Os elementos do tensor simétrico pode ser medido por gradientes de difusão ao longo de, pelo menos, seis não colineares e não coplanares instruções de modo a que b (Equação 1) tornou-se um tensor, o que resulta na atenuação do sinal
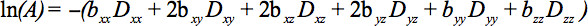
Esta equação requer respondendo por possíveis interações entre imagem e gradientes de difusão que são aplicadas em direções ortogonais (termos cruzados) e até mesmo entre os gradientes de imagem que são aplicadasem quatro direcções ortogonais.
O tensor de difusão de segunda ordem  sempre pode ser diagonalizada deixando apenas três elementos diferentes de zero ao longo da diagonal principal do tensor, ou seja, os valores próprios (
sempre pode ser diagonalizada deixando apenas três elementos diferentes de zero ao longo da diagonal principal do tensor, ou seja, os valores próprios ( 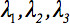 ). Os Eigenvalues reflectir a forma ou configuração do elipsóide. A relação matemática entre o principal coordenadas da elipsóide e do quadro de laboratório é descrita por os autovectores
). Os Eigenvalues reflectir a forma ou configuração do elipsóide. A relação matemática entre o principal coordenadas da elipsóide e do quadro de laboratório é descrita por os autovectores 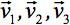
Uma vez que existem vários desafios na exibição de dados tensor, o conceito de elipsóides de difusão foi proposto 3. Os Eigendiffusivities destes ellipsoids representam unidimensionais os coeficientes de difusão na direcção principal de difusividades do meio, isto é, o eixo principal do elipsóide representa a direcção de difusão principal no voxel, que coincide com a direcção das fibras, enquanto que a excentricidade do elipsóide fornece informações sobre o grau de anisotropia e a sua simetria. Portanto, as métricas de anisotropia de difusão, tais como a anisotropia fracionada (FA) pode ser definida 7.
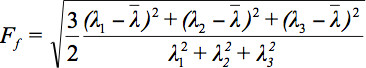
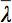 é a média aritmética de todas as Eigenvalues.
é a média aritmética de todas as Eigenvalues.
Uma abordagem adicional consiste em utilizar a direcção principal do tensor de difusão para abordar a conectividade WM do cérebro, o que corresponde ao tractografia approach que tem a intenção de investigar quais as partes do cérebro estão ligados uns aos outros. Assumindo-se que a orientação do componente principal do tensor de difusão representa a orientação dos folhetos axonais dominantes, num campo de vectores em 3-D é proporcionado, em que cada vetor representa a orientação das fibras. Actualmente, existem diversas abordagens para reconstruir WM extensões que podem ser divididas em dois tipos: a primeira categoria é baseado em algoritmos de propagação de linha usando a informação tensor local para cada passo de propagação do tracto fibra 2,8,9. A segunda categoria é baseada na minimização de energia global para encontrar o caminho energeticamente mais favorável entre duas regiões WM, resultando na abordagem estatística espacial baseados trato (TBSS) 10, o qual tem sido usado em outros algoritmos, tais como as estatísticas da anisotropia fracionada tractwise (AGT – ver texto do protocolo, a seção 2.4)..
Transformação em estande estereotáxicaard espaço
Tal como em outros métodos de ressonância magnética avançada, DTI-e estudos baseados em FT num contexto clínico prosseguir a meta final para categorizar morfologia do cérebro do paciente individual, a fim de facilitar o processo de diagnóstico com base em alguma discriminação métrico 11. Estudos ao nível do grupo são mais relevantes se o fenótipo clínico comum é suposto ser devido a danos a uma ou mais áreas específicas do cérebro ou uma rede neuroanatomical específico. Aqui, com uma média de resultados para indivíduos diferentes é útil para avaliar padrões comuns de alterações microestruturais. Cada cérebro individual tem que ser transferido para o espaço estereotáxico de modo que, num segundo passo, a média aritmética dos resultados ao nível do voxel-a-voxel é possível. Normalização espacial permitido para cálculo da média aritmética dos resultados obtidos a partir de diferentes indivíduos, a fim de melhorar a relação sinal-ruído (SNR), e para realizar uma comparação de amostras de pacientes e controls, a fim de analisar o pathoanatomy computacional de uma doença específica, por exemplo, uma doença neurodegenerativa, o qual está associado com a afectação de um sistema cerebral específico.
A abordagem inicial de normalização para um espaço estereotáxico padronizado em 12 sugeriram um algoritmo de transformação de um atlas padrão envolvendo a identificação de vários marcos cerebrais e fragmentada escala de quadrantes do cérebro. Hoje em dia, a maioria dos pacotes de análise de dados de ressonância magnética avançados usam normalização do Instituto Neurológico de Montreal (MNI) estereotáxica espaço 13. Para esta transformação, algoritmos de registro cérebro semi-automáticos e automatizados usando o estudo de modelos específicos foram desenvolvidos 14,15. Em DTI, atenção especial deve ser desenhado para preservar a informação direcional durante o processo de normalização 16,17. A aplicação de transformações espaciais em imagens DT-MR, que são necessários para a normalização espacialde conjuntos de conjuntos de dados é, em contraste com as imagens escalares entortamento, complicado pelo facto de conter informações DTs orientacional que é novamente afectadas pela transformação. Este efeito deve ser contabilizada, a fim de garantir a correção anatômica da imagem transformada. Aqui, são apresentadas técnicas de aplicação transformações afins de conjuntos de dados de DTI.
Aplicação de DTI para doenças cerebrais
A comparação dos dados longitudinal DTI requer um alinhamento / registo de dados de um objecto entre si. Neste contexto, a preservação da informação direccional é necessário (isto é, a rotação do tensor de difusão durante transformações afins). As possíveis aplicações para doenças neurodegenerativas foram relatadas anteriormente (por exemplo, 18,19).
DTI foi estabelecida como uma ferramenta técnica não-invasiva robusto para investigar in vivo Neuropatholgia de WM extensões neuronais (por exemplo, 11,20,21,22). Métricas quantitativas baseadas DTI do processo de difusão, por exemplo, o FA, já demonstraram ser marcadores sensíveis para o estudo de uma ampla gama de WM patologias, tais como acidente vascular cerebral 20, esclerose múltipla 23, a esclerose amiotrófica lateral, 24, 25, a doença de Alzheimer 26 e vários outros distúrbios WM 27,28.
Além disso, o DTI com FT podem ser usadas para identificar extensões WM 23. Esta técnica, embora ainda não em uso clínico de rotina, está emergindo como um poderoso instrumento para a avaliação de anormalidades específicas da via na doença neurológica. Dentro dos intervalos identificados vários índices quantitativos MRI derivado de DTI e aquisições adicionais (por exemplo, T2 e / ou transferência de magnetização (MT) de imagem) que são anatomicamente georeferenciados aos dados DTI podem ser medidos. Por este meio, cada índice poderia ser calculated como uma função da posição no interior do tracto, referindo-se aos lotes que descrevem a variação espacial como perfis trato.
Nos seguintes, digitaliza DTI humanos, que foram realizadas em 1,5 Tesla MRI scanners (Siemens Medical, Erlangen, Alemanha) foram utilizadas para investigar o potencial de várias técnicas de análise para a detecção de alterações na substância branca em grupos de pacientes, assim como em indivíduos. Depois de um controlo automático de qualidade para a eliminação de volumes movimento corrompidos e volumes com outros tipos de artefatos, procedimentos pós-processamento padronizados preparar os dados do DTI para a análise consecutiva. Diferentes abordagens de análise será ilustrada no seguinte, ou seja, em primeiro lugar, o cérebro todo com base estatística espacial (WBSs), em segundo lugar, a FT, e, Tractwise estatísticas da anisotropia fracionada terceiros (AGT). WBSs é um método que funciona em analogia com morfometria baseada em voxel (VBM), que é geralmente conhecida como morfometria / estatística baseada em voxel em dados DTI (VBM / DTI) <em>. VBM é um método que é executado inicialmente em imagens de contraste em que as diferenças de contraste nas varreduras separados têm de ser resolvidas quando WBSs é um método que utiliza a comparação voxelwise de um parâmetro físico. Portanto, embora algoritmicamente semelhante, uma terminologia que se diferenciar WBSs e VBM serão usados a seguir.
Protocol
Representative Results
Discussion
Média inter-sujeito dos dados DTI podem ser alcançados com respeito à amplitude de difusão (por utilização de informação FA) ea direcção da difusão (com base em FT), respectivamente. Média de FA mapas permite a comparação estatística dos grupos de sujeitos por WBSs e AGT. Este quadro metodológico dá uma introdução às técnicas DTI com média inter-sujeitos e comparação grupo. Normalização estereotáxica e comparação de mapas de FA no nível do grupo permite várias possibilidades de quantificar…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Partes deste trabalho, ou seja, o estudo sobre QC e correção para direções gradiente corrompidos na aplicação de dados de pacientes com desordens hipercinéticas, foram apoiados pela rede HD Europeia (EHDN projeto 070). Os exames de ressonância magnética nesta determinado estudo foram adquiridos como parte do site coorte TRACK-HD Londres.
Materials
| MR scanner | Siemens 1.5 T Magnetom Symphony | ||
| analysis software | TIFT – Tensor Imaging and Fiber Tracking |
References
- Moseley, M. E., Cohen, Y., et al. Diffusion-weighted MR imaging of anisotropic water diffusion in cat central nervous system. Radiology. 176, 439-445 (1990).
- Mori, S., van Zijl, P. C. M. Fiber tracking: principles and strategies – a technical review. NMR Biomed. 15, 468-480 (2002).
- Basser, P. J., Mattiello, J., LeBihan, D. MR Diffusion Tensor Spectroscopy and Imaging. Biophys J. 66, 259-267 (1994).
- Mattiello, J., Basser, J. P., Le Bihan, D. Analytical expression for the b-matrix in NMR diffusion imaging and spectroscopy. J. Magn. Reson. A. 108, 131-141 (1994).
- Pierpaoli, C., Basser, P. J. Toward a quantitative assessment of diffusion anisotropy. Magn. Reson. Med. 36, 893-906 (1996).
- Pajevic, S., Pierpaoli, C. Color schemes to represent the orientation of anisotropic tissues from diffusion tensor data: application to white matter fiber tract mapping in the human brain. Magn. Reson. Med. 42, 526-540 (1999).
- Le Bihan, D., Mangin, J. F., et al. Diffusion tensor imaging: concepts and applications. J. Magn. Reson. Imaging. 13, 534-546 (2001).
- Conturo, T. E., Lori, N. F., et al. Tracking neuronal fibre pathways in the living human brain. Proc. Natl. Acad. Sci. U.S.A. 96, 10422-10427 (1999).
- Lori, N. F., Akbudak, E. Diffusion tensor fibre tracking of human brain connectivity: aquisition methods, reliability analysis and biological results. NMR Biomed. 15, 494-515 (2002).
- Smith, S. M., Jenkinson, M., et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. 31, 1487-1505 (2006).
- Agosta, F., Pagani, E., et al. Assessment of white matter tract damage in patients with amyotrophic lateral sclerosis: a diffusion tensor MR imaging tractography study. AJNR. Am. J. Neuroradiol. 31, 1457-1461 (2010).
- Talairach, J., Tournoux, P. . Coplanar stereotaxic atlas of the human brain. , (1988).
- Brett, M., Johnsrude, I. S., Owen, A. M. The problem of functional localization in the human brain. Nat. Rev. Neurosci. 3, 243-249 (2002).
- Collins, D. L., Neelin, P., Peters, T. M., Evans, A. C. Automatic 3-D intersubject registration of MR volumetric data in standardized Talairach space. J. Comput. Assist. Tomogr. 18, 192-205 (1994).
- Friston, K. J., Ashburner, J., Frith, C. D., Poline, J. -. B., Heather, J. D., Frackowiak, R. S. J. Spatial registration and normalization of images. Human Brain Mapp. 2, 165-189 (1995).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial transformations of diffusion tensor magnetic resonance images. IEEE Trans. Med. Imaging. 20, 1131-1139 (2001).
- Müller, H. -. P., Unrath, A., Ludolph, A. C., Kassubek, J. Preservation of Diffusion Tensor Properties during Spatial Normalization by use of Tensor imaging and Fiber Tracking on a Normal Brain Database. Phys. Med. Biol. 52, N99-N109 (2007).
- Likitjaroen, Y., Meindl, T., et al. Longitudinal changes of fractional anisotropy in Alzheimer’s disease patients treated with galantamine: a 12-month randomized, placebo-controlled, double-blinded study. Eur. Arch. Psychiatry Clin. Neurosci. 262, 341-350 (2012).
- Zhang, Y., Schuff, N. Progression of white matter degeneration in amyotrophic lateral sclerosis: A diffusion tensor imaging study. Amyotroph. Lateral Scler. 12, 421-429 (2011).
- Pierpaoli, C., Barnett, A. Water diffusion changes in Wallerian degeneration and their dependence on white matter architecture. Neuroimage. 13, 1174-1185 (2001).
- Agosta, F., Valsasina, P., et al. Sensorimotor functional connectivity changes in amyotrophic lateral sclerosis. Cereb Cortex. 21, 2291-2298 (2011).
- Müller, H. -. P., Unrath, A., Huppertz, H. J., Ludolph, A. C., Kassubek, J. Neuroanatomical patterns of cerebral white matter involvement in different motor neuron diseases as studied by diffusion tensor imaging analysis. Amyotroph Lateral Scler. 13, 254-264 (2012).
- Reich, D. S., Zackowski, K. M. Corticospinal tract abnormalities are associated with weakness in multiple sclerosis. Am. J. Neuroradiol. 29, 333-339 (2008).
- Abe, O., Yamada, H. Amyotrophic lateral sclerosis: Diffusion tensor tractography and voxel-based analysis. NMR Biomed. 17, 411-416 (2004).
- Sage, C. A., Peeters, R. R., Gorner, A., Robberecht, W., Sunaert, S. Quantitative diffusion tensor imaging in amyotrophic lateral sclerosis. Neuroimage. 34, 486-499 (2007).
- Preti, M. G., Baglio, F., et al. Assessing corpus callosum changes in Alzheimer’s disease: comparison between tract-based spatial statistics and atlas-based tractography. PLoS One. 7, e35856 (2012).
- Borroni, B., Brambati, S. M., et al. Evidence of white matter changes on diffusion tensor imaging in frontotemporal dementia. Arch. Neurol. 64, 246-251 (2007).
- Unrath, A., Müller, H. -. P., Riecker, A., Ludolph, A. C., Sperfeld, A. D., Kassubek, J. Whole brain-based analysis of regional white matter tract alterations in rare motor neuron diseases by diffusion tensor imaging. Hum Brain Mapp. 31, 1727-1740 (2010).
- Müller, H. -. P., Lulé, D., Unrath, A., Ludolph, A. C., Riecker, A., Kassubek, J. Complementary Image Analysis of Diffusion Tensor Imaging and 3-Dimensional T1-Weighted Imaging: White Matter Analysis in Amyotrophic Lateral Sclerosis. J. Neuroimaging. 21, 24-33 (2011).
- Müller, H. -. P., Unrath, A., Sperfeld, A. D., Ludolph, A. C., Riecker, A., Kassubek, J. Diffusion tensor imaging and tractwise fractional anisotropy statistics: quantitative analysis in white matter pathology. Biomed. Eng. Online. 6, 42 (2007).
- Müller, H. -. P., Unrath, A., Riecker, A., Pinkhardt, E. H., Ludolph, A. C., Kassubek, J. Inter-subject variability in the analysis of diffusion tensor imaging at the group level: fractional anisotropy mapping and fiber tracking techniques. Magn. Reson. Imaging. 27, 324-334 (2009).
- Müller, H. -. P., Glauche, V., et al. Stability of white matter changes related to Huntington’s disease in the presence of imaging noise: a DTI study. PLoS Curr. 3, RRN1232 (2011).
- Müller, H. -. P., Süßmuth, S. D., Landwehrmeyer, G. B., Ludolph, A. C., Tabrizi, S. J., Klöppel, S., Kassubek, J. Stability effects on results of diffusion tensor imaging analysis by reduction of the number of gradient directions due to motion artifacts: an application to presymptomatic Huntington’s disease. PLoS Curr. 3, RRN1292 (2011).
- Shen, Y., Larkman, D. J., Counsell, S., Pu, I. M., Edwards, D., Hajnal, J. V. Correction of High-Order Eddy Current Induced Geometric Distortion in Diffusion-Weighted Echo-Planar images. Magn. Reson. Med. 52, 1184-1189 (2004).
- Ashburner, J., Friston, K. J. Nonlinear Spatial Normalization Using Basis Functions. Human Brain Mapping. 7, 254-266 (1999).
- Jones, D. K., Symms, M. R., Cercignani, M., Howard, R. J. The effect of filter size on VBM analyses of DT-MRI data. Neuroimage. 26, 546-554 (2005).
- Kunimatsu, A., Aoki, S., et al. The optimal trackability threshold of fractional anisotropy for diffusion tensor tractography of the corticospinal tract. Magn. Reson. Med. Sci. 3, 11-17 (2004).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. Neuroimage. 15, 870-878 (2002).
- Cleaver, J. E. Defective repair replication of DNA in xeroderma pigmentosum. Nature. 218, 652-656 (1968).
- Anttinen, A., Koulu, L., et al. Neurological symptoms and natural course of xeroderma pigmentosum. Brain. 131, 1979-1989 (2008).
- Kassubek, J., Sperfeld, A. D. The cerebro-morphological fingerprint of a progeroid syndrome: white matter changes correlate with neurological symptoms in xeroderma pigmentosum. PLoS One. 7, e30926 (2012).
- Canu, E., Agosta, F. The topography of brain microstructural damage in amyotrophic lateral sclerosis assessed using diffusion tensor MR imaging. AJNR. Am. J. Neuroradiol. 32, 1307-1314 (2011).
- Verstraete, E., Veldink, J. H., Hendrikse, J., Schelhaas, H. J., van den Heuvel, M. P., van den Berg, L. H. Structural MRI reveals cortical thinning in amyotrophic lateral sclerosis. J. Neurol. Neurosurg. Psychiatry. 83, 383-388 (2012).
- Hofer, S., Frahm, J. Topography of the human corpus callosum revisited- comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. Neuroimage. 32, 989-994 (2006).
- Iwata, N. K., Kwan, J. Y., et al. White matter alterations differ in primary lateral sclerosis and amyotrophic lateral sclerosis. Brain. 134, 2642-2655 (2011).
- Kassubek, J., Ludolph, A. C., Müller, H. -. P. Neuroimaging of motor neuron diseases. Ther. Adv. Neurol. Disord. 5, 119-127 (2012).
- Kassubek, J., Juengling, F. D. . Multimodality functional neuroimaging. In: C. Stippich (Ed.): Clinical functional MRI – Presurgical functional neuroimaging. , (2007).
- Stadlbauer, A., Buchfelder, M., Salomonowitz, E., Ganslandt, O. Fiber density mapping of gliomas: histopathologic evaluation of a diffusion-tensor imaging data processing method. Radiology. , 257-846 (2010).
- Stadlbauer, A., Hammen, T., et al. Differences in metabolism of fiber tract alterations in gliomas: a combined fiber density mapping and magnetic resonance spectroscopic imaging study. Neurosurgery. 71, 454-463 (2012).
- Staempfli, P., Jaermann, T., Crelier, G. R., Kollias, S., Valavanis, A., Boesiger, P. Resolving fiber crossing using advanced fast marching tractography based on diffusion tensor imaging. Neuroimage. 30, 110-120 (2006).
- Ehricke, H. H., Otto, K. M., Klose, U. Regularization of bending and crossing white matter fibers in MRI Q-ball fields Magn. Reson Imaging. 29, 916-926 (2011).
- Hirsch, J. G., Schwenk, S. M., Rossmanith, C., Hennerici, M. G., Gass, A. Deviations from the diffusion tensor model as revealed by contour plot visualization using high angular resolution diffusion-weighted imaging (HARDI). MAGMA. 16, 93-102 (2003).
- Lazar, M., Weinstein, D. M., et al. White matter tractography using diffusion tensor deflection. Human Brain Mapping. 18, 306-321 (2003).
- Reisert, M., Mader, I., Anastasopoulos, C., Weigel, M., Schnell, S., Kiselev, V. Global fiber reconstruction becomes practical. Neuroimage. 54, 955-962 (2011).
- Klein, A., Andersson, J. Evaluation of 14 nonlinear deformation algorithms applied to human brain MRI registration. Neuroimage. 46, 786-802 (2009).
- Bammer, R. Basic principles of diffusion-weighted imaging. Eur. J. Radiol. 45, 169-184 (2003).
- Mohammadi, S., Keller, S. S. The influence of spatial registration on detection of cerebral asymmetries using voxel-based statistics of fractional anisotropy images and TBSS. PLoS One. 7, e36851 (2012).
- Turner, M. R., Grosskreutz, , et al. Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. 10, 400-403 (2011).
- Müller, H. -. P., Kassubek, J., Enderle, J. D. Multimodal imaging in neurology – special focus on MRI applications and MEG. Synthesis Lectures in Biomedical Engineering. 16, (2008).
- Douaud, G., Filippini, N., Knight, S., Talbot, K., Turner, M. R. Integration of structural and functional magnetic resonance imaging in amyotrophic lateral sclerosis. Brain. 134, 3470-3479 (2011).
- Kolind, S. H., Laule, C., et al. Complementary information from multi-exponential T2 relaxation and diffusion tensor imaging reveals differences between multiple sclerosis lesions. Neuroimage. 40, 77-85 (2008).
- Verma, R., Zacharaki, E. I. Multiparametric tissue characterization of brain neoplasms and their recurrence using pattern classification of MR images. Acad. Radiol. 15, 966-977 (2008).

