Тензора диффузии Магнитно-резонансная томография в исследовании нейродегенеративных заболеваний
Summary
Воображение тензора диффузии (DTI) в основном служит МРТ-инструмент для выявления<em> В естественных условиях</em> Микроструктуры мозга и патологических процессов из-за неврологических нарушений в коре головного белого вещества. DTI основе анализы позволяют для нанесения на заболевания головного мозга, как на уровне группы и в данных одного предмета.
Abstract
Воображение тензора диффузии (DTI) методы обеспечивают информацию о микроструктурных процессов головного белого вещества (WM) в естественных условиях. В настоящем приложения предназначены для исследования различий узоров WM участие в различных заболеваний мозга, особенно нейродегенеративных расстройств, при использовании различных анализов DTI в сравнении с контрольной группой.
DTI анализ данных выполняется в мерный образом, т. voxelwise сопоставление региональных направлении диффузии на основе таких показателей, как фракционная анизотропия (ФА), а также волоконно-слежения (FT) в сопровождении tractwise дробной статистике анизотропии (TFAS) на уровне группы в целях выявить различия в Англии наряду WM структур, направленный на определение региональных особенностей изменений WM на уровне группы. Трансформация в стереотаксической стандартном пространстве является необходимым условием для групповых занятий и требует тщательной обработки данных, чтобы сохранить Directional взаимозависимости. Настоящий приложения появятся оптимизированные технические подходы к этому сохранение количественных и направленной информации при пространственном нормализации анализа данных на уровне группы. Исходя из этого, FT методы могут быть применены к группе усредненные данные для того, чтобы количественно данные метрик, как это определено FT. Кроме того, применение методов DTI, т.е. различия в FA-карты после стереотаксической выравнивания в продольном анализа на индивидуальной основе субъект раскрывать информацию о прогрессировании неврологических расстройств. Дальнейшее улучшение качества DTI основе результаты могут быть получены при предварительной обработке путем применения контролируемого устранение градиент направлениях с высоким уровнем шума.
Таким образом, DTI используется для определения различных патологической анатомии WM различных заболеваний мозга путем сочетания всего головного мозга на основе путей и анализа на основе МТП.
Introduction
Воображение тензора диффузии в человеческом мозге
Белого вещества (WM) трактов в центральной нервной системе состоит из плотно упакованных аксонов в дополнение к различным типам нейроглии и других небольших популяций клеток. Мембраны аксона, а также хорошо выровненных волокон белка в аксон ограничивает диффузию воды перпендикулярной к ориентации волокон, что приводит к анизотропной диффузии воды в мозге WM 1. Миелиновых оболочек вокруг аксонов также может способствовать анизотропии для внутри-и внеклеточной воды 2.
Количественное описание этой анизотропии могут быть обнаружены воображение тензора диффузии (DTI). DTI производит изображения тканей взвешены с учетом местных микроструктурных характеристик диффузии воды. Изображений интенсивности в каждом положении ослабляются, в зависимости от силы и направления так называемого градиента магнитного диффузии (представлено вб-значение), а также на локальном микроструктуры в которых молекулы воды диффундируют 3, коэффициент диффузии D, скалярное значение:
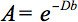
Тем не менее, в присутствии анизотропии СУС, диффузия не может быть охарактеризована одним коэффициентом скаляр, но требует тензор  которая в первом приближении описывает молекулярную подвижность по каждому направлению и корреляции между этими направлениями 4. Анизотропии диффузии в основном связано с ориентацией волокон участки в WM и находится под влиянием ее микро-и макроструктуры особенности. Из микроструктуры, intraaxonal организации видимому, имеет наибольшее влияние на анизотропии диффузии, кроме того, плотность волоконй упаковки клеток, степени миелинизации, а отдельные диаметра волокна. В макроскопических масштабах, изменчивость в ориентации всех путей в WM изображений воксел влияет на ее степень анизотропии 5.
которая в первом приближении описывает молекулярную подвижность по каждому направлению и корреляции между этими направлениями 4. Анизотропии диффузии в основном связано с ориентацией волокон участки в WM и находится под влиянием ее микро-и макроструктуры особенности. Из микроструктуры, intraaxonal организации видимому, имеет наибольшее влияние на анизотропии диффузии, кроме того, плотность волоконй упаковки клеток, степени миелинизации, а отдельные диаметра волокна. В макроскопических масштабах, изменчивость в ориентации всех путей в WM изображений воксел влияет на ее степень анизотропии 5.
В типичных измерений DTI, воксел размеры приведены в порядок миллиметров. Таким образом, вокселов всегда содержит усредненной информации молекул воды внутри обнаруженного объем, который обычно охватывает несколько аксонах, а также окружающих молекул воды. Несмотря на это разнонаправленные среды, МТП чувствительного к ориентации крупных основной оси, которая выравнивает к преимущественному аксонального направлении, т.е. аксонального вклад доминирует измеренного сигнала 2.
DTI предоставляет два типа информации о недвижимости диффузии воды: во-первых, ориентация независимых степень анизотропии диффузии 5 и, во-вторых, преобладающее направление диффузии воды в мнимойэлектронной вокселов, т.е. диффузии ориентации 6.
Современные протоколы должны обеспечивать рамках DTI методов анализа для количественного сравнения предметных групп на уровне группы, как об этом говорится в следующем.
Количественная оценка свойств диффузии – анализ параметров
Элементы симметричный тензор может быть измерена путем диффузии градиент вдоль по меньшей мере шесть неколлинеарных и некомпланарными направлениях, так что Ъ (уравнение 1) стала тензор, что приводит к ослаблению сигнала
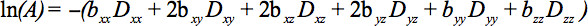
Это уравнение требует учета возможных взаимодействий между изображениями и диффузии градиенты, которые применяются в ортогональных направлениях (перекрестные члены) и даже между изображениями градиенты, которые применяютсяв ортогональных направлениях 4.
Второго ранга тензора диффузии  всегда может быть приведена к диагональному оставив только три ненулевых элементов на главной диагонали тензора, т.е. собственные значения (
всегда может быть приведена к диагональному оставив только три ненулевых элементов на главной диагонали тензора, т.е. собственные значения ( 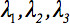 ). Собственные отражают форму и конфигурацию эллипсоида. Математическую зависимость между основными координат эллипсоида и лабораторной описывается собственные векторы
). Собственные отражают форму и конфигурацию эллипсоида. Математическую зависимость между основными координат эллипсоида и лабораторной описывается собственные векторы 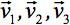
Так как существует несколько проблем при отображении тензор данных, концепция диффузии эллипсоидов была предложена 3. Eigendiffusivities из этих электронныхllipsoids представляют собой одномерные коэффициентов диффузии в основном направлении диффузии среды, т.е. основной оси эллипсоида является основным направлением диффузии в воксела которой совпадает с направлением волокон, при этом эксцентриситет эллипсоид предоставляет информацию о степень анизотропии и ее симметрии. Поэтому анизотропии диффузии показателей, таких как дробная анизотропии (ФА) может быть определено 7.
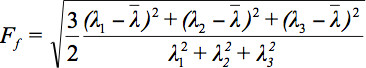
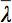 является средним арифметическим всех собственных.
является средним арифметическим всех собственных.
Еще один подход заключается в использовании основное направление тензора диффузии для решения соединения WM головного мозга, отвечающая трактография подхоч. который имеет намерение исследовать, какие части головного мозга соединены друг с другом. Если предположить, что ориентация основной компонент тензора диффузии представляет ориентации доминирующей аксонального путей, 3-D векторное поле предусмотрено, в котором каждый вектор представляет ориентации волокон. В настоящее время существует несколько различных подходов для восстановления WM участки, которые могут быть разделены на два типа: первая категория основана на линии распространения алгоритмов с использованием локальной информации тензор на каждом этапе распространения волокна тракта 2,8,9. Вторая категория основана на глобальной минимизации энергии, чтобы найти наиболее энергетически выгодная путь между двумя областями WM, в результате чего подход тракта на основе пространственной статистики (TBSS) 10, который был использован в других алгоритмов, таких как tractwise дробной статистике анизотропии (TFAS – см. текст протокола, раздел 2.4)..
Преобразование в стереотаксической стендARD пространства
Как и в других передовых методов МРТ, DTI-и FT на основе исследований в клиническом контексте добиваться конечной цели классифицировать морфологии мозга конкретного пациента, чтобы облегчить диагностический процесс, основанный на некоторую дискриминацию метрических 11. Исследования на уровне группы, которые наиболее актуальны если общий клинический фенотип, как предполагается, из-за повреждения одного или нескольких конкретных областях мозга или конкретных нейроанатомическую сети. Здесь усреднение результатов по различным предметам полезна для оценки общих закономерностей микроструктурных изменений. Каждый отдельный мозг должен быть передан в стереотаксической пространство таким образом, что на втором этапе, арифметическое усреднение результатов на воксела-на-воксела уровне возможно. Пространственное нормализации разрешено для арифметических усреднением результатов, полученных из различных предметов для того, чтобы улучшить отношение сигнал-шум (SNR) и выполнить сравнение образцов пациентов и продолжениеROLS для анализа вычислительных патологической анатомии конкретного расстройства, например, нейродегенеративные заболевания, которое связано с аффектацией конкретной системы мозга.
Раннем подходе к нормализации стандартизированных стереотаксической пространства на 12 предложили алгоритм преобразования в стандартный атлас участием идентификации различных достопримечательностей по частям мозга и масштабирование мозга квадранта. В настоящее время большинство передовых МРТ анализа данных пакеты используют нормализацию Монреальского неврологического института (МНИ) стереотаксической пространстве 13. Для этого преобразования, полуавтоматические и автоматические мозга регистрации алгоритмы, использующие конкретные исследования были разработаны шаблоны 14,15. В DTI, особое внимание должно быть обращено на сохранение информации о направлении во время процесса нормализации 16,17. Применение пространственных преобразований DT-МР изображений, которые требуются для пространственного нормализацииколлекций наборов данных, в отличие от коробления скалярных изображений, осложняется тем фактом, что ДЦ содержать ориентационная информация, которая снова зависит от трансформации. Этот эффект должны быть учтены в целях обеспечения анатомической правильности преобразованное изображение. Здесь методы применения аффинного преобразования, чтобы DTI наборов данных представлены.
Применение DTI для заболеваний головного мозга
Сравнение продольной DTI данных требует выравнивания / регистрации данных одного субъекта друг с другом. В этом контексте, сохранение информации о направлении необходимо (т.е. вращение Тензор диффузии при аффинных преобразований). Возможные приложения для нейродегенеративных заболеваний были зарегистрированы ранее (например, 18,19).
Министерство торговли и промышленности был создан в качестве надежных неинвазивных техническим инструментом для исследования в естественных условиях Neuropatholлогии WM нейронных путей (например 11,20,21,22). DTI основе количественных метрик процесса диффузии, например, FA, уже было показано, чувствительных маркеров для изучения широкого спектра патологий, WM, таких как инсульт 20, рассеянный склероз 23, боковой амиотрофический склероз 24, 25, болезни Альцгеймера 26 и ряд других расстройств WM 27,28.
Кроме того, МТП с FT может быть использован для идентификации WM трактов 23. Этот метод, в то время как до сих пор не в рутинной клинической использования, становится мощным инструментом для оценки пути конкретных отклонений в неврологическом заболевании. В определены путей, различные количественные показатели МРТ, полученных из DTI и дополнительные приобретения (например, Т2-взвешенных изображений и / или намагниченность перевода (МП) изображения), которые анатомически coregistered к DTI данные могут быть измерены. Настоящим, каждый индекс может быть исчислениеated в зависимости от положения в тракте, ссылаясь на участках изображающие их пространственное изменение как тракт профилей.
В следующем, человеческие сканирований DTI, которые были выполнены на 1,5 Тесла МРТ-сканеры (Siemens Medical, Эрланген, Германия) были использованы для исследования потенциала различных методов анализа для обнаружения аномалий белого вещества в группах пациентов, а также у лиц. После автоматизированной проверки качества для ликвидации движения поврежденного объемы и объемы с других видов артефактов, стандартизированные процедуры постобработки DTI подготовить данные для последовательного анализа. Различные подходы анализ будет проиллюстрировано следующими, то есть первый, весь мозг основан пространственной статистики (WBSS), второй FT, и, в-третьих, Tractwise дробной статистике анизотропии (TFAS). WBSS это метод, который работает по аналогии с воксел основе морфометрии (ВБМ), который, как правило, известные как воксел основе морфометрии / статистика по данным DTI (ВБМ / DTI) <eм>. ВБМ это метод, который изначально работает на контрасте изображений, где различия в контрасте отдельных сканов должны быть решены в то время как WBSS это метод, который использует voxelwise сравнение физического параметра. Поэтому, хотя алгоритмически подобное, терминологии, которая дифференцирует WBSS и ВБМ будет использоваться в следующем.
Protocol
Representative Results
Discussion
Inter-субъект усреднение DTI данных может быть достигнута по отношению к диффузии амплитуды (по использованию информации FA) и направление диффузии (в расчете на FT) соответственно. Усреднение FA карт позволяет статистическое сравнение групп предметов по WBSS и TFAS. Эта методологическая основа ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Части этой работы, то есть исследования по QC и коррекции для поврежденных градиентом направлений в приложения к данным пациентов с гиперкинетической нарушениями, однако были при поддержке Европейской сети HD (EHDN проект 070). МРТ в этом определенные исследования были приобретены в рамках сайта Лондоне TRACK-HD когорты.
Materials
| MR scanner | Siemens 1.5 T Magnetom Symphony | ||
| analysis software | TIFT – Tensor Imaging and Fiber Tracking |
References
- Moseley, M. E., Cohen, Y., et al. Diffusion-weighted MR imaging of anisotropic water diffusion in cat central nervous system. Radiology. 176, 439-445 (1990).
- Mori, S., van Zijl, P. C. M. Fiber tracking: principles and strategies – a technical review. NMR Biomed. 15, 468-480 (2002).
- Basser, P. J., Mattiello, J., LeBihan, D. MR Diffusion Tensor Spectroscopy and Imaging. Biophys J. 66, 259-267 (1994).
- Mattiello, J., Basser, J. P., Le Bihan, D. Analytical expression for the b-matrix in NMR diffusion imaging and spectroscopy. J. Magn. Reson. A. 108, 131-141 (1994).
- Pierpaoli, C., Basser, P. J. Toward a quantitative assessment of diffusion anisotropy. Magn. Reson. Med. 36, 893-906 (1996).
- Pajevic, S., Pierpaoli, C. Color schemes to represent the orientation of anisotropic tissues from diffusion tensor data: application to white matter fiber tract mapping in the human brain. Magn. Reson. Med. 42, 526-540 (1999).
- Le Bihan, D., Mangin, J. F., et al. Diffusion tensor imaging: concepts and applications. J. Magn. Reson. Imaging. 13, 534-546 (2001).
- Conturo, T. E., Lori, N. F., et al. Tracking neuronal fibre pathways in the living human brain. Proc. Natl. Acad. Sci. U.S.A. 96, 10422-10427 (1999).
- Lori, N. F., Akbudak, E. Diffusion tensor fibre tracking of human brain connectivity: aquisition methods, reliability analysis and biological results. NMR Biomed. 15, 494-515 (2002).
- Smith, S. M., Jenkinson, M., et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. 31, 1487-1505 (2006).
- Agosta, F., Pagani, E., et al. Assessment of white matter tract damage in patients with amyotrophic lateral sclerosis: a diffusion tensor MR imaging tractography study. AJNR. Am. J. Neuroradiol. 31, 1457-1461 (2010).
- Talairach, J., Tournoux, P. . Coplanar stereotaxic atlas of the human brain. , (1988).
- Brett, M., Johnsrude, I. S., Owen, A. M. The problem of functional localization in the human brain. Nat. Rev. Neurosci. 3, 243-249 (2002).
- Collins, D. L., Neelin, P., Peters, T. M., Evans, A. C. Automatic 3-D intersubject registration of MR volumetric data in standardized Talairach space. J. Comput. Assist. Tomogr. 18, 192-205 (1994).
- Friston, K. J., Ashburner, J., Frith, C. D., Poline, J. -. B., Heather, J. D., Frackowiak, R. S. J. Spatial registration and normalization of images. Human Brain Mapp. 2, 165-189 (1995).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial transformations of diffusion tensor magnetic resonance images. IEEE Trans. Med. Imaging. 20, 1131-1139 (2001).
- Müller, H. -. P., Unrath, A., Ludolph, A. C., Kassubek, J. Preservation of Diffusion Tensor Properties during Spatial Normalization by use of Tensor imaging and Fiber Tracking on a Normal Brain Database. Phys. Med. Biol. 52, N99-N109 (2007).
- Likitjaroen, Y., Meindl, T., et al. Longitudinal changes of fractional anisotropy in Alzheimer’s disease patients treated with galantamine: a 12-month randomized, placebo-controlled, double-blinded study. Eur. Arch. Psychiatry Clin. Neurosci. 262, 341-350 (2012).
- Zhang, Y., Schuff, N. Progression of white matter degeneration in amyotrophic lateral sclerosis: A diffusion tensor imaging study. Amyotroph. Lateral Scler. 12, 421-429 (2011).
- Pierpaoli, C., Barnett, A. Water diffusion changes in Wallerian degeneration and their dependence on white matter architecture. Neuroimage. 13, 1174-1185 (2001).
- Agosta, F., Valsasina, P., et al. Sensorimotor functional connectivity changes in amyotrophic lateral sclerosis. Cereb Cortex. 21, 2291-2298 (2011).
- Müller, H. -. P., Unrath, A., Huppertz, H. J., Ludolph, A. C., Kassubek, J. Neuroanatomical patterns of cerebral white matter involvement in different motor neuron diseases as studied by diffusion tensor imaging analysis. Amyotroph Lateral Scler. 13, 254-264 (2012).
- Reich, D. S., Zackowski, K. M. Corticospinal tract abnormalities are associated with weakness in multiple sclerosis. Am. J. Neuroradiol. 29, 333-339 (2008).
- Abe, O., Yamada, H. Amyotrophic lateral sclerosis: Diffusion tensor tractography and voxel-based analysis. NMR Biomed. 17, 411-416 (2004).
- Sage, C. A., Peeters, R. R., Gorner, A., Robberecht, W., Sunaert, S. Quantitative diffusion tensor imaging in amyotrophic lateral sclerosis. Neuroimage. 34, 486-499 (2007).
- Preti, M. G., Baglio, F., et al. Assessing corpus callosum changes in Alzheimer’s disease: comparison between tract-based spatial statistics and atlas-based tractography. PLoS One. 7, e35856 (2012).
- Borroni, B., Brambati, S. M., et al. Evidence of white matter changes on diffusion tensor imaging in frontotemporal dementia. Arch. Neurol. 64, 246-251 (2007).
- Unrath, A., Müller, H. -. P., Riecker, A., Ludolph, A. C., Sperfeld, A. D., Kassubek, J. Whole brain-based analysis of regional white matter tract alterations in rare motor neuron diseases by diffusion tensor imaging. Hum Brain Mapp. 31, 1727-1740 (2010).
- Müller, H. -. P., Lulé, D., Unrath, A., Ludolph, A. C., Riecker, A., Kassubek, J. Complementary Image Analysis of Diffusion Tensor Imaging and 3-Dimensional T1-Weighted Imaging: White Matter Analysis in Amyotrophic Lateral Sclerosis. J. Neuroimaging. 21, 24-33 (2011).
- Müller, H. -. P., Unrath, A., Sperfeld, A. D., Ludolph, A. C., Riecker, A., Kassubek, J. Diffusion tensor imaging and tractwise fractional anisotropy statistics: quantitative analysis in white matter pathology. Biomed. Eng. Online. 6, 42 (2007).
- Müller, H. -. P., Unrath, A., Riecker, A., Pinkhardt, E. H., Ludolph, A. C., Kassubek, J. Inter-subject variability in the analysis of diffusion tensor imaging at the group level: fractional anisotropy mapping and fiber tracking techniques. Magn. Reson. Imaging. 27, 324-334 (2009).
- Müller, H. -. P., Glauche, V., et al. Stability of white matter changes related to Huntington’s disease in the presence of imaging noise: a DTI study. PLoS Curr. 3, RRN1232 (2011).
- Müller, H. -. P., Süßmuth, S. D., Landwehrmeyer, G. B., Ludolph, A. C., Tabrizi, S. J., Klöppel, S., Kassubek, J. Stability effects on results of diffusion tensor imaging analysis by reduction of the number of gradient directions due to motion artifacts: an application to presymptomatic Huntington’s disease. PLoS Curr. 3, RRN1292 (2011).
- Shen, Y., Larkman, D. J., Counsell, S., Pu, I. M., Edwards, D., Hajnal, J. V. Correction of High-Order Eddy Current Induced Geometric Distortion in Diffusion-Weighted Echo-Planar images. Magn. Reson. Med. 52, 1184-1189 (2004).
- Ashburner, J., Friston, K. J. Nonlinear Spatial Normalization Using Basis Functions. Human Brain Mapping. 7, 254-266 (1999).
- Jones, D. K., Symms, M. R., Cercignani, M., Howard, R. J. The effect of filter size on VBM analyses of DT-MRI data. Neuroimage. 26, 546-554 (2005).
- Kunimatsu, A., Aoki, S., et al. The optimal trackability threshold of fractional anisotropy for diffusion tensor tractography of the corticospinal tract. Magn. Reson. Med. Sci. 3, 11-17 (2004).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. Neuroimage. 15, 870-878 (2002).
- Cleaver, J. E. Defective repair replication of DNA in xeroderma pigmentosum. Nature. 218, 652-656 (1968).
- Anttinen, A., Koulu, L., et al. Neurological symptoms and natural course of xeroderma pigmentosum. Brain. 131, 1979-1989 (2008).
- Kassubek, J., Sperfeld, A. D. The cerebro-morphological fingerprint of a progeroid syndrome: white matter changes correlate with neurological symptoms in xeroderma pigmentosum. PLoS One. 7, e30926 (2012).
- Canu, E., Agosta, F. The topography of brain microstructural damage in amyotrophic lateral sclerosis assessed using diffusion tensor MR imaging. AJNR. Am. J. Neuroradiol. 32, 1307-1314 (2011).
- Verstraete, E., Veldink, J. H., Hendrikse, J., Schelhaas, H. J., van den Heuvel, M. P., van den Berg, L. H. Structural MRI reveals cortical thinning in amyotrophic lateral sclerosis. J. Neurol. Neurosurg. Psychiatry. 83, 383-388 (2012).
- Hofer, S., Frahm, J. Topography of the human corpus callosum revisited- comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. Neuroimage. 32, 989-994 (2006).
- Iwata, N. K., Kwan, J. Y., et al. White matter alterations differ in primary lateral sclerosis and amyotrophic lateral sclerosis. Brain. 134, 2642-2655 (2011).
- Kassubek, J., Ludolph, A. C., Müller, H. -. P. Neuroimaging of motor neuron diseases. Ther. Adv. Neurol. Disord. 5, 119-127 (2012).
- Kassubek, J., Juengling, F. D. . Multimodality functional neuroimaging. In: C. Stippich (Ed.): Clinical functional MRI – Presurgical functional neuroimaging. , (2007).
- Stadlbauer, A., Buchfelder, M., Salomonowitz, E., Ganslandt, O. Fiber density mapping of gliomas: histopathologic evaluation of a diffusion-tensor imaging data processing method. Radiology. , 257-846 (2010).
- Stadlbauer, A., Hammen, T., et al. Differences in metabolism of fiber tract alterations in gliomas: a combined fiber density mapping and magnetic resonance spectroscopic imaging study. Neurosurgery. 71, 454-463 (2012).
- Staempfli, P., Jaermann, T., Crelier, G. R., Kollias, S., Valavanis, A., Boesiger, P. Resolving fiber crossing using advanced fast marching tractography based on diffusion tensor imaging. Neuroimage. 30, 110-120 (2006).
- Ehricke, H. H., Otto, K. M., Klose, U. Regularization of bending and crossing white matter fibers in MRI Q-ball fields Magn. Reson Imaging. 29, 916-926 (2011).
- Hirsch, J. G., Schwenk, S. M., Rossmanith, C., Hennerici, M. G., Gass, A. Deviations from the diffusion tensor model as revealed by contour plot visualization using high angular resolution diffusion-weighted imaging (HARDI). MAGMA. 16, 93-102 (2003).
- Lazar, M., Weinstein, D. M., et al. White matter tractography using diffusion tensor deflection. Human Brain Mapping. 18, 306-321 (2003).
- Reisert, M., Mader, I., Anastasopoulos, C., Weigel, M., Schnell, S., Kiselev, V. Global fiber reconstruction becomes practical. Neuroimage. 54, 955-962 (2011).
- Klein, A., Andersson, J. Evaluation of 14 nonlinear deformation algorithms applied to human brain MRI registration. Neuroimage. 46, 786-802 (2009).
- Bammer, R. Basic principles of diffusion-weighted imaging. Eur. J. Radiol. 45, 169-184 (2003).
- Mohammadi, S., Keller, S. S. The influence of spatial registration on detection of cerebral asymmetries using voxel-based statistics of fractional anisotropy images and TBSS. PLoS One. 7, e36851 (2012).
- Turner, M. R., Grosskreutz, , et al. Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. 10, 400-403 (2011).
- Müller, H. -. P., Kassubek, J., Enderle, J. D. Multimodal imaging in neurology – special focus on MRI applications and MEG. Synthesis Lectures in Biomedical Engineering. 16, (2008).
- Douaud, G., Filippini, N., Knight, S., Talbot, K., Turner, M. R. Integration of structural and functional magnetic resonance imaging in amyotrophic lateral sclerosis. Brain. 134, 3470-3479 (2011).
- Kolind, S. H., Laule, C., et al. Complementary information from multi-exponential T2 relaxation and diffusion tensor imaging reveals differences between multiple sclerosis lesions. Neuroimage. 40, 77-85 (2008).
- Verma, R., Zacharaki, E. I. Multiparametric tissue characterization of brain neoplasms and their recurrence using pattern classification of MR images. Acad. Radiol. 15, 966-977 (2008).

