Síntese altamente Stereoselective de 1,6-cetoésteres Mediada por líquidos iônicos: A reacção de três componente permitindo o rápido acesso a uma nova classe de baixo peso molecular Gelators Peso
Summary
Ionic liquids (ILs) mediate fast, simple and cheap access to 1,6-ketoesters in high diastereoselectivities and good yields. The reaction protocol is robust and the 1,6-ketoesters can be obtained in gram scale after a simple filtration protocol. Moreover, the 1,6-ketoesters are potent gelators in hydrocarbon solvents.
Abstract
In organic chemistry ionic liquids (ILs) have emerged as safe and recyclable reaction solvents. In the presence of a base ILs can be deprotonated to form catalytically active N-Heterocyclic Carbenes (NHCs). Here we have used ILs as precatalysts in the addition of α,β-unsaturated aldehydes to chalcones to form 1,6-ketoesters, incorporating an anti-diphenyl moiety in a highly stereoselective fashion. The reaction has a broad substrate scope and several functional groups and heteroaromatics can be integrated into the ketoester backbone in generally good yields with maintained stereoselectivity. The reaction protocol is robust and scalable. The starting materials are inexpensive and the products can be obtained after simple filtration, avoiding solvent-demanding chromatography. Furthermore, the IL can be recycled up to 5 times without any loss of reactivity. Moreover, the 1,6-ketoester end product is a potent gelator in several hydrocarbon based solvents. The method enables rapid access to and evaluation of a new class of low molecular weight gelators (LMWGs) from recyclable and inexpensive starting materials.
Introduction
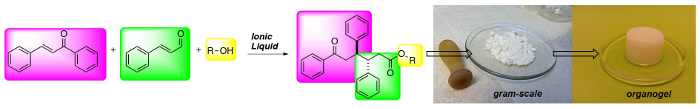
(Acima) síntese Três-componente do 1,6-cetoésteres: uma nova classe de gelators baixo peso molecular.
Os líquidos iónicos (ILS) têm uma elevada estabilidade, baixa volatilidade, não inflamabilidade e, portanto, têm prestado atenção como meios de reacção seguras e solventes ideais para reciclagem. 1-3 imidazoliums dialquilo é um certo tipo de líquidos iónicos que, na presença de uma base, , pode ser desprotonado para renderizar um carbeno N-heterocíclicos (NHC) 4. No campo da organocatálise, NHCs, operando sob caminhos de reação distintas, têm encontrado uso generalizado em uma ampla gama de reações genéricas. 5-11
Apesar disso, a ligação entre TIs e ligação CC forming NHC-catálise é relativamente inexplorado. No entanto, NHCs derivado de ILS têm sido relatados para catalisar reacções de formação de ligações CC, tais como a condensação de benzoína e a reacção Stetter 12-22. Por exemplo, Davis et ai. Demonstraram que LIs thiazoliums derivados de N-alquilo servir como no precatalysts 12 formação de benzoína do benzaldeído.
Mais recentemente, Chen e colegas de trabalho expandido este conceito utilizando uma base imidazólio IL, 1-etil-3-metil imidazólio de etilo (EMIMAc), para efectuar a condensação de benzoína em 5-hidroximetilfurfural (HMF) para gerar 5,5 '-di (hidroximetil) furoin (DHMF). 23 Dado que as TIs estão disponíveis comercialmente e oferecem uma forma barata de gerar NHCs, estávamos interessados em investigar o que os outros tipos de reações ILs poderia realizar. Para este fim, descobriu-se que de dialquilo imidazoliums poderia ser usado eficientemente como precatalysts no additi formal de conjugadode aldeídos insaturados em a calconas (Figura 1) para dar 1,6-cetoésteres. A IL mais eficiente, EMIMAc, promove uma reacção altamente estereosselectiva entre cinamaldeído e chalcona. A reacção ocorre com elevada preferência pelo anti -diastereero e os 1,6-cetoésteres pode ser isolado com rendimentos de até 92%. 24,25,26
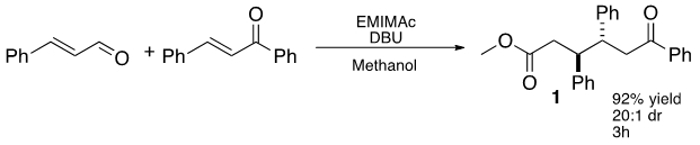
Figura 1: IL-mediada de três componentes, além estereosselectiva de cinamaldeído a calcona.
Protocol
Representative Results
Discussion
Com base na configuração- anti determinado por análise de raios-X de cetoéster 3 e na investigação mecanicista proposto por Bode e colegas de trabalho 30 o seguinte caminho reaccional é sugerido (Figura 5). A desprotonação do IL gera espécies NHC; o NHC reage com o aldeído insaturado, para formar o intermediário I. O Breslow Breslow intermédia e a calcona reagir numa reacção cruzada benzoína para formar dieno II. Intermediário II sofre um rearranjo oxi-Cope via estad…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We gratefully acknowledge the Swedish Research Council Formas for generous financial support.
Materials
| 1-ethyl-3-methyl imidazolium acetate | Aldrich | 51053-100G-F | Produced by BASF ≥90%, dried on a rotary evaporated before use (10 mBar, 40 °C, 1h) CAS NUMBER: 143314-17-4 |
| 1,3-diphenyl-2-propen-1-one | Aldrich | 11970-100G | 98.0% CAS NUMBER: 94-41-7 |
| trans-cinnamaldehyde | Aldrich | C80687-25G | 99%, stored under nitrogen prior to use CAS NUMBER: 14371-10-9 |
| 1,8-Diazobicyclo[5.4.0]undec-7-ene | Aldrich | 139009-25G | 98% CAS NUMBER: 6674-22-2 |
| Methanol | Sigma-Aldrich | 32213N-2.5L | puriss. P.a., ACS reagent, reag. ISO, reag. Ph. Eur. ≥99.8% (GC) CAS NUMBER: 67-56-1 |
| Dichloromethane | Fischer Chemical | D/1852/17X | Analytic reagent grade, stabilized with amylene CAS NUMBER:9/2/1975 |
| n-Heptane | Fischer Chemical | H/0160/17X | Analytic reagent grade CAS NUMBER: 142-82-5 |
References
- Hallett, J. P., Welton, T. Room-Temperature Ionic Liquids: Solvents for Synthesis and Catalysis. 2. Chem. Rev. 111, 3508-3576 (2011).
- Welton, T. Room-Temperature Ionic Liquids. Solvents for Synthesis and Catalysis. Chem. Rev. 99, 2071-2084 (1999).
- Vora, H. U., Wheeler, P., Rovis, T. Exploiting acyl and enol azolium intermediates via N-hetero- cyclic carbene-catalyzed reactions of α-reducible aldehydes. Adv. Synth. Catal. 354, 1617-1639 (2012).
- Holloczki, O., et al. Carbenes in ionic liquids. New J. Chem. 34, 3004-3009 (2010).
- Enders, D., Balensiefer, T. Nucleophilic Carbenes in Asymmetric Organocatalysis. Acc. Chem. Res. 37, 534-541 (2004).
- Enders, D., Niemeier, O., Henseler, A. Organocatalysis by N-Heterocyclic Carbenes. Chem. Rev. 107, 5606-5655 (2007).
- List, B. Enamine Catalysis Is a Powerful Strategy for the Catalytic Generation and Use of Carbanion Equivalents. Acc. Chem. Res. 37, 548-557 (2004).
- Nair, V., Bindu, S., Sreekumar, V. N-Heterocyclic carbenes: Reagents, not just ligands!. Angew. Chem. Int. Ed. 43, 5130-5135 (2004).
- Marion, N., Dìez-González, S., Nolan, S. P. N-Heterocyclic Carbenes as Organocatalysts. Angew. Chem. Int. Ed. 46, 2988-3000 (2007).
- Biju, A. T., Kuhl, N., Glorius, F. Extending NHC-Catalysis: Coupling Aldehydes with Unconventional Reaction Partners. Acc. Chem. Res. 44, 1182-1195 (2011).
- Bugaut, X., Glorius, F. Organocatalytic umpolung: N-heterocyclic carbenes and beyond. Chem. Soc. Rev. 41, 3511-3522 (2012).
- Davis, h. j., Forrester, K. J. Thiazolium-ion based organic ionic liquids (OILs).1,2 Novel OILs which promote the benzoin condensation. Tetrahedron Lett. 40, 1621-1622 (1999).
- Xu, L. -. W., Gao, Y., Yin, J. -. J., Li, L., Xia, C. -. G. Efficient and mild benzoin condensation reaction catalyzed by simple 1-N-alkyl-3-methylimidazolium salts. Tetrahedron Lett. 46, 5317-5320 (2005).
- Jiang, F. S., Yu, H., Gao, G., Xie, R. G. Benzoin condensation in imidazolium based room-temperature ionic liquids. Chin. Chem. Lett. 16, 321-324 (2005).
- Estager, J., Lévêque, J. M., Turgis, R., Draye, M. Solventless and swift benzoin condensation catalyzed by 1-alkyl-3-methylimidazolium ionic liquids under microwave irradiation. J. Mol. Catal. A: Chem. 256, 261-264 (2006).
- Estager, J., Lévêque, J. -. M., Turgis, R., Draye, M. Neat benzoin condensation in recyclable room-temperature ionic liquids under ultrasonic activation. Tetrahedron Lett. 48, 755-759 (2007).
- Orsini, M., Chiarotto, I., Elinson, M. N., Sotgiu, G., Inesi, A. Benzoin condensation in 1,3-dialkylimidazolium ionic liquids via electrochemical generation of N-heterocyclic carbene. Electrochem. Commun. 11, 1013-1017 (2009).
- Dunn, M. H., Cole, M. L., Harper, J. B. Effects of an ionic liquid solvent on the synthesis of [gamma]-butyrolactones by conjugate addition using NHC organocatalysts. RSC Advances. 2, 10160-10162 (2012).
- Kelemen, Z., Holloczki, O., Nagy, J., Nyulaszi, L. An organocatalytic ionic liquid. Org. Biomol. Chem. 9, 5362-5364 (2011).
- Yu, F. -. L., Zhang, R. -. L., Xie, C. -. X., Yu, S. -. T. Synthesis of thermoregulated phase-separable triazolium ionic liquids catalysts and application for Stetter reaction. Tetrahedron. 66, 9145-9150 (2010).
- Aupoix, A., Vo-Thanh, G. Solvent-free synthesis of alkylthiazolium-based ionic liquids and their use as catalysts in the intramolecular Stetter reaction. Synlett. , 1915-1920 (2009).
- Yu, F. -. L., Jiang, J. -. J., Zhao, D. -. M., Xie, C. -. X., Yu, S. -. T. Imidazolium chiral ionic liquid derived carbene-catalyzed conjugate umpolung for synthesis of [gamma]-butyrolactones. RSC Advances. 3, 3996-4000 (2013).
- Liu, D., Zhang, Y., Chen, E. Y. X. Organocatalytic upgrading of the key biorefining building block by a catalytic ionic liquid and N-heterocyclic carbenes. Green Chem. 14, 2738-2746 (2012).
- Ta, L., Axelsson, A., Bijl, J., Haukka, M., Sundén, H. Ionic Liquids as Precatalysts in the Highly Stereoselective Conjugate Addition of α,β-Unsaturated Aldehydes to Chalcones. Chem. Eur. J. 20, 13889-13893 (2014).
- Nair, V., et al. Nucleophilic Heterocyclic Carbene Catalyzed Annulation of Enals to Chalcones in Methanol: A Stereoselective Synthesis of Highly Functionalized Cyclopentanes. Org. Lett. 11, 2507-2510 (2009).
- Ma, J., Huang, Y., Chen, R. N-Heterocyclic carbene-catalyzed (NHC) three-component domino reactions: highly stereoselective synthesis of functionalized acyclic ϵ-ketoesters. Org. Biomol. Chem. 9, 1791-1798 (2011).
- Domingo, L. R., Saez, J. A., Arno, M. A DFT study on the NHC catalysed Michael addition of enols to α,β-unsaturated acyl-azoliums. A base catalysed C-C bond-formation step. Org. Biomol. Chem. 12, 895-904 (2014).
- Kaeobamrung, J., Mahatthananchai, J., Zheng, P., Bode, J. W. An Enantioselective Claisen Rearrangement Catalyzed by N-Heterocyclic Carbenes. J. Am. Chem. Soc. 132, 8810-8812 (2010).
- Zweep, N., van Esch, J. H. . Functional Molecular Gels. , 1-29 (2014).
- Chiang, P. -. C., Kaeobamrung, J., Bode, J. W. Enantioselective, Cyclopentene-Forming Annulations via NHC-Catalyzed Benzoin−Oxy-Cope Reactions. J. Am. Chem. Soc. 129, 3520-3521 (2007).

