Herstellung und Prüfung von impedanzbasierten Fluidic Biochips mit RTgill-W1 Zellen für die schnelle Auswertung von Trinkwasserproben für Toxizität
Summary
This manuscript describes how to prepare fluidic biochips with Rainbow trout gill epithelial cells for use in a field portable electric cell-substrate impedance sensor. The protocol for running a rapid drinking water toxicity test with the sensor is also described.
Abstract
This manuscript describes how to prepare fluidic biochips with Rainbow trout gill epithelial (RTgill-W1) cells for use in a field portable water toxicity sensor. A monolayer of RTgill-W1 cells forms on the sensing electrodes enclosed within the biochips. The biochips are then used for testing in a field portable electric cell-substrate impedance sensing (ECIS) device designed for rapid toxicity testing of drinking water. The manuscript further describes how to run a toxicity test using the prepared biochips. A control water sample and the test water sample are mixed with pre-measured powdered media and injected into separate channels of the biochip. Impedance readings from the sensing electrodes in each of the biochip channels are measured and compared by an automated statistical software program. The screen on the ECIS instrument will indicate either “Contamination Detected” or “No Contamination Detected” within an hour of sample injection. Advantages are ease of use and rapid response to a broad spectrum of inorganic and organic chemicals at concentrations that are relevant to human health concerns, as well as the long-term stability of stored biochips in a ready state for testing. Limitations are the requirement for cold storage of the biochips and limited sensitivity to cholinesterase-inhibiting pesticides. Applications for this toxicity detector are for rapid field-portable testing of drinking water supplies by Army Preventative Medicine personnel or for use at municipal water treatment facilities.
Introduction
Das Ziel war es, ein Verfahren für die Zellaussaat, Lagerung und Prüfung von fluidischen Biochips im ECIS Biosensor zu entwickeln. Das Ziel für die Entwicklung dieses Biosensor war US-Armee Spezifikationen für ein Feld tragbares Gerät zu erfüllen, die eine mögliche Kontamination von Trinkwasserversorgung von Soldaten benutzt wird erkennen konnte. Die Anforderungen an die Toxizität Sensor waren, dass sie sich schnell ein breites Spektrum von toxischen Industrie Verbindungen erkennen konnte (innerhalb einer Stunde) in Konzentrationen relevant für die menschliche Gesundheit, dass das Gerät Feld tragbar sein, und die biologischen Komponenten würde eine Haltbarkeit haben, mindestens neun Monate. Kältetechnik, aber nicht das Einfrieren, die von verderblichen Komponenten war akzeptabel.
Historisch gesehen haben, Feld tragbaren Wasser Prüftechnik mit einer biologischen Komponente , um sie (wie Antikörper, Enzyme oder Nucleinsäuren) Analyt-spezifischen 1-3. Der Nachteil dieser Art von Biosensoren ist, dass sie onl wirdy zu einem Zeitpunkt eine Art der chemischen Erkennung. Mehrere Sensoren benötigt werden, wenn vermutet wird, dass mehr als eine Chemikalie vorhanden ist. Wenn ein bestimmter Sensor nicht im Test Repertoire, chemische Verunreinigungen im Wasser ist, könnte leicht unentdeckt bleiben.
Breit abgestütztes Toxizität Sensoren, auf der anderen Seite, haben das Potenzial, diese Technologielücke zu füllen. Diese haben in der Regel eine zelluläre Komponente , um sie 4-8. Die Vorteile der breit abgestützten Toxizität Biosensoren sind , dass sie das Vorhandensein einer Vielzahl von chemischen Verunreinigungen erkennen kann, einschließlich Mischungen und Unbekannten, in einem relativ kurzen Zeitraum 5,9,10.
Das Konzept der Messung der elektrischen Impedanz von Zellmonolayern als mögliche Toxizitätssensor, der auch als elektrische Zell-Substrat – Impedanz – Mess (ECIS), wurde zuerst bekannt ist 11 von Giaever und Keese beschrieben. In den vergangenen zwei Jahrzehnten ein empfindlicher Indikator für Zell VIAB erwiesen wurdeility und Zytotoxizität. Grundsätzlich wird die Zellmonoschicht, die an die Elektroden auf den Biochips anhaftet auf Hochfrequenz ausgesetzt und niedriger Spannung und Stromstärke Wechselstromsignal. Die konfluente Monoschicht von Zellen behindert den Fluss der Elektronen. Wenn die Integrität der Zellmonoschicht beeinträchtigt ist (beispielsweise wenn eine giftige Chemikalie eingebracht wird), zeichnet der ECIS Sensor eine Änderung in der elektrischen Impedanz 11-14. 1 veranschaulicht das Prinzip der ECIS in Bezug auf die Zellmonoschicht auf dem Biochip .
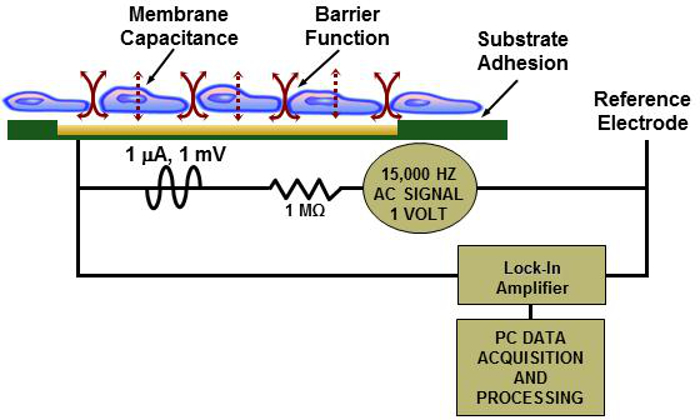
Abbildung 1:.. Das Prinzip der ECIS Illustration einer Zellschicht auf einem Biochip mit vereinfachten ECIS Leser elektrisches Schema Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Verfahren für die Aussaat, Lagerung und Prüfung von fluidischen Biochips enthalten,Monoschichten von RTgill-W1 Zellen auf fluidische Biochips in einem Biosensor ECIS werden hier beschrieben. Die fluidische Biochips können für bis zu 9 Monate in einem gekühlten Zustand gelagert werden und kann zum Testen von Trinkwasser supplies.The begleitenden ECIS Leser, oder Testeinheiten werden separat ausgeliefert in einem kalten Lagerbehälter, versendet werden. Die Biochips haben zwei Komponenten zu ihnen; eine obere Polycarbonatschicht mit zwei getrennten Fluidkanäle, und eine untere Schicht, die elektronische vier Elektroden-Pads pro Kanal für die Impedanzabtastung enthält. Es gibt 10 Arbeitselektroden pro Pad; jede Elektrode 250 & mgr; m im Durchmesser. Die versammelten Biochips haben Goldelektrodenanschlüsse zum Erfassen von Messwerten Impedanz, wenn sie in der ECIS Testgerät eingesetzt. Jede der beiden geschlossenen fluidischen U-förmige Kanäle hält 2 ml der RTgill-W1 Zellsuspension. 2 zeigt eine fluidische Biochip in dem ECIS Leser mit einer Vergrößerung von einer konfluenten Zellen auf einer einzelnen Sensorelektrode.
<p class= "Jove_content" fo: keep-together.within-page = "1">
Abbildung 2:.. Fluidic Biochip in ECIS Reader gezoomten Bereich zeigt eine konfluente Monoschicht von RTgill-W1 – Zellen auf einer einzigen Sensorelektrode Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Protocol
Representative Results
Discussion
Die ECIS Technologie eine gute Leistung in einer Laborumgebung und war in der Lage mögliche Wasser Verunreinigungen in Konzentrationen zu ermitteln, die für die menschliche Gesundheit relevant sind. Die Portabilität und Verpackung der Technologie macht es auf den Feldeinsatz förderlich.
Kritische Schritte in dem Protokoll für den Erfolg der Technik sind wie folgt: 1) Halten Sie aseptischen Bedingungen während der Kultur, Säen und Fütterung der Biochips, 2) Halten Sie die ausgesäten Biochips in gekühlten Bedingungen bis zum Testen bereit, da die RTgill-W1-Zellen wird nicht sehr lange überleben, wenn sie auf Temperaturen über 25 ° C ausgesetzt sind, 3) wird genau das L-15ex in den pulverförmigen Phiolen Medien und genau die Wasserproben Fehlalarme zu vermeiden messen Herstellung, die durch eine Verschiebung der verursacht werden kann Osmolalität von Medien eher als Probe Toxizität, 4) zum Ausführen der Tests Gebrauchsanweisungen auf der ECIS Bildschirm. Die Software in dem Lesegerät alarmiert den Benutzer, wenn eine biochip ist nicht akzeptabel für die Prüfung (bezogen auf den anfänglichen Impedanzmessungen), wenn der Biochip zuerst in das Lesegerät eingeführt wird. Wenn die Impedanzniveaus nicht akzeptabel für die Prüfung sind, wird die Software nicht zulassen, dass der Benutzer mit der Prüfung fortfahren, bis ein neuer Biochip verwendet wird. Gründe für nicht akzeptabel Impedanzmessungen sind in der Regel aufgrund einer leichten Versatz der Biochip-Elektroden mit den ECIS Leser Stifte oder Flüssigkeitsleckage an einer der Verklebung Kanten des Biochips.
Es gibt einige Grenzen dieser Technologie, da der ECIS Sensor nur mit Trinkwasser und nicht mit Oberflächenwasser getestet. Die RTgill-W1-Zellen, die auf dem Biochip sind, können nicht das Einfrieren oder die Temperaturen weit über 25 ° C für längere Zeit (Zeitrahmen abhängig von Stunden bis Tagen sein kann, von der Temperatur tolerieren. Die Biochips am besten funktionieren in einem Temperaturbereich von gekühlt Raumtemperatur 7. Sie sind sofort einsatzbereit, jedoch direkt nach r zu seinemoved von kalten Lagerung. Tragbare Kühlraumbehälter werden derzeit von Armeepersonal im Bereich für temperaturempfindliche Versorgungen verwendet. Diese gleichen Behälter können für geimpfte Biochip Transport verwendet werden.
Eine weitere Beschränkung dieser Technik besteht darin, dass, obwohl es ein Breitbandsensor Toxizität ist, ist es nicht gut reagiert, wenn überhaupt, auf die Cholinesterase-hemmenden Verbindungen, wie einige Pestizide. Um diese Fähigkeit Lücke zu füllen, wird der ECIS-Sensor entwickelt, um mit einem im Handel erhältlichen schnellen Pestizid-Test-Test in Verbindung verwendet werden, wenn Wasserproben, um die Prüfung der Benutzer mit einem breiteren Spektrum von Toxizitätstests zur Verfügung zu stellen. Das Kit ist eine schnelle enzymatische Assays entwickelt, um Organophosphat und Carbamatpestiziden innerhalb von 30 Minuten zu erkennen.
Die ECIS Sensor ergänzt das WQAS-PM (Water Quality Analysis System – Präventive Medizin) Bereich Wasser-Testsystem, das derzeit von militärischen Präventivmedizin Personal zur Erkennung, arsenic, Blei oder Zyanid in einer Trinkwasserprobe. Obwohl der ECIS Sensor nicht erkennen, was die Verunreinigung ist, zeigt es, wenn bestimmte Metalle oder organische Verbindungen vorhanden sind, was darauf hinweist, dass das Wasser nicht für den menschlichen Verzehr geeignet sind. Die ECIS Testergebnisse sind innerhalb einer Stunde zur Verfügung. Die Wasserproben können dann zur Identifizierung der kontaminierenden gesendet für eine weitere Analyse, wenn es ein positives Testergebnis.
Wie oben beschrieben, wird der ECIS Leser ausgelegt ist Teil eines Systems sein, die eine separate enzymatische ACE-Kit, um ein breites Spektrum an Fremdkörperdetektion zur Deckung umfasst. Beide Leser werden in einem robusten Gehäuse verpackt für Feldtransport für den Feldeinsatz von Soldaten.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by the US Army Medical Research and Materiel Command and by the Small Business Innovation Research and Small Business Technology Transfer program; Contract No. W81XWH-13-C-0093. We would like to thank Dr. Lucy Lee at the University of Fraser for being our RTgill-W1 cell culture mentor, and to acknowledge Dr. Niels Bols of Waterloo University for the development of the RTgill-W1cell line.
Materials
| Fetal bovine serum | Life Technologies, Inc. www.lifetechnologies.com | 16000-085 | Store @ -20 °C. Thaw @ room temperature before use. Ingredient for complete L-15 cell culture media (10%). |
| Fibronectin, bovine plasma | EMD Millipore Corp. www.emdmillipore.com | 341631-1 mg | Store @ -20 °C. Thaw @ room temperature before use. Mix with L-15 media for a concentration of 10 ug/mL and freeze @ -20 °C in aliquots. Use as substrate for biochips. |
| L-15 media without L-glutamine | Lonza www.lonzabioscience.com | 12-700F | Basal media for cell culture and feeding biochips. Store at 6 °C. |
| L-15ex powdered media with phenol red | US Biological www.usbio.net | L1501 | Media is weighed out in 60 mg aliquots in 0.1 dram vials and stored at 6 °C in foil pouches with dessicant packs. Nine month shelf-life. Mixed with 10 mL of water sample for testing in biochips. |
| PBS, w/o Ca++ or Mg++ | Lonza www.lonzabioscience.com | 17-516F | Store at room temperature. Used for rinsing media when trypsinizing cell culture flasks. |
| Trypsin, EDTA | Lonza www.lonzabioscience.com | CC-5012 | Store @ -20 °C. Thaw at room temperature and use to trypsinize cell culture flasks. |
| T175 culture flasks | Fisher Scientific www.fishersci.com |
12-565-30 | Used for culturing RTgill-W1 cells. |
| Bleach | Chlorox www.chlorox.com | Diluted to 20% with millique or distilled water for cleaning ECIS chips. Any household bleach is acceptable. | |
| 70 % ethyl alcohol | For disinfecting biohood surfaces and any materials being placed in biohood. | ||
| Rainbow trout gill cells (RTgill-W1) | American Type Tissue Culture Collection www.atcc.org | CRL-2523 | Cells cultured and used for biosensor (seeding biochips). |
| GlutaMAX-1 Supplement, 200 mM | Lonza www.lonzabioscience.com | 35050-061 | Store at room temperature. Ingredient for complete L-15 cell culture media (1%). |
| Penn/Strep Stock 10K/10K | Lonza www.lonzabioscience.com | 17-602E | Store @ -20 °C. Thaw @ room temperature before use. Ingredient for complete L-15 cell culture media (1%). |
| Pharmed BPT tubing | U.S. Plastic Corp. www.usplastic.com | 57317 | Cut in 27 mm sections and autoclaved. Used for seeding biochips with cells and as a closed loop between media changes. |
| Polycarbonate luer fittings for Pharmed tubing assemblies | Value Plastics | MTLS210-9 | Secured to each end of cut Pharmed tubing for insertion into bichips. |
| 20 mL syringes, slip-tip | VWR Scientific us.vwr.com | BD302831 | Used for injection of cell suspension for seeding ECIS chips, as well as for feeding chips. |
| 0.1 dram snap-cap polypropylene microvials | Bottles Jars and Tubes, Inc. www.bottlesjarsandtubes.com | 30600 | Used to store 60 mg aliquots of L-15ex powdered media. |
| 60 mil Lexan fluidic ECIS biochips | Nanohmics, Inc. www.nanohmics.com | Custom-made by Nanohmics, Inc. RTgill-W1 cells will be injected into the biochips and seeded chips will be placed in ECIS reader for testing. | |
| Autoclavable Plastic Instrument Box 17 1/2" x 7 3/4" x 2 3/8" |
Medi-Dose EPS medidose.com | IB701 | Used to store the following; autoclaved plugs, biochips that have been cleaned, seeded biochips. |
| Paper heat-seal sterilization pouches, 7 ½” x 13” | CardinalHealth www.cardinalhealth.com | 90713 | Used for autoclaving tubing and fittings and plugs. |
| Quantos automated powder dispenser | Mettler Toledo www.mt.com | QB5 | Automated dispension of 60 mg aliquots of powdered L-15ex into 0.1 dram vials. |
| ECIS reader | Nanohmics, Inc. www.nanohmics.com | Custom-made by Nanohmics, Inc. Seeded biochip is inserted into the reader for conducting water toxicity testing. | |
| 3 X 5 metalized 2.5 mil polypropylene reclosable bags | Uline www.uline.com | S-16893 | Packaging and storage for both seeded biochips and powdered L-15ex media vials. |
| Leatherman squirt ps4 | Amazon www.Amazon.com | Used to open powdered media vials. | |
| 1 gram silica gel desiccant packets | Uline www.uline.com | S-3902 | Put in polypropylene bags with L-15ex powdered media vials to prevent the powder from picking up moisture. |
| Sterile 250 or 500 mL Nalgene bottles | Fisher Scientific www.fishersci.com |
09-740-25C or E | Hold cell suspensions for seeding ECIS chips in biohood. |
| Plugs for biochips | Nanohmics, Inc. www.nanohmics.com | Custom-made by Nanohmics, Inc. Used to seal ports on biochips before storage @ 6°C. | |
| Drains for ECIS biochips | Nanohmics, Inc. www.nanohmics.com | Custom-made by Nanohmics, Inc. Placed on 2 inner ports on biochips prior to insertion in ECIS reader. Allows for excess media to drain from channels during test injections. | |
| Hemocytometer | Fisher Scientific www.fishersci.com |
S17040 | Needed for counting cells prior to adjusting cell suspension for injection into biochips. |
| Brightfield microscope w/ 10X objective | Leitz Labovert | Any brightfield microscope is acceptable. | |
| Class II biological safety cabinet | Any class II biological safety cabinet where cell culture can be performed under sterile conditions is acceptable. | ||
| Microcentrifuge tubes, 0.6 mL | Fisher Scientific www.fishersci.com |
02-681-311 | Holds 1 mL of cell suspension prior to counting cells. |
| Slip 10 cc red syringes | Procedure Products, Inc. www.procedureproducts.com | S/49S 30-R | Withdraws 9 mL of test water sample and used to inject sample into biochip. |
| Slip 10 cc blue syringes | Procedure Products, Inc. www.procedureproducts.com | S/49S 30-B | Withdraws 9 mL of control water sample and used to inject sample into biochip. |
| ½ oz. clear pet plastic jar w/ white ribbed lined caps | SKS Bottle & Packaging, Inc. www.sks-bottle.com | 0605-30 | Sample vials used for mixing L-15ex powder and 10 mL of water sample for testing. |
| 50 mL sterile conical polypropylene centrifuge tubes | Fisher Scientific www.fishersci.com | 12-565-269 | Used to hold 40 mL aliquots of 10 ug/mL fibronectin @ -20 °C. |
References
- Pancrazio, J. J., Whelan, J. P., Borkholder, D. A., Ma, A., Stenger, D. A. Development and application of cell-based biosensors. Ann. Biomed. Eng. 27, 697-711 (1999).
- States, S., Scheuring, M., Kuchta, J., Newberry, J., Casson, L. Utility-based analytical methods to ensure public water supply security. J. Am. Water Works Assoc. 95, 103-115 (2003).
- Kelly, T., Baxter, W., McCauley, M., Koglin, E. Testing of Screening Technologies for Detection of Toxic Industrial Chemicals in All Hazards Receipt Facilities. EPA/600/R-08/034. , 1-25 (2008).
- van der Schalie, W. H., James, R. R., Gargan, T. P. Selection of a battery of rapid toxicity sensors for drinking water evaluation. Biosens. Bioelectron. 22, 18-27 (2006).
- Iuga, A., Lerner, E., Shedd, T. R., van der Schalie, W. H. Rapid responses of a melanophore cell line to chemical contaminants in water. J. Appl. Toxicol. 29, 346-349 (2009).
- Curtis, T. M., et al. Suitability of invertebrate and vertebrate cells in a portable impedance-based toxicity sensor: temperature mediated impacts on long-term survival. Toxicol In Vitro. 27, 2016-2066 (2013).
- Brennan, L. M., Widder, M. W., Lee, L. E. J., van der Schalie, W. H. Long-term storage and impedence-based water toxicity testing capabilities of fluidic biochips seeded with RTgill-W1 cells. Toxicol In Vitro. 26, 736-745 (2012).
- Widder, M. W., Brennan, L. M., Hanft, E. A., Schrock, M. E., James, R. R., van der Schalie, W. H. Evaluation and refinement of a field-portable drinking water toxicity sensor and a fluidic biochip. J. Appl. Toxicol. , (2014).
- O’Shaughnessy, T. J., Gray, S. A., Pancrazio, J. J. Cultured neuronal networks as environmental biosensors. J. Appl.Toxicol. 24, 379-385 (2004).
- Eltzov, E., Marks, R. S. Whole-cell aquatic biosensors. Anal. Bioanal. Chem. 400, 895-913 (2011).
- Giaever, I., Keese, C. R. A morphological biosensor for mammalian cells. Nature. 366, 591-592 (1993).
- Curtis, T. M., et al. A portable cell-based impedance sensor for toxicity testing of drinking water. Lab on a Chip. 9, 2176-2183 (2009).
- Xiao, C., Luong, J. H. T. Assessment of cytotoxicity by emerging impedance spectroscopy. Toxicol. .Appl. Pharmacol. 206 (2), 102-112 (2005).
- Xing, J. Z., Zhu, L., Gabos, S., Xie, L. Microelectronic cell sensor assay for detection of cytotoxicity and prediction of acute toxicity. Toxicol. In Vitro. 20, 995-1004 (2006).
- Lee, L. E. J., Dayeh, V. R., Schirmer, K., Bols, N. C. Applications and potential uses of fish gill cell lines: examples with RTgill-W1. In Vitro Cell. Develop. Biol.- Animal. 45, 127-134 (2009).
- . RT-gill-W1 (ATCC CRL-2523) Culture Method. American Type Culture Collection (ATCC). , (2015).

