Preparazione e test di impedenza a base di biochip fluidici con le cellule RTgill-W1 per valutare rapidamente campioni di acqua potabile per la tossicità
Summary
This manuscript describes how to prepare fluidic biochips with Rainbow trout gill epithelial cells for use in a field portable electric cell-substrate impedance sensor. The protocol for running a rapid drinking water toxicity test with the sensor is also described.
Abstract
This manuscript describes how to prepare fluidic biochips with Rainbow trout gill epithelial (RTgill-W1) cells for use in a field portable water toxicity sensor. A monolayer of RTgill-W1 cells forms on the sensing electrodes enclosed within the biochips. The biochips are then used for testing in a field portable electric cell-substrate impedance sensing (ECIS) device designed for rapid toxicity testing of drinking water. The manuscript further describes how to run a toxicity test using the prepared biochips. A control water sample and the test water sample are mixed with pre-measured powdered media and injected into separate channels of the biochip. Impedance readings from the sensing electrodes in each of the biochip channels are measured and compared by an automated statistical software program. The screen on the ECIS instrument will indicate either “Contamination Detected” or “No Contamination Detected” within an hour of sample injection. Advantages are ease of use and rapid response to a broad spectrum of inorganic and organic chemicals at concentrations that are relevant to human health concerns, as well as the long-term stability of stored biochips in a ready state for testing. Limitations are the requirement for cold storage of the biochips and limited sensitivity to cholinesterase-inhibiting pesticides. Applications for this toxicity detector are for rapid field-portable testing of drinking water supplies by Army Preventative Medicine personnel or for use at municipal water treatment facilities.
Introduction
L'obiettivo generale era quello di sviluppare un metodo per la semina delle cellule, stoccaggio e verifica dei biochip fluidici nel biosensore ECIS. L'obiettivo per lo sviluppo di questo biosensore è stato quello di soddisfare le specifiche Army per un dispositivo portatile di campo che potrebbe rilevare possibile contaminazione di acqua potabile utilizzata dai soldati. I requisiti per il sensore di tossicità erano che potrebbe rilevare un ampio spettro di composti tossici industriali rapidamente (entro un'ora) a concentrazioni rilevanti per la salute umana, che il dispositivo sia campo portatile e componenti biologiche avrebbe una shelf-life di almeno nove mesi. Refrigerazione, ma non gelida, di componenti deperibili era accettabile.
Storicamente, campo portatili tecnologie di controllo dell'acqua con una componente biologica a loro (come gli anticorpi, enzimi, o acidi nucleici) sono stati 1-3 specifico analita. Lo svantaggio di questi tipi di biosensori è che essi ONLy rilevare un tipo di sostanza chimica alla volta. I sensori multipli sono necessari se si sospetta che più di un chimico è presente. Se un sensore specifico non è nel repertorio di prova, contaminanti chimici nell'acqua potrebbe facilmente passare inosservato.
I sensori di tossicità ad ampia base, d'altra parte, hanno il potenziale per colmare questo divario tecnologico. Questi hanno solitamente un componente cellulare a loro 4-8. I vantaggi di biosensori tossicità ampia base sono che possono rilevare la presenza di una vasta gamma di contaminanti chimici, comprese miscele e incognite, in un periodo relativamente breve di tempo 5,9,10.
Il concetto di utilizzare la misura della impedenza elettrica di monostrati cellulari come possibile sensore tossicità, che è noto anche come elettrico cellula-substrato impedenza di rivelazione (ECIS), è stato descritto da Giaever e Keese 11. Negli ultimi due decenni si è dimostrato essere un indicatore sensibile di viab celluleility e citotossicità. Fondamentalmente, il monostrato cellulare che viene fatto aderire agli elettrodi sui biochip è esposto ad elevata frequenza e bassa tensione e amperaggio alternata segnale corrente. Il monostrato confluente di cellule impedisce il flusso di elettroni. Quando l'integrità del monostrato cellulare è compromessa (ad esempio quando viene introdotto un composto chimico), il sensore ECIS registra una variazione della impedenza elettrica 11-14. La figura 1 illustra il principio di ECIS rispetto al monostrato di cellule sul biochip .
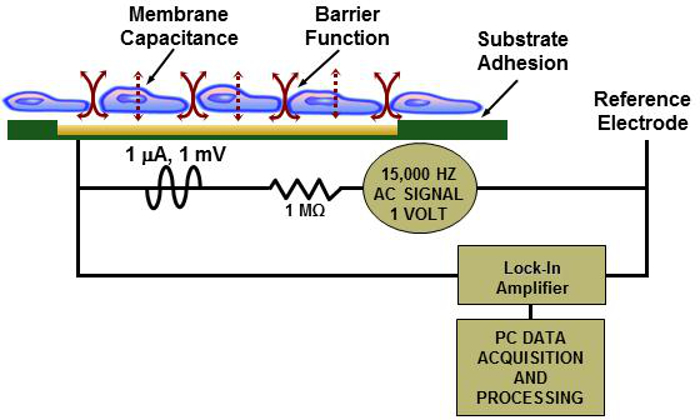
Figura 1:.. Principio di ECIS Illustrazione di un monostrato di cellule su un biochip con lettore di ECIS semplificato schema elettrico Cliccate qui per vedere una versione più grande di questa figura.
Metodi per la semina, stoccaggio e verifica dei biochip fluidici contenentimonostrati di cellule RTgill-W1 su biochip fluidici in un biosensore ECIS sono descritte qui. I biochip fluidici possono essere conservati per un massimo di 9 mesi in uno stato refrigerato e possono essere spediti in un contenitore di stoccaggio a freddo, per la prova di acqua potabile supplies.The che accompagnano i lettori ECIS, o unità di prova, vengono spediti separatamente. I biochip hanno due componenti a loro; uno strato superiore in policarbonato con due canali fluidi separati, e uno strato inferiore elettronico che contiene quattro elettrodi per canale per il rilevamento di impedenza. Ci sono 10 elettrodi di lavoro per blocco; ogni elettrodo è di 250 micron di diametro. I biochip assemblati hanno collegamenti elettrodo d'oro per l'acquisizione di letture di impedenza quando viene inserito nell'unità di test ECIS. Ciascuno dei due canali a forma di U fluidici allegate terrà 2 ml della sospensione cellulare RTgill-W1. Figura 2 mostra un biochip fluidico nel lettore ECIS con un ingrandimento di un cellule confluenti su un singolo elettrodo di rilevamento.
<p class= "Jove_content" fo: keep-together.within-page = "1">
Figura 2:.. Biochip Fluidic in ECIS Reader area ingrandita mostra un monostrato confluente di cellule RTgill-W1 su un singolo elettrodo di rilevamento Cliccate qui per vedere una versione più grande di questa figura.
Protocol
Representative Results
Discussion
La tecnologia ECIS eseguito bene in un ambiente di laboratorio ed è stato in grado di rilevare potenziali contaminanti in concentrazioni che sono rilevanti per la salute umana. La portabilità e il confezionamento della tecnologia rende favorevole per l'uso sul campo.
passaggi critici nel protocollo per il successo della tecnologia sono i seguenti: 1) mantenere condizioni asettiche durante la coltura, la semina, e l'alimentazione dei biochip, 2) Tenere i biochip seminati in condizioni refrigerate fino pronto per il test in quanto le cellule RTgill-W1 non sopravviverà molto lungo una volta che sono sottoposti a temperature superiori ai 25 ° C, 3) pesare la L-15ex nelle fiale multimediali polvere e misurare accuratamente i campioni di acqua per evitare di produrre falsi positivi, che possono essere causati da un cambiamento nella osmolalità dei media piuttosto che la tossicità del campione, 4) Seguire le istruzioni utente sullo schermo ECIS per eseguire i test. Il software nel lettore avvisa l'utente se un biochip è inaccettabile per il test (basato su letture dell'impedenza iniziali) quando il biochip viene dapprima inserita nel lettore. Se i livelli di impedenza sono inaccettabili per il test, il software non consente all'utente di procedere con il test fino a quando si utilizza un nuovo biochip. Motivi per letture dell'impedenza inaccettabili solito a causa di un leggero disallineamento degli elettrodi biochip con piedini del lettore ECIS o perdite di liquido lungo uno dei bordi di incollaggio del biochip.
Ci sono alcuni limiti di questa tecnologia, perché il sensore ECIS è stato testato solo con acqua potabile e non con le acque di superficie. Le cellule RTgill-W1 che si trovano sul biochip non possono tollerare il congelamento o temperature molto al di sopra di 25 ° C per lunghi periodi di tempo (periodo di tempo può essere da ore a giorni dipende dalla temperatura. I biochip funzionano meglio in un range di temperatura da frigorifero a temperatura 7. sono pronti per l'uso immediato, tuttavia, subito dopo essere rdell'uso e rimossi dalle celle frigorifere. contenitori freddo portatili sono attualmente utilizzati da personale dell'esercito nel campo delle forniture sensibili alla temperatura. Questi stessi contenitori possono essere utilizzati per il trasporto biochip seminata.
Un altro limite di questa tecnologia è che anche se è un sensore di tossicità a larga banda, non risponde bene, se non del tutto, a composti di inibizione della colinesterasi, come alcuni pesticidi. Per colmare questa lacuna capacità, il sensore ECIS è progettato per essere utilizzato in combinazione con un saggio test rapido pesticidi disponibile in commercio quando il test campioni di acqua al fine di fornire all'utente una gamma più ampia di prove di tossicità. Il kit è un test enzimatico rapida progettato per rilevare organofosfati e carbammati pesticidi entro 30 min.
Il sensore ECIS integra la wqas-PM (Analisi dell'acqua Sistema di Qualità – Medicina Preventiva) sistema di test d'acqua campo, attualmente utilizzato da personale militare medicina preventiva per rilevare, Arsenic, piombo, o cianuro in un campione di acqua potabile. Anche se il sensore ECIS non identificare ciò che il contaminante è, indicherà se sono presenti alcuni metalli o composti organici, che indica che l'acqua non può essere adatto per il consumo umano. I risultati del test ECIS sono disponibili all'interno di un ora. I campioni di acqua possono essere inviati per ulteriori analisi per l'identificazione del contaminante se vi è un risultato positivo.
Come descritto sopra, il lettore ECIS è progettato per essere parte di un sistema che include un kit ACE enzimatica separata per coprire un ampio spettro di rilevamento contaminanti. Entrambi questi lettori vengono confezionati in una robusta valigetta per il trasporto di campo per l'uso sul campo da parte dei soldati.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by the US Army Medical Research and Materiel Command and by the Small Business Innovation Research and Small Business Technology Transfer program; Contract No. W81XWH-13-C-0093. We would like to thank Dr. Lucy Lee at the University of Fraser for being our RTgill-W1 cell culture mentor, and to acknowledge Dr. Niels Bols of Waterloo University for the development of the RTgill-W1cell line.
Materials
| Fetal bovine serum | Life Technologies, Inc. www.lifetechnologies.com | 16000-085 | Store @ -20 °C. Thaw @ room temperature before use. Ingredient for complete L-15 cell culture media (10%). |
| Fibronectin, bovine plasma | EMD Millipore Corp. www.emdmillipore.com | 341631-1 mg | Store @ -20 °C. Thaw @ room temperature before use. Mix with L-15 media for a concentration of 10 ug/mL and freeze @ -20 °C in aliquots. Use as substrate for biochips. |
| L-15 media without L-glutamine | Lonza www.lonzabioscience.com | 12-700F | Basal media for cell culture and feeding biochips. Store at 6 °C. |
| L-15ex powdered media with phenol red | US Biological www.usbio.net | L1501 | Media is weighed out in 60 mg aliquots in 0.1 dram vials and stored at 6 °C in foil pouches with dessicant packs. Nine month shelf-life. Mixed with 10 mL of water sample for testing in biochips. |
| PBS, w/o Ca++ or Mg++ | Lonza www.lonzabioscience.com | 17-516F | Store at room temperature. Used for rinsing media when trypsinizing cell culture flasks. |
| Trypsin, EDTA | Lonza www.lonzabioscience.com | CC-5012 | Store @ -20 °C. Thaw at room temperature and use to trypsinize cell culture flasks. |
| T175 culture flasks | Fisher Scientific www.fishersci.com |
12-565-30 | Used for culturing RTgill-W1 cells. |
| Bleach | Chlorox www.chlorox.com | Diluted to 20% with millique or distilled water for cleaning ECIS chips. Any household bleach is acceptable. | |
| 70 % ethyl alcohol | For disinfecting biohood surfaces and any materials being placed in biohood. | ||
| Rainbow trout gill cells (RTgill-W1) | American Type Tissue Culture Collection www.atcc.org | CRL-2523 | Cells cultured and used for biosensor (seeding biochips). |
| GlutaMAX-1 Supplement, 200 mM | Lonza www.lonzabioscience.com | 35050-061 | Store at room temperature. Ingredient for complete L-15 cell culture media (1%). |
| Penn/Strep Stock 10K/10K | Lonza www.lonzabioscience.com | 17-602E | Store @ -20 °C. Thaw @ room temperature before use. Ingredient for complete L-15 cell culture media (1%). |
| Pharmed BPT tubing | U.S. Plastic Corp. www.usplastic.com | 57317 | Cut in 27 mm sections and autoclaved. Used for seeding biochips with cells and as a closed loop between media changes. |
| Polycarbonate luer fittings for Pharmed tubing assemblies | Value Plastics | MTLS210-9 | Secured to each end of cut Pharmed tubing for insertion into bichips. |
| 20 mL syringes, slip-tip | VWR Scientific us.vwr.com | BD302831 | Used for injection of cell suspension for seeding ECIS chips, as well as for feeding chips. |
| 0.1 dram snap-cap polypropylene microvials | Bottles Jars and Tubes, Inc. www.bottlesjarsandtubes.com | 30600 | Used to store 60 mg aliquots of L-15ex powdered media. |
| 60 mil Lexan fluidic ECIS biochips | Nanohmics, Inc. www.nanohmics.com | Custom-made by Nanohmics, Inc. RTgill-W1 cells will be injected into the biochips and seeded chips will be placed in ECIS reader for testing. | |
| Autoclavable Plastic Instrument Box 17 1/2" x 7 3/4" x 2 3/8" |
Medi-Dose EPS medidose.com | IB701 | Used to store the following; autoclaved plugs, biochips that have been cleaned, seeded biochips. |
| Paper heat-seal sterilization pouches, 7 ½” x 13” | CardinalHealth www.cardinalhealth.com | 90713 | Used for autoclaving tubing and fittings and plugs. |
| Quantos automated powder dispenser | Mettler Toledo www.mt.com | QB5 | Automated dispension of 60 mg aliquots of powdered L-15ex into 0.1 dram vials. |
| ECIS reader | Nanohmics, Inc. www.nanohmics.com | Custom-made by Nanohmics, Inc. Seeded biochip is inserted into the reader for conducting water toxicity testing. | |
| 3 X 5 metalized 2.5 mil polypropylene reclosable bags | Uline www.uline.com | S-16893 | Packaging and storage for both seeded biochips and powdered L-15ex media vials. |
| Leatherman squirt ps4 | Amazon www.Amazon.com | Used to open powdered media vials. | |
| 1 gram silica gel desiccant packets | Uline www.uline.com | S-3902 | Put in polypropylene bags with L-15ex powdered media vials to prevent the powder from picking up moisture. |
| Sterile 250 or 500 mL Nalgene bottles | Fisher Scientific www.fishersci.com |
09-740-25C or E | Hold cell suspensions for seeding ECIS chips in biohood. |
| Plugs for biochips | Nanohmics, Inc. www.nanohmics.com | Custom-made by Nanohmics, Inc. Used to seal ports on biochips before storage @ 6°C. | |
| Drains for ECIS biochips | Nanohmics, Inc. www.nanohmics.com | Custom-made by Nanohmics, Inc. Placed on 2 inner ports on biochips prior to insertion in ECIS reader. Allows for excess media to drain from channels during test injections. | |
| Hemocytometer | Fisher Scientific www.fishersci.com |
S17040 | Needed for counting cells prior to adjusting cell suspension for injection into biochips. |
| Brightfield microscope w/ 10X objective | Leitz Labovert | Any brightfield microscope is acceptable. | |
| Class II biological safety cabinet | Any class II biological safety cabinet where cell culture can be performed under sterile conditions is acceptable. | ||
| Microcentrifuge tubes, 0.6 mL | Fisher Scientific www.fishersci.com |
02-681-311 | Holds 1 mL of cell suspension prior to counting cells. |
| Slip 10 cc red syringes | Procedure Products, Inc. www.procedureproducts.com | S/49S 30-R | Withdraws 9 mL of test water sample and used to inject sample into biochip. |
| Slip 10 cc blue syringes | Procedure Products, Inc. www.procedureproducts.com | S/49S 30-B | Withdraws 9 mL of control water sample and used to inject sample into biochip. |
| ½ oz. clear pet plastic jar w/ white ribbed lined caps | SKS Bottle & Packaging, Inc. www.sks-bottle.com | 0605-30 | Sample vials used for mixing L-15ex powder and 10 mL of water sample for testing. |
| 50 mL sterile conical polypropylene centrifuge tubes | Fisher Scientific www.fishersci.com | 12-565-269 | Used to hold 40 mL aliquots of 10 ug/mL fibronectin @ -20 °C. |
References
- Pancrazio, J. J., Whelan, J. P., Borkholder, D. A., Ma, A., Stenger, D. A. Development and application of cell-based biosensors. Ann. Biomed. Eng. 27, 697-711 (1999).
- States, S., Scheuring, M., Kuchta, J., Newberry, J., Casson, L. Utility-based analytical methods to ensure public water supply security. J. Am. Water Works Assoc. 95, 103-115 (2003).
- Kelly, T., Baxter, W., McCauley, M., Koglin, E. Testing of Screening Technologies for Detection of Toxic Industrial Chemicals in All Hazards Receipt Facilities. EPA/600/R-08/034. , 1-25 (2008).
- van der Schalie, W. H., James, R. R., Gargan, T. P. Selection of a battery of rapid toxicity sensors for drinking water evaluation. Biosens. Bioelectron. 22, 18-27 (2006).
- Iuga, A., Lerner, E., Shedd, T. R., van der Schalie, W. H. Rapid responses of a melanophore cell line to chemical contaminants in water. J. Appl. Toxicol. 29, 346-349 (2009).
- Curtis, T. M., et al. Suitability of invertebrate and vertebrate cells in a portable impedance-based toxicity sensor: temperature mediated impacts on long-term survival. Toxicol In Vitro. 27, 2016-2066 (2013).
- Brennan, L. M., Widder, M. W., Lee, L. E. J., van der Schalie, W. H. Long-term storage and impedence-based water toxicity testing capabilities of fluidic biochips seeded with RTgill-W1 cells. Toxicol In Vitro. 26, 736-745 (2012).
- Widder, M. W., Brennan, L. M., Hanft, E. A., Schrock, M. E., James, R. R., van der Schalie, W. H. Evaluation and refinement of a field-portable drinking water toxicity sensor and a fluidic biochip. J. Appl. Toxicol. , (2014).
- O’Shaughnessy, T. J., Gray, S. A., Pancrazio, J. J. Cultured neuronal networks as environmental biosensors. J. Appl.Toxicol. 24, 379-385 (2004).
- Eltzov, E., Marks, R. S. Whole-cell aquatic biosensors. Anal. Bioanal. Chem. 400, 895-913 (2011).
- Giaever, I., Keese, C. R. A morphological biosensor for mammalian cells. Nature. 366, 591-592 (1993).
- Curtis, T. M., et al. A portable cell-based impedance sensor for toxicity testing of drinking water. Lab on a Chip. 9, 2176-2183 (2009).
- Xiao, C., Luong, J. H. T. Assessment of cytotoxicity by emerging impedance spectroscopy. Toxicol. .Appl. Pharmacol. 206 (2), 102-112 (2005).
- Xing, J. Z., Zhu, L., Gabos, S., Xie, L. Microelectronic cell sensor assay for detection of cytotoxicity and prediction of acute toxicity. Toxicol. In Vitro. 20, 995-1004 (2006).
- Lee, L. E. J., Dayeh, V. R., Schirmer, K., Bols, N. C. Applications and potential uses of fish gill cell lines: examples with RTgill-W1. In Vitro Cell. Develop. Biol.- Animal. 45, 127-134 (2009).
- . RT-gill-W1 (ATCC CRL-2523) Culture Method. American Type Culture Collection (ATCC). , (2015).

