Produção e medição de partículas orgânicas na câmara ambiental de Harvard
Summary
Este artigo descreve os procedimentos de operação para a câmara ambiental de Harvard (HEC) e relacionados a instrumentação para medição de gases e partículas espécies. A câmara ambiental é usada para produzir e estudar as espécies secundárias orgânicas produzidas a partir dos precursores orgânicos, especialmente relacionados com partículas orgânicas atmosférica.
Abstract
A produção e a evolução da atmosfera orgânico particulado (PM) são insuficientemente compreendidos para simulações precisas de química atmosférica e clima. Os mecanismos de produção complexa e caminhos de reação fazem este tópico de pesquisa desafiador. Para solucionar esses problemas, é necessária uma câmara ambiental, proporcionando bastante tempo de residência e fechar-para-concentrações de precursores para matérias orgânicas secundárias. A câmara ambiental de Harvard (HEC) foi construída para atender a essa necessidade, simulando a produção de espécies de fase de gás e partículas de compostos orgânicos voláteis (COV). O HEC tem um volume de 4,7 m3 e um tempo médio de permanência de 3,4 h sob condições típicas de operação. É operado como um reator de fluxo completamente misto (CMFR), fornecendo a possibilidade de operação por tempo indefinido de estado estacionário em dias para amostra coleta e análise de dados. Os procedimentos de operação são descritos em detalhes neste artigo. Vários tipos de instrumentação são usados para caracterizar o gás produzido e partículas. Um de alta resolução espectrómetro de massa de aerossol tempo-de-luta (HR-ToF-AMS) é usado para caracterizar as partículas. Um espectrômetro de massa de reação de transferência de próton (PTR-MS) é usado para análise de gases. Resultados de exemplo são apresentados para mostrar o uso da câmara ambiental em uma ampla variedade de aplicações relacionadas com as propriedades físico-químicas e mecanismos de reação de orgânico particulado atmosférico.
Introduction
Atmosférico orgânico particulado (PM) é produzido a partir da oxidação de compostos orgânicos voláteis (COV) emitida pela biosfera e actividades antropogénicas1,2. Apesar dos importantes efeitos destes aerossol partículas sobre alterações climáticas, saúde humana e visibilidade3, os mecanismos de produção permanecem incompletamente compreendido e caracterizada, tanto qualitativa como quantitativamente. Um desafio para os estudos de laboratório, que são necessariamente de âmbito limitado e tempo, é simular a evolução atmosférica de gases e partículas espécies de fase. Tempos de residência devem ser longa o suficiente para que os compostos em fases de gás e de partículas podem sofrer oxidação e reação multifásica como fariam em ambientes ambiente4,5,6,7, 8. Outro desafio é trabalhar no laboratório em concentrações suficientemente baixos que representam o ambiente9,10,11. Muitos processos importantes de escala com concentrações. Por exemplo, excessivamente alta concentração em massa de orgânico PM em um experimento de laboratório erroneamente pode deslocar o particionamento de espécies semivolatile da fase gasosa para a fase de partícula. A composição das fases de gás e partículas pode se tornar não-representativo das condições atmosféricas. Câmara ambiental de Harvard foi concebida para responder a estes desafios, principalmente usando a abordagem de uma configuração de fluxo contínuo, operada em uma escala de tempo indeterminada, permitindo baixas concentrações e tempos de integração longo para detecção do sinal. A câmara celebra um milestone aniversário de doze anos de descoberta científica em 2018.
Câmaras ambientais variam com base na fonte de luz, o fluxo de mistura sistema, tamanho e o número de câmaras que operam juntos. Existem câmaras exteriores que recebem luz solar natural12,13 , bem como a câmara interior que operam com luz artificial14,15,16,17,18 ,19,20,21. Câmaras exteriores também podem ser construídas relativamente grandes, minimizando artefatos que podem ser introduzidos por efeitos de parede, embora os desafios incluem a variação da iluminação por causa de nuvens, bem como a variação de temperatura. Embora câmaras interiores cuidadosamente podem controlar a temperatura e umidade relativa do ar, a intensidade e o espectro da luz artificial são geralmente diferentes da luz do sol natural, que pode afetar certas reações fotoquímicas14. Câmaras também podem ser operadas como reatores em batelada ou de fluxo misto completamente reatores (CMFR)22. Reatores em batelada são geralmente mais fáceis de operar e manter, mas CMFR pode ser operado por semanas, conforme necessário, para permitir a integração do sinal e assim trabalhar em concentrações baixas, a atmosfera relevantes.
Neste documento, o hardware e a operação do Harvard câmara ambiental (HEC)7,23,24,25 são descritas em detalhes. O HEC é composto por um saco de Teflon de PFA 4,7 m3 alojado dentro de uma câmara de temperatura constante (2,5 × 2,5 × 2,75 m3)26. Folhas de alumínio reflexivo cobrem as paredes internas da câmara para permitir iluminação vários caminhos através do saco e, assim, aumentar a taxa da fotoquímica. O HEC é operado como um CMFR, usando uma taxa de fluxo total de 21 sLpm e correspondente a um tempo médio de permanência de 3,4 h27. Temperatura, umidade e concentração de ozônio são mantidas pelos controles de gabarito. Partículas de sulfato de amônio são utilizadas como partículas de semente para imitar a condensação dos componentes orgânicos em partículas inorgânicas em meio ambiente. O diâmetro do modo das partículas de sulfato inorgânico é selecionado para ser 100-200 nm para simular os tamanhos de partículas medidos no campo28. Procedimentos de operação são descritos na seção de protocolo neste documento, incluindo uma apresentação visual, seguida de uma breve discussão de aplicações e os resultados de pesquisas do HEC.
Protocol
Representative Results
Discussion
A crescente importância na compreensão da formação e evolução de aerossóis orgânicos leva à vontade de construir câmaras ambientais para simular tais processos em um ambiente bem controlado. Actualmente, a maioria das câmaras ambientais é com base no lote reator modo19,31,32,33,34 enquanto tem havido muito poucas câmaras que utilizam continuamente mistura reator modo15,35. Operar a câmara ambiental no continuamente modo de reator de fluxo fornece a conveniência de aerossol contínuo de amostragem para dias ou mesmo semanas no ambiente, como as concentrações. É interessante notar que as condições ambientais são muito mais complexas do que as configurações de laboratório bem controlados. Por exemplo, a temperatura do ambiente varia enquanto na câmara é mantido em um valor constante. O tempo de reação dos gases e partículas na câmara será controlado e limitado a residência da câmara, em vez de alcançar dias de tempo de reação no mundo real. O uso de blacklights, em vez de radiação solar natural, pode também gerar radicais OH e simular as reações na temperatura ambiente. Mas blacklight, às vezes, pode levar a concentração elevada de radicles OH comparado com os do ambiente, que pode afetar o estado de oxidação das moléculas orgânicas e precisa ser examinado cuidadosamente. No entanto, apenas uma ou duas variáveis de ajuste e controlando todas as outras variáveis através de câmara ambiental, podemos sistematicamente estudar estes processos físico/químico.
Dentre os passos críticos em operar continuamente câmaras de mistura é manter a pressão interna da câmara dentro do intervalo ideal. Uma alta pressão dentro da câmara irá causar vazamento de gases e partículas da câmara, enquanto uma baixa pressão dentro da câmara vai sugar ar e partículas do laboratório para a câmara e causar contaminação. Um calibre de pressão é necessária para controlar a pressão da câmara dentro de valores seguros (< 5 Pa) ao longo do curso dos experimentos. Outra questão observada comum para a câmara ambiental é auto nucleação de partículas orgânicas inesperado. Uma maior concentração de partículas de semente ou de uma menor taxa de injeção de COV/oxidante é necessária para evitar este fenômeno. Dependendo da finalidade dos experimentos, as concentrações de ozono, VOC e partículas de semente podem variar de uma ordem de magnitude. A seguinte equação pode ser usada para calcular a taxa de fluxo, finjeção, de cada espécie injetado na câmara.
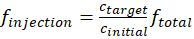 (1)
(1)
onde calvo e cinicial cada representam a concentração alvo final do reagente no interior da câmara e a concentração inicial do reagente que é gerado a partir da fonte. O símbolo ftotal representam o fluxo total de todas as espécies que foram injetados na câmara.
O terceiro passo crítico para operar a câmara ambiental e obtenção dos resultados com êxito é calibrar cada instrumento antes dos experimentos. O sistema SMPS pode ser calibrado através da injeção de tamanho conhecido do PSL partículas36. O analisador dex e de ozônio não são calibrados usando um 5ppm nenhum cilindro diluído por N2e 10 ppm de ozônio diluído por N2, respectivamente,26. Os procedimentos de calibração de AMS e PTR-MS são complicados e podem ser encontrados em manuais de instrumento ou anterior literaturas27,37.
A instalação de câmara ambiental descrita acima não é apenas adequado para estudar a produção e a evolução dos aerossóis orgânicos, mas também aplicável em revestimento de várias partículas com revestimento orgânico, bem como examinar as reações de fase de gás através da injeção de gás precursores apenas. Essas múltiplas direções fornecem câmara ambiental a flexibilidade em uma variedade de campos de pesquisa relacionados com a qualidade do ar, mudança climática e saúde humana tópicos a estudar.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este material é baseado em trabalho apoiado pelo programa de ciências ambientais da química da divisão de química de os E.U. nacional Science Foundation (NSF) sob o número 1111418, a divisão de Geociências-atmosférica de concessão da ciência nacional dos EUA Foundation (NSF) sob o número 1524731 de concessão, bem como prêmio de publicação de faculdade de Harvard. Reconhecemos Pengfei Liu, Qi Chen e Mikinori Kuwata para discussões úteis e assistência com os experimentos, bem como Eric Etcovitch por ser a narração do vídeo.
Materials
| (-)-α-pinene | Sigma-Aldrich | 305715 | |
| 2-butanol | Sigma-Aldrich | 294810 | |
| 5.00 mL syringe | Hamilton | 201300 | |
| Aerosol particle mass analyzer | Kanomax | 3600 | |
| Condensational particle counter | TSI | 3022 | |
| Differential mobility analyzer | TSI | 3081 | |
| Heating mantle | Cole-parmer | WU-36225-10 | |
| Mass flow controller | MKS | M100B | |
| Nafion tube | Perma Pure | MD-700-24F-1 | |
| Nanometer aerosol sampler | TSI | 3089 | |
| Ozone generator | Jelight | 600 | |
| Ozone monitor | Ecosensors | UV-100 | |
| Pressure sensor | Omega | PX409 | |
| RH sensor | Rotronic | 60587161 | |
| Round-bottom, three neck flask | Aceglass | 6944-04 | |
| Scanning electron microscope | Zeiss | N/A | Ultra plus FESEM |
| Scanning mobility particle sizer | TSI | 3071A+3772 | electrostatic classifier is model 3071A and the condensational particle ocunter is 3772 |
| Silicon substrate | University Wafer | 1707 | |
| Syringe Needle | Hamilton | 90025 | 25 G, 2 inch |
| Syringe pump | Chemyx | Fusion Touch 200 | |
| Temperature sensor | National Instrument | USB-TC01 | |
| water circulator | Brinkmann | RC6 |
References
- Hallquist, M., et al. The formation, properties and impact of secondary organic aerosol: current and emerging issues. Atmospheric Chemistry and Physics. 9, 5155-5236 (2009).
- Fehsenfeld, F., et al. Emissions of volatile organic compounds from vegetation and the implications for atmospheric chemistry. Global Biogeochemical Cycles. 6, 389-430 (1992).
- Seinfeld, J. H., Pandis, S. N. . Atmospheric Chemistry and Physics: from air pollution to climate change. , (2006).
- Zaveri, R. A., Easter, R. C., Shilling, J. E., Seinfeld, J. H. Modeling kinetic partitioning of secondary organic aerosol and size distribution dynamics: representing effects of volatility, phase state, and particle-phase reaction. Atmospheric Chemistry and Physics. , 5153-5181 (2014).
- Shiraiwa, M., Berkemeier, T., Schilling-Fahnestock, K. A., Seinfeld, J. H., Pöschl, U. Molecular corridors and kinetic regimes in the multiphase chemical evolution of secondary organic aerosol. Atmospheric Chemistry and Physics. 14, 8323-8341 (2014).
- Ziemann, P. J., Atkinson, R. Kinetics, products, and mechanisms of secondary organic aerosol formation. Chemical Society Reviews. 41, 6582-6605 (2012).
- Chen, Q., Liu, Y., Donahue, N. M., Shilling, J. E., Martin, S. T. Particle-Phase Chemistry of Secondary Organic Material: Modeled Compared to Measured O:C and H:C Elemental Ratios Provide Constraints. Environmental Science and Technology. 45, 4763-4770 (2011).
- Liu, P., et al. Highly Viscous States Affect the Browning of Atmospheric Organic Particulate Matter. ACS Central Science. 4 (2), 207-215 (2018).
- Jimenez, J. L., et al. Evolution of organic aerosols in the atmosphere. Science. 326, 1525-1529 (2009).
- Goldstein, A. H., Galbally, I. E. Known and unexplored organic constituents in the earth’s atmosphere. Environmental Science and Technology. 41, 1514-1521 (2007).
- Martin, S. T., et al. Sources and properties of Amazonian aerosol particles. Review of Geophysics. 48, RG2002 (2010).
- Zhang, H., Surratt, J. D., Lin, Y. H., Bapat, J., Kamens, R. M. Effect of relative humidity on SOA formation from isoprene/NO photooxidation: enhancement of 2-methylglyceric acid and its corresponding oligoesters under dry conditions. Atmospheric Chemistry and Physics. 11, 6411-6424 (2011).
- Rohrer, F., et al. Characterisation of the photolytic HONO-source in the atmosphere simulation chamber SAPHIR. Atmospheric Chemistry and Physics. 5, 2189-2201 (2005).
- Cocker, D. R., Flagan, R. C., Seinfeld, J. H. State-of-the-art chamber facility for studying atmospheric aerosol chemistry. Environmental Science and Technology. 35, 2594-2601 (2001).
- Shilling, J. E., et al. Loading-dependent elemental composition of α-pinene SOA particles. Atmospheric Chemistry and Physics. 9, 771-782 (2009).
- Presto, A. A., Huff Hartz, K. E., Donahue, N. M. Secondary organic aerosol production from terpene ozonolysis. 1. effect of UV radiation. Environmental Science and Technology. 39, 7036-7045 (2005).
- Epstein, S. A., Blair, S. L., Nizkorodov, S. A. Direct photolysis of α-pinene ozonolysis secondary organic aerosol: effect on particle mass and peroxide content. Environmental Science and Technology. 48, 11251-11258 (2014).
- Boyd, C. M., et al. Secondary organic aerosol formation from the β-pinene+NO3 system: effect of humidity and peroxy radical fate. Atmospheric Chemistry and Physics. 15, 7497-7522 (2015).
- Xu, L., Kollman, M. S., Song, C., Shilling, J. E., Ng, N. L. Effects of NOx on the volatility of secondary organic aerosol from isoprene photooxidation. Environmental Science and Technology. 48, 2253-2262 (2014).
- Loza, C. L., et al. Characterization of vapor wall loss in laboratory chambers. Environmental Science and Technology. 44, 5074-5078 (2010).
- Lin, Y. H., et al. Isoprene epoxydiols as precursors to secondary organic aerosol formation: acid-catalyzed reactive uptake studies with authentic compounds. Environmental Science and Technology. 46, 250-258 (2012).
- Martin, S. T., Kuwata, M., Smith, M. L. An analytic equation for the volume fraction of condensationally grown mixed particles and applications to secondary organic material produced in continuously mixed flow reactors. Aerosol Science and Technology. 48, 803-812 (2014).
- Bateman, A. P., Bertram, A. K., Martin, S. T. Hygroscopic Influence on the Semisolid-to-Liquid Transition of Secondary Organic Materials. Journal of Physical Chemistry A. 119, 4386-4395 (2015).
- Shilling, J. E., King, S. M., Mochida, M., Worsnop, D. R., Martin, S. T. Mass spectral evidence that small changes in composition caused by oxidative aging processes alter aerosol CCN properties. The Journal of Physical Chemistry A. 111, 3358-3368 (2007).
- Smith, M. L., Kuwata, M., Martin, S. T. Secondary Organic Material Produced by the Dark Ozonolysis of alpha-Pinene Minimally Affects the Deliquescence and Efflorescence of Ammonium Sulfate. Aerosol Science and Technology. 45, 244-261 (2011).
- King, S. M., Rosenoern, T., Shilling, J. E., Chen, Q., Martin, S. T. Increased cloud activation potential of secondary organic aerosol for atmospheric mass loadings. Atmospheric Chemistry and Physics. 9, 2959-2971 (2009).
- Shilling, J. E., et al. Particle mass yield in secondary organic aerosol formed by the dark ozonolysis of α-pinene. Atmospheric Chemistry and Physics. 8, 2073-2088 (2008).
- Nguyen, T. K. V., et al. Trends in particle-phase liquid water during the Southern Oxidant and Aerosol Study. Atmospheric Chemistry and Physics. 14, 10911-10930 (2014).
- Nah, T., McVay, R. C., Pierce, J. R., Seinfeld, J. H., Ng, N. L. Constraining uncertainties in particle-wall deposition correction during SOA formation in chamber experiments. Atmospheric Chemistry and Physics. 17, 2297-2310 (2017).
- Reineking, A., Porstendörfer, J. Measurements of Particle Loss Functions in a Differential Mobility Analyzer (TSI, Model 3071) for Different Flow Rates. Aerosol Science and Technology. 5, 483-486 (1986).
- Kroll, J. H., Seinfeld, J. H. Chemistry of secondary organic aerosol: Formation and evolution of low-volatility organics in the atmosphere. Atmospheric Environment. 42, 3593-3624 (2008).
- Surratt, J. D., et al. Reactive intermediates revealed in secondary organic aerosol formation from isoprene. Proceedings of the National Academy of Sciences USA. 107, 6640-6645 (2010).
- Surratt, J. D., et al. Effect of Acidity on Secondary Organic Aerosol Formation from Isoprene. Environmental Science and Technology. 41, 5363-5369 (2007).
- Isaacman-VanWertz, G., et al. Chemical evolution of atmospheric organic carbon over multiple generations of oxidation. Nature Chemistry. 10, 462-468 (2018).
- Docherty, K. S., et al. Trends in the oxidation and relative volatility of chamber-generated secondary organic aerosol. Aerosol Science and Technology. , 1-13 (2018).
- Wiedensohler, A., et al. Mobility particle size spectrometers: Calibration procedures and measurement uncertainties. Aerosol Science and Technology. 52, 146-164 (2018).
- Warneke, C., de Gouw, J. A., Kuster, W. C., Goldan, P. D., Fall, R. Validation of Atmospheric VOC Measurements by Proton-Transfer- Reaction Mass Spectrometry Using a Gas-Chromatographic Preseparation Method. Environmental Science and Technology. 37, 2494-2501 (2003).

