Producción y medición de la materia orgánica particulada en la cámara ambiental de Harvard
Summary
Este documento describe los procedimientos de operación para la cámara ambiental de Harvard (HEC) y relacionados con instrumentación para medición de gases y partículas especies. La cámara se utiliza para producir y estudiar especies secundarias orgánicas producidas a partir de los precursores orgánicos, especialmente relacionadas con orgánico particulado atmosférico.
Abstract
La producción y la evolución de la materia particulada orgánica atmosférica (PM) se entienden suficientemente para simulaciones precisas de química de la atmósfera y el clima. Los mecanismos de producción compleja y vías de reacción hacen de este un tema difícil de la investigación. Para abordar estas cuestiones, es necesario una cámara ambiental, proporcionando suficiente tiempo de residencia y las concentraciones de precursores cerca al ambiente de materiales orgánicos secundarios. La cámara ambiental de Harvard (HEC) fue construido para servir esta necesidad, que simula la producción de gas y partículas fase especies de compuestos orgánicos volátiles (COV). La HEC cuenta con un volumen de 4,7 m3 y un tiempo de residencia media de 3,4 h bajo condiciones de operación típicas. Se funciona como un reactor de flujo completamente mezclado (CMFR), ofreciendo la posibilidad de operación de estado estacionario indefinida en días para la muestra recogida y análisis de datos. Los procedimientos de operación se describen en detalle en este artículo. Varios tipos de instrumentación se utilizan para caracterizar el gas producido y las partículas. Un espectrómetro de masas de Aerosol tiempo de lucha alta resolución (HR-ToF-AMS) se utiliza para caracterizar las partículas. Un espectrómetro de masas de la reacción de transferencia de protones (PTR-MS) se utiliza para análisis de gases. Se presentan resultados de ejemplo para mostrar el uso de la cámara en una amplia variedad de aplicaciones relacionadas con las propiedades fisicoquímicas y mecanismos de reacción de la materia orgánica de partículas atmosférica.
Introduction
Atmosférico orgánico particulado (PM) se produce de la oxidación de compuestos orgánicos volátiles (COV) emitidos por la Biosfera y las actividades antropogénicas1,2. A pesar de los efectos importantes de estos aerosol partículas en los mecanismos de producción y visibilidad3, clima, salud humana, permanecen incompletamente entendido y caracterizado, tanto cualitativa y cuantitativamente. Un reto para los estudios de laboratorio, que son necesariamente de alcance limitado y el tiempo, es para simular la evolución atmosférica de especie de fase gas y partículas. Tiempos de residencia deben ser lo suficientemente largos que compuestos en fases de gas y las partículas pueden sufrir oxidación y reacción multifase como lo harían en ambientes ambiente4,5,6,7, 8. Otro reto es trabajar en el laboratorio a concentraciones lo suficientemente bajas que representan el ambiente9,10,11. Escala de muchos procesos importantes con concentraciones. Por ejemplo, excesiva concentración en masa de PM orgánico en un experimento de laboratorio erróneamente puede cambiar la partición de semivolátiles especie desde la fase gaseosa a la fase de partículas. La composición de las fases de gas y partículas puede ser no representativa de las condiciones atmosféricas. La cámara ambiental de Harvard fue diseñada para responder a estos desafíos, principalmente mediante el enfoque de una configuración de flujo continuo operado bajo un plazo indefinido, lo que permite concentraciones bajas y tiempos largos de integración para detección de señal. La cámara celebra un hito aniversario de doce años de descubrimiento científico en el 2018.
Cámaras ambientales varían en función de la fuente de luz, el flujo de mezcla sistema, tamaño y el número de cámaras que operan juntos. Hay cámaras al aire libre que reciben luz del sol natural12,13 , así como cámara interior que operan con luz artificial14,15,16,17,18 ,19,20,21. Cámaras al aire libre también se pueden construir artefactos relativamente grandes, reduciendo al mínimo que pueden ser introducidos por efectos de pared, aunque la variación de iluminación entre los desafíos debido a las nubes así como la variación en temperatura. Aunque cámaras interior pueden controlar temperatura y humedad relativa, la intensidad y el espectro de la luz artificial son generalmente diferentes de la luz del sol natural, que puede afectar a ciertas reacciones fotoquímicas14. Cámaras pueden utilizarse también como reactores batch o flujo completamente mezclado reactores (CMFR)22. Reactores por lotes son generalmente más fáciles de operar y mantener pero CMFR puede funcionar durante semanas, según sea necesario, para permitir la integración de la señal y así trabajar en concentraciones bajas, atmosférico relevantes.
En el presente, el hardware y el funcionamiento de la cámara ambiental Harvard (HEC)7,23,24,25 se describen en detalle. La HEC consiste en una bolsa de teflón PFA de 4,7 m3 ubicada dentro de una cámara de temperatura constante (2.5 × 2.5 × 2.75 m3)26. Láminas de aluminio reflectante cubren las paredes internas de la cámara para permitir iluminación múltiple a través de la bolsa y así aumentar la tasa de la fotoquímica. La HEC se funciona como un CMFR, utilizando un caudal total de 21 sLpm y correspondiente a un tiempo de residencia media de 3,4 h27. Temperatura, humedad y concentración de ozono se mantienen controles de retroalimentación. Partículas de sulfato de amonio se utilizan como partículas de semilla para imitar la condensación de compuestos orgánicos en partículas inorgánicas en el ambiente. El diámetro de modo de las partículas de sulfato inorgánico es seleccionado para ser 100 y 200 nm para simular los tamaños de partícula medidos en el campo28. Procedimientos de operación se describen en la sección de protocolo, incluyendo una presentación visual, seguida de una breve discusión de aplicaciones y resultados de investigación de la HEC.
Protocol
Representative Results
Discussion
La importancia cada vez mayor en la comprensión de la formación y evolución de los aerosoles orgánicos conduce a la urgencia de construir cámaras ambientales para simular estos procesos en un entorno bien controlado. En la actualidad, la mayoría de las cámaras de medio ambiente se basa en batch reactor modo19,31,32,33,34 mientras que ha habido muy pocas cámaras que utilizan continuamente mezcla reactor de15,de modo35. La cámara en modo de reactor de flujo continuo de operación brinda la comodidad de aerosol continuo de muestreo para días o incluso semanas en ambiente similares concentraciones. Cabe señalar que las condiciones ambientales son mucho más complejas que los valores de laboratorio bien controladas. Por ejemplo, la temperatura del ambiente fluctúa mientras que en la cámara se mantiene a un valor constante. El tiempo de reacción de los gases y partículas en la cámara será controlado y limitado por la residencia de la cámara, en lugar de llegar a días de tiempo de reacción en el mundo real. El uso de blacklights, en vez de natural radiación solar, también puede generar a los radicales OH y simular las reacciones en el ambiente. Pero negra a veces puede llevar a la concentración elevada de radículas OH comparados con ésos en el ambiente, que puede afectar el estado de oxidación de las moléculas orgánicas y debe ser cuidadosamente examinados. Sin embargo, por sólo una o dos variables de ajuste y control de todas las otras variables a través de la cámara, podemos estudiar sistemáticamente estos procesos químicos/físicos.
Uno de los pasos críticos en la operación de cámaras de mezcla continuamente es mantener la presión interna de la cámara dentro de un rango óptimo. Una alta presión dentro de la cámara provocará fugas de los gases y las partículas en la cámara, mientras que una baja presión dentro de la cámara será aspirar aire y las partículas del laboratorio en la cámara y causar contaminación. Es necesario un manómetro para controlar la presión de la cámara en valores seguros (< 5 Pa) durante el curso de los experimentos. Otro problema común observado para la cámara es la nucleación de inesperado partícula orgánica. Una menor tasa de inyección de VOC/oxidante o una mayor concentración de partículas de semilla es necesario para evitar este fenómeno. Dependiendo de la finalidad de los experimentos, las concentraciones de ozono, compuestos orgánicos volátiles y partículas de semilla pueden variar en un orden de magnitud. La siguiente ecuación puede utilizarse para calcular la tasa de flujo, finyección, de cada especie que se inyecta en la cámara.
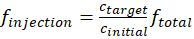 (1)
(1)
donde cblanco y cinicial cada representan la concentración de destino final de lo reactivo dentro de la cámara y la concentración inicial de lo reactivo que se genera de la fuente. El símbolo ftotal representa el flujo total de todas las especies que se inyecta en la cámara.
El tercer paso crítico para operar la cámara con éxito y obtener los resultados es calibrar cada instrumento antes de los experimentos. El sistema SMPS puede calibrarse mediante la inyección de tamaño conocido de los PSL partículas36. El analizador NOx y ozono son calibrados usando un 5 ppm NO cilindro diluido por N2y 10 ppm de ozono diluido por N2, respectivamente26. Los procedimientos de calibración de AMS y PTR-MS son complicados y pueden encontrarse en manuales de instrumento o anteriores literaturas27,37.
La configuración de la cámara ambiental descrita anteriormente es no sólo conveniente para el estudio de la producción y la evolución de los aerosoles orgánicos, pero también aplicable en varias partículas con recubrimiento orgánico, así como examinar las reacciones de la fase de gas mediante la inyección de gas de la capa sólo precursores. Estas múltiples direcciones proporcionan cámara la flexibilidad en el estudio de una variedad de campos de investigación relacionados con la calidad del aire, cambio climático y temas de salud humana.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este material está basado en trabajo apoyado por el programa de Ciencias de la química ambiental en la división de química de la Estados Unidos National Science Foundation (NSF) bajo la concesión número 1111418, la división de Geociencias atmosférica de la ciencia nacional de Estados Unidos Foundation (NSF) bajo la concesión número 1524731, así como el Premio de publicación de Facultad de Harvard. Reconocemos Pengfei Liu, Qi Chen y Mikinori Kuwata para discusiones útiles y ayuda con los experimentos, así como Eric Etcovitch por ser la voz en OFF del vídeo.
Materials
| (-)-α-pinene | Sigma-Aldrich | 305715 | |
| 2-butanol | Sigma-Aldrich | 294810 | |
| 5.00 mL syringe | Hamilton | 201300 | |
| Aerosol particle mass analyzer | Kanomax | 3600 | |
| Condensational particle counter | TSI | 3022 | |
| Differential mobility analyzer | TSI | 3081 | |
| Heating mantle | Cole-parmer | WU-36225-10 | |
| Mass flow controller | MKS | M100B | |
| Nafion tube | Perma Pure | MD-700-24F-1 | |
| Nanometer aerosol sampler | TSI | 3089 | |
| Ozone generator | Jelight | 600 | |
| Ozone monitor | Ecosensors | UV-100 | |
| Pressure sensor | Omega | PX409 | |
| RH sensor | Rotronic | 60587161 | |
| Round-bottom, three neck flask | Aceglass | 6944-04 | |
| Scanning electron microscope | Zeiss | N/A | Ultra plus FESEM |
| Scanning mobility particle sizer | TSI | 3071A+3772 | electrostatic classifier is model 3071A and the condensational particle ocunter is 3772 |
| Silicon substrate | University Wafer | 1707 | |
| Syringe Needle | Hamilton | 90025 | 25 G, 2 inch |
| Syringe pump | Chemyx | Fusion Touch 200 | |
| Temperature sensor | National Instrument | USB-TC01 | |
| water circulator | Brinkmann | RC6 |
References
- Hallquist, M., et al. The formation, properties and impact of secondary organic aerosol: current and emerging issues. Atmospheric Chemistry and Physics. 9, 5155-5236 (2009).
- Fehsenfeld, F., et al. Emissions of volatile organic compounds from vegetation and the implications for atmospheric chemistry. Global Biogeochemical Cycles. 6, 389-430 (1992).
- Seinfeld, J. H., Pandis, S. N. . Atmospheric Chemistry and Physics: from air pollution to climate change. , (2006).
- Zaveri, R. A., Easter, R. C., Shilling, J. E., Seinfeld, J. H. Modeling kinetic partitioning of secondary organic aerosol and size distribution dynamics: representing effects of volatility, phase state, and particle-phase reaction. Atmospheric Chemistry and Physics. , 5153-5181 (2014).
- Shiraiwa, M., Berkemeier, T., Schilling-Fahnestock, K. A., Seinfeld, J. H., Pöschl, U. Molecular corridors and kinetic regimes in the multiphase chemical evolution of secondary organic aerosol. Atmospheric Chemistry and Physics. 14, 8323-8341 (2014).
- Ziemann, P. J., Atkinson, R. Kinetics, products, and mechanisms of secondary organic aerosol formation. Chemical Society Reviews. 41, 6582-6605 (2012).
- Chen, Q., Liu, Y., Donahue, N. M., Shilling, J. E., Martin, S. T. Particle-Phase Chemistry of Secondary Organic Material: Modeled Compared to Measured O:C and H:C Elemental Ratios Provide Constraints. Environmental Science and Technology. 45, 4763-4770 (2011).
- Liu, P., et al. Highly Viscous States Affect the Browning of Atmospheric Organic Particulate Matter. ACS Central Science. 4 (2), 207-215 (2018).
- Jimenez, J. L., et al. Evolution of organic aerosols in the atmosphere. Science. 326, 1525-1529 (2009).
- Goldstein, A. H., Galbally, I. E. Known and unexplored organic constituents in the earth’s atmosphere. Environmental Science and Technology. 41, 1514-1521 (2007).
- Martin, S. T., et al. Sources and properties of Amazonian aerosol particles. Review of Geophysics. 48, RG2002 (2010).
- Zhang, H., Surratt, J. D., Lin, Y. H., Bapat, J., Kamens, R. M. Effect of relative humidity on SOA formation from isoprene/NO photooxidation: enhancement of 2-methylglyceric acid and its corresponding oligoesters under dry conditions. Atmospheric Chemistry and Physics. 11, 6411-6424 (2011).
- Rohrer, F., et al. Characterisation of the photolytic HONO-source in the atmosphere simulation chamber SAPHIR. Atmospheric Chemistry and Physics. 5, 2189-2201 (2005).
- Cocker, D. R., Flagan, R. C., Seinfeld, J. H. State-of-the-art chamber facility for studying atmospheric aerosol chemistry. Environmental Science and Technology. 35, 2594-2601 (2001).
- Shilling, J. E., et al. Loading-dependent elemental composition of α-pinene SOA particles. Atmospheric Chemistry and Physics. 9, 771-782 (2009).
- Presto, A. A., Huff Hartz, K. E., Donahue, N. M. Secondary organic aerosol production from terpene ozonolysis. 1. effect of UV radiation. Environmental Science and Technology. 39, 7036-7045 (2005).
- Epstein, S. A., Blair, S. L., Nizkorodov, S. A. Direct photolysis of α-pinene ozonolysis secondary organic aerosol: effect on particle mass and peroxide content. Environmental Science and Technology. 48, 11251-11258 (2014).
- Boyd, C. M., et al. Secondary organic aerosol formation from the β-pinene+NO3 system: effect of humidity and peroxy radical fate. Atmospheric Chemistry and Physics. 15, 7497-7522 (2015).
- Xu, L., Kollman, M. S., Song, C., Shilling, J. E., Ng, N. L. Effects of NOx on the volatility of secondary organic aerosol from isoprene photooxidation. Environmental Science and Technology. 48, 2253-2262 (2014).
- Loza, C. L., et al. Characterization of vapor wall loss in laboratory chambers. Environmental Science and Technology. 44, 5074-5078 (2010).
- Lin, Y. H., et al. Isoprene epoxydiols as precursors to secondary organic aerosol formation: acid-catalyzed reactive uptake studies with authentic compounds. Environmental Science and Technology. 46, 250-258 (2012).
- Martin, S. T., Kuwata, M., Smith, M. L. An analytic equation for the volume fraction of condensationally grown mixed particles and applications to secondary organic material produced in continuously mixed flow reactors. Aerosol Science and Technology. 48, 803-812 (2014).
- Bateman, A. P., Bertram, A. K., Martin, S. T. Hygroscopic Influence on the Semisolid-to-Liquid Transition of Secondary Organic Materials. Journal of Physical Chemistry A. 119, 4386-4395 (2015).
- Shilling, J. E., King, S. M., Mochida, M., Worsnop, D. R., Martin, S. T. Mass spectral evidence that small changes in composition caused by oxidative aging processes alter aerosol CCN properties. The Journal of Physical Chemistry A. 111, 3358-3368 (2007).
- Smith, M. L., Kuwata, M., Martin, S. T. Secondary Organic Material Produced by the Dark Ozonolysis of alpha-Pinene Minimally Affects the Deliquescence and Efflorescence of Ammonium Sulfate. Aerosol Science and Technology. 45, 244-261 (2011).
- King, S. M., Rosenoern, T., Shilling, J. E., Chen, Q., Martin, S. T. Increased cloud activation potential of secondary organic aerosol for atmospheric mass loadings. Atmospheric Chemistry and Physics. 9, 2959-2971 (2009).
- Shilling, J. E., et al. Particle mass yield in secondary organic aerosol formed by the dark ozonolysis of α-pinene. Atmospheric Chemistry and Physics. 8, 2073-2088 (2008).
- Nguyen, T. K. V., et al. Trends in particle-phase liquid water during the Southern Oxidant and Aerosol Study. Atmospheric Chemistry and Physics. 14, 10911-10930 (2014).
- Nah, T., McVay, R. C., Pierce, J. R., Seinfeld, J. H., Ng, N. L. Constraining uncertainties in particle-wall deposition correction during SOA formation in chamber experiments. Atmospheric Chemistry and Physics. 17, 2297-2310 (2017).
- Reineking, A., Porstendörfer, J. Measurements of Particle Loss Functions in a Differential Mobility Analyzer (TSI, Model 3071) for Different Flow Rates. Aerosol Science and Technology. 5, 483-486 (1986).
- Kroll, J. H., Seinfeld, J. H. Chemistry of secondary organic aerosol: Formation and evolution of low-volatility organics in the atmosphere. Atmospheric Environment. 42, 3593-3624 (2008).
- Surratt, J. D., et al. Reactive intermediates revealed in secondary organic aerosol formation from isoprene. Proceedings of the National Academy of Sciences USA. 107, 6640-6645 (2010).
- Surratt, J. D., et al. Effect of Acidity on Secondary Organic Aerosol Formation from Isoprene. Environmental Science and Technology. 41, 5363-5369 (2007).
- Isaacman-VanWertz, G., et al. Chemical evolution of atmospheric organic carbon over multiple generations of oxidation. Nature Chemistry. 10, 462-468 (2018).
- Docherty, K. S., et al. Trends in the oxidation and relative volatility of chamber-generated secondary organic aerosol. Aerosol Science and Technology. , 1-13 (2018).
- Wiedensohler, A., et al. Mobility particle size spectrometers: Calibration procedures and measurement uncertainties. Aerosol Science and Technology. 52, 146-164 (2018).
- Warneke, C., de Gouw, J. A., Kuster, W. C., Goldan, P. D., Fall, R. Validation of Atmospheric VOC Measurements by Proton-Transfer- Reaction Mass Spectrometry Using a Gas-Chromatographic Preseparation Method. Environmental Science and Technology. 37, 2494-2501 (2003).

