بروتوكول لإنتاج ناقلات لينتيفيرال إينتيجراسي التي تفتقر لخروج المغلوب كريسبر/Cas9-بوساطة الجينات في تقسيم الخلايا
Summary
يصف لنا استراتيجية إنتاج ناقلات تفتقر إلى إينتيجراسي لينتيفيرال (إيدلفس) كوسائل إيصال كريسبر/Cas9 للخلايا. مع قدرة على التوسط من أجل تحرير سريعة وقوية من الجينات في الخلايا، إيدلفس أكثر أماناً ومنصة متجه نفس القدر من الفعالية لإيصال الجينات بالمقارنة مع نواقل إينتيجراسي المختصة.
Abstract
لينتيفيرال الناقلة اختيار مثالي لتقديم عناصر التحرير الجينات للخلايا بسبب قدرتها على ستابلي ترانسدوسينج مجموعة واسعة نطاق من الخلايا والتوسط لمستويات عالية من التعبير الجيني. ولكن قدرتها على الاندماج في جينوم الخلية المضيفة يعزز خطر موتجنيستي insertional وهكذا يثير شواغل السلامة ويحد من استخدامها في ظروف سريرية. علاوة على ذلك، قدم التعبير المستمر عن مكونات الجينات–تحرير هذه الزيادات متجهات التكامل المختصة لينتيفيرال (إيكلفس) احتمال استهداف الجين منحل. وكبديل لذلك، وضعت جيلا جديداً من ناقلات تفتقر إلى إينتيجراسي لينتيفيرال (إيدلفس) الذي يتناول العديد من هذه الشواغل. هنا البروتوكول الإنتاج من منصة إيدلف جديدة ومحسنة لتحرير كريسبر بوساطة الجينات وقائمة بالخطوات التي تشارك في التنقية ويرد وصف لتركيز هذه العوامل الناقلة للمرض وتوصيل وتحرير الجينات كفاءة استخدام HEK-293T وقد أثبتت الخلايا. هذا البروتوكول هو تحجيم بسهولة، ويمكن استخدامها لتوليد إيدلفس عيار عالية قادرة على ترانسدوسينج الخلايا في المختبر و في فيفو. وعلاوة على ذلك، هذا البروتوكول يمكن تكييفها بسهولة لإنتاج إيكلفس.
Introduction
تحرير الجينات الدقيقة تشكل حجر الزاوية للتطورات الطبية الحيوية الرئيسية التي تنطوي على وضع استراتيجيات جديدة للتصدي للأمراض الوراثية. في طليعة تكنولوجيا الجينات–تحرير بالطريقة التي تعتمد على استخدام جلوستيريد rاجولارلي–أنانتيرسباسيد sهورت فاليندروميك صابيتس (كريسبر)/نظام Cas9 التي تم تحديدها في البداية كمكون للبكتيريا مناعة ضد الغزو المواد الجينية الفيروسية (إعادة النظر في المراجع1،2). ميزة كبيرة للنظام كريسبر/Cas9 على غيرها من أدوات تحرير الجينات، مثل نوكلياسيس إصبع الزنك (زفنس) والنسخ المستجيب المنشط–مثل نوكلياسيس (تالينس) (واستعرضت في مرجع3)، هي البساطة النسبية لتصميم بلازميد و بناء مكونات كريسبر – ميزة التي لديه بدعم التوسع في تحرير الجينات من عدد قليل من المختبرات المتخصصة إلى مجتمع بحث أوسع كثيرا. بالإضافة إلى ذلك، غذت بساطة البرمجة كريسبر/Cas9 وقدرته على الاعتراف بهدف متعدد زيادة شعبيتها كتكنولوجيا فعالة من حيث التكلفة وسهلة الاستخدام. بين الأساليب المختلفة المتاحة للباحثين لتقديم هذه المكونات تحرير الجينات للخلايا، يبقى النواقل الفيروسية بكثير النظام الأكثر شعبية وأكثر كفاءة.
ناقلات لينتيفيرال (LVs) ظهرت كوسيلة الاختيار لتقديم عناصر كريسبر/Cas9 النظام في فيفو لتطبيقات متنوعة4،5،،من67. جعل العديد من الميزات الرئيسية LVs خياراً شعبيا لهذه العملية بما في ذلك قدرتها على إصابة الفاصل وعدم تقسيم الخلايا، الاستمناع منخفضة، والسمية الخلوية الحد الأدنى (استعرض في المرجع8). نتيجة لذلك استخدمت العلاج الجيني بوساطة LV في علاجات للأمراض المعدية، مثل فيروس نقص المناعة البشرية-1 و HBV هامبورغ-1، وكذلك في تصحيح العيوب الكامنة وراء الأمراض الوراثية البشرية، مثل التليف الكيسي والأجسام القريبة من الأرض والأوعية الدموية البقعي 4 , 5 , 7 , 9 , 10 , 11-وعلاوة على ذلك، LVs قد عدلت فعلياً تنفيذ تحرير متعدد الجينات في المكاني الجينوم متميزة باستخدام نظام ناقل واحد12.
ومع ذلك، الخاصية المتأصلة من LVs الاندماج في جينوم مضيف يمكن مطفرة وغالباً ما يعوق فائدتها كوسائل إيصال التحوير، لا سيما في ظروف سريرية. وعلاوة على ذلك، منذ LVs ستابلي المتكاملة أعرب عن المتسلسلات في مستويات عالية على نحو مستدام، وهذا النظام غير ملائمة لإيصال الجينات تحرير مكونات مثل كريسبر/Cas9؛ أوفيريكسبريسيون Cas9–دليل الحمض النووي الريبي (جرنا)، والبروتينات مشابهة مثل زفنس، ترتبط بمستويات مرتفعة من الآثار قبالة المستهدفة، والتي تشمل الطفرات غير مرغوب فيها13،14،،من1516 , 17 ويمكن أن يحتمل أن تعزز سيتوتوكسيسيتي18. ولذلك، لتحقيق دقة تحرير الجينات مع الحد الأدنى من الآثار خارج الهدف، يتحتم لتصميم النظم التي تسمح لتعبير الجينات تحرير مكونات عابرة.
وفي السنوات الأخيرة، وضعت مجموعة متنوعة من منصات التسليم لعابر إكسبريس كريسبر/Cas9 في الخلايا16،19،،من2021 (استعرض في المرجع22). وتشمل هذه الأساليب التي تعتمد على مباشرة إدخال Cas9 المنقي جنبا إلى جنب مع الكشف الدليل المناسب في الخلايا، والتي تبين أن يكون أكثر فعالية في تحرير الجينات المستهدفة بالمقارنة بوساطة بلازميد تعداء16. وقد أثبتت الدراسات أن ريبونوكليوبروتين (رنب) دليل مجمعات تتكون من الحمض النووي الريبي/Cas9 الجزيئات سرعة تسليم بعد وساطة الانقسام الحمض النووي في أهدافها، مما يدل على أن التعبير القصير الأجل لهذه المكونات تكفي لتحقيق قوة الجينات تحرير16. ومن المتصور عدم إدماج أنظمة النواقل الفيروسية مثل النواقل الفيروسية المرتبطة بالغدة (أعفس) يمكن أن توفر بديلاً مجديا لتسليم الآلات تحرير الجينات إلى الخلايا. ولسوء الحظ، كابسيدس إف تمتلك قدرة التعبئة أقل بكثير مما LVs (< 5 كيلو بايت)، مما يعوق بشدة قدرتها على حزمة أدوات كريسبر متعدد العناصر داخل ناقل واحد (استعرض في المرجع8). تجدر الإشارة إلى أن إضافة المركبات التي تمنع هيستون ديسيتيلاسيس (مثلاً، بوتيراتي الصوديوم23) أو تعيق دورة الخلية (مثلاً، الكافيين24) أظهرت زيادة التتر لينتيفيرال. وعلى الرغم من التقدم الذي أحرز مؤخرا، ما زال يعرقل النظم تعبير عابر التي وضعت حتى الآن من أوجه قصور عديدة، مثل انخفاض كفاءة الإنتاج، مما يؤدي إلى انخفاض الفيروسية التتر، وكفاءة توصيل منخفض من الفيروسات التي تم إنشاؤها من خلال وهذا النهج25.
ناقلات تفتقر إلى إينتيجراسي لينتيفيرال (إيدلفس) تمثل تقدما كبيرا في تطوير مركبات إيصال الجينات، كما أنها تجمع بين القدرة على التعبئة والتغليف من LVs مع فائدة إضافية للصيانة مثل إف ابيسومال في الخلايا. تساعد هذه الميزات إيدلفس إلى حد كبير الالتفاف حول القضايا الرئيسية المرتبطة بإدماج ناقلات، overexpression المقارنة المستمرة يحتمل أن تكون عناصر سمية جينية والتكامل بوساطة المحدثة للطفرات. قد تجلى سابقا أنه يمكن تعديل إيدلفس بنجاح لتعزيز التعبير الجيني ابيسومال26،27. فيما يتعلق بالتسليم بوساطة إيدلف كريسبر/Cas9، التتر الإنتاج المنخفض والتعبير أدنى الجينومات تنقلها ابيسومي بالنسبة لأنظمة لينتيفيرال إينتيجراسي-يتقن يحد من فائدتها كأدوات حسن النية لتقديم التحرير الجينوم بنيات المحورة وراثيا. نحن مؤخرا أظهرت أن التعبير التحوير والتتر الفيروسية المرتبطة بإنتاج إيدلف تتعزز كثيرا بإدراج مواقع لعامل النسخ حزمة الخدمة Sp1 ضمن كاسيت التعبير الفيروسية28الربط. قوة دعم إيدلفس تم التعديل الجيني بوساطة كريسبر التحرير سواء في المختبر (في الخلايا HEK-293T) و في فيفو (في الدماغ بعد الانقسامية الخلايا العصبية)، في حين حمل الطفرات خارج الهدف الحد الأدنى مقارنة بالمقابلة إيكلف بوساطة نظم28. عموما، قمنا بتطوير رواية، أدوات كريسبر المدمجة، والكل في واحد على منصة إيدلف وأوجز مختلف مزايا استخدام وسيلة إيصال لتحرير الجينات المحسنة.
هنا، بروتوكول إنتاج نظام إيدلف-كريسبر/Cas9 وصف، بما في ذلك الخطوات المختلفة التي تنطوي عليها في الجمعية، وتنقية، والتركيز، والمعايرة إيدلفس، فضلا عن استراتيجيات للتحقق من فعالية الجينات تحرير هذه العوامل الناقلة للمرض. هذا البروتوكول هو قابلة بسهولة لتلبية احتياجات مختلفة من المحققين وهو مصمم بنجاح إنشاء ناقلات LV مع التتر في النطاق من 1 × 1010 وحدات (تو) ترانسدوسينج/مل. يمكن أن تستخدم ناقلات التي تم إنشاؤها من خلال هذا البروتوكول لكفاءة تصيب العديد من أنواع الخلايا المختلفة، بما في ذلك صعوبة ترانسدوسي الخلايا الجذعية الجنينية، الخلايا المكونة للدم (خلايا تي والضامة)، ومثقف و في فيفو– حقن الخلايا العصبية. وعلاوة على ذلك، أن البروتوكول أيضا مناسبة تماما لإنتاج ناقلات لينتيفيرال إينتيجراسي المختصة بكميات مماثلة.
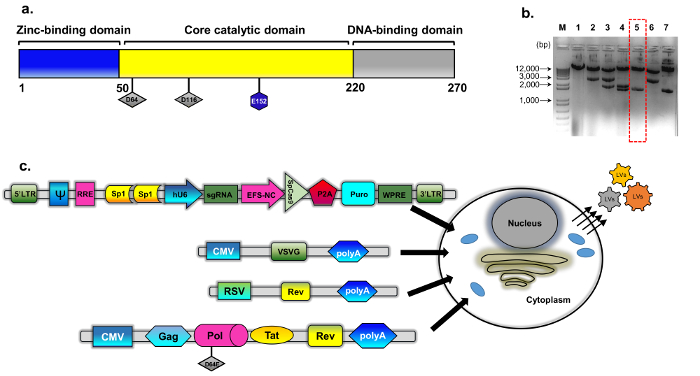
رقم 1: التعبئة والتغليف إيدلف. (أ) التخطيطي من البروتين integrase البرية نوع (ب) بلازميد معدلة مستمد من psPAX2 (راجع أساليب البناء بلازميد للحصول على التفاصيل). الممثل [اغروس] هلام صورة استنساخ فرزهم لاستنساخ integrase المتحولة. تم تحليل عينات الحمض النووي التي أعدت باستخدام مجموعة مصغرة عزل الحمض النووي بلازميد قياسية بالهضم مع اكورف وسفي. كذلك تحققت التسلسل المباشر (سانجر) لاستبدال D64E في INTاستنساخ يهضم بشكل صحيح (رقم 5، مربع أحمر متقطع). كان اسمه كاسيت التغليف تفتقر إلى إينتيجراسي pBK43. (ج) يعمل التخطيطي بروتوكول تعداء عابرة لتوليد نواقل إيدلف-كريسبر/Cas9، تظهر الخلايا 293T transfected مع منظمة-ز، والتغليف، والتحوير أشرطة الكاسيت (بلازميد الكل في واحد حزمة الخدمة Sp1-كريسبر/Cas9). الجسيمات الفيروسية أن برعم خارجاً من غشاء الخلية تحتوي على كامل طول الجيش الملكي النيبالي لمكافحة ناقلات (معبراً عنها من الكاسيت التحوير). استخدمت الجيل الثاني من نظام إيدلف والتغليف، والتي تشمل البروتينات التنظيمية تأت والقس Rev التعبير هو تكميل من كاسيت منفصل (RSV-القس-بلازميد). أبريف: لتر-منذ فترة طويلة–المحطة الطرفية فيروس التهاب الفم الحويصلي تكرار، منظمة-ز، ز-البروتين، المروج الفيروس المضخم للخلايا-بكمف؛ ساركومه راوس المروج فيروس (RSV)؛ رر-(رؤ استجابة عنصر). العناصر التنظيمية الأخرى في كاسيت التعبير تشمل مواقع Sp1-الربط، رد القس العنصر (رر)، وودتشوك التهاب الكبد الوبائي فيروس بوسترانسكريبشونال التنظيمية عنصر (وبري)، مروج 1α عامل استطالة أساسية (EFS-NC)، ناقل التعبئة والتغليف عنصر ψ (psi) والبشرية الفيروس المضخم للخلايا (hCMV) مروج ومروج U6 البشرية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Protocol
Representative Results
Discussion
إيدلفس وقد بدأت في الظهور كالوسيلة للاختيار في فيفو الجينات-التحرير، ولا سيما في سياق الأمراض الوراثية، ويرجع ذلك إلى حد كبير إلى انخفاض خطر الطفرات المرتبطة بناقلات هذه المقارنة لإدماج تسليم منصات22 , 28-في المخطوطة الحالية، سعينا إلى تفاصيل البروتوكو…
Disclosures
The authors have nothing to disclose.
Acknowledgements
نود أن نشكر إدارة علم الأعصاب، كلية الطب في جامعة ديوك، ومكتب عميد الكلية “العلوم الأساسية”، وجامعة ديوك. كما نشكر أعضاء الأساسية النواقل الفيروسية ديوك للتعليقات على المخطوطة. وكان بلازميد بلينتي CRISPRv2 هدية من تشانغ فنغ (معهد واسع). نظام الوقف والتغليف بما في ذلك psPAX2 والبلازميدات، منظمة-ز، pMD2.G، والقس برسف كان هدية نوع من ترونو ديدييه (لوزان، سويسرا). وقدمت الدعم المالي لهذا العمل “جامعة من ولاية كارولينا الجنوبية مدرسة الطب”، منح RDF18080-E202 (B.K).
Materials
| Equipment | |||
| Optima XPN-80 Ultracentrifuge | Beckman Coulter | A99839 | |
| Allegra 25R tabletop centrifuge | Beckman Coulter | 369434 | |
| xMark Microplate Absorbance plate reader | Bio-Rad | 1681150 | |
| BD FACS | Becton Dickinson | 338960 | |
| Inverted fluorescence microscope | Leica | DM IRB2 | |
| 0.45-μm filter unit, 500mL | Corning | 430773 | |
| Conical bottom ultracentrifugation tubes | Seton Scientific | 5067 | |
| Conical tube adapters | Seton Scientific | PN 4230 | |
| SW32Ti swinging-bucket rotor | Beckman Coulter | 369650 | |
| 15 mL conical centrifuge tubes | Corning | 430791 | |
| 50mL conical centrifuge tubes | Corning | 430291 | |
| High-binding 96-well plates | Corning | 3366 | |
| 150 mm TC-Treated Cell Culture dishes with 20 mm Grid | Corning | 353025 | |
| 100mm TC-Treated Culture Dish | Corning | 430167 | |
| 0.22 μM filter unit, 1L | Corning | 430513 | |
| QIAprep Spin Miniprep Kit (50) | Qiagen | 27104 | |
| Tissue culture pipettes, 5 mL | Corning | 4487 | |
| Tissue culture pipettes, 10 mL | Corning | 4488 | |
| Tissue culture pipettes, 25 mL | Corning | 4489 | |
| Hemacytometer with cover slips | Cole-Parmer | UX-79001-00 | |
| Name | Company | Catalog Number | Comments |
| Cell culture reagents | |||
| Human embryonic kidney 293T (HEK 293T) cells | ATCC | CRL-3216 | |
| 293FT cells | Thermo Fisher Scientific | R70007 | |
| DMEM, high glucose media | Gibco | 11965 | |
| Cosmic Calf Serum | Hyclone | SH30087.04 | |
| Antibiotic-antimycotic solution, 100X | Sigma Aldrich | A5955-100ML | |
| Sodium pyruvate | Sigma Aldrich | S8636-100ML | |
| Non-Essential Amino Acid (NEAA) | Hyclone | SH30087.04 | |
| RPMI 1640 media | Thermo Fisher Scientific | 11875-085 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Trypsin-EDTA 0.05% | Gibco | 25300054 | |
| BES (N, N-bis (2-hydroxyethyl)-2-amino-ethanesulfonic acid) | Sigma Aldrich | B9879 – BES | |
| Gelatin | Sigma Aldrich | G1800-100G | |
| Name | Company | Catalog Number | Comments |
| p24 ELISA reagents | |||
| Monoclonal anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | 3537 | |
| HIV-1 standards | NIH AIDS Research and Reference Reagent Program | SP968F | |
| Polyclonal rabbit anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | SP451T | |
| Goat anti-rabbit horseradish peroxidase IgG | Sigma Aldrich | 12-348 | Working concentration 1:1500 |
| Normal mouse serum, Sterile, 500mL | Equitech-Bio | SM30-0500 | |
| Goat serum, Sterile, 10mL | Sigma | G9023 | Working concentration 1:1000 |
| TMB peroxidase substrate | KPL | 5120-0076 | Working concentration 1:10,000 |
| Name | Company | Catalog Number | Comments |
| Plasmids | |||
| psPAX2 | Addgene | 12260 | |
| pMD2.G | Addgene | 12259 | |
| pRSV-Rev | Addgene | 12253 | |
| lentiCRISPR v2 | Addgene | 52961 | |
| Name | Company | Catalog Number | Comments |
| Restriction enzymes | |||
| BsrGI | New England Biolabs | R0575S | |
| BsmBI | New England Biolabs | R0580S | |
| EcoRV | New England Biolabs | R0195S | |
| KpnI | New England Biolabs | R0142S | |
| PacI | New England Biolabs | R0547S | |
| SphI | New England Biolabs | R0182S |
References
- Horvath, P., Barrangou, R. CRISPR/Cas, the immune system of bacteria and archaea. Science. 327 (5962), 167-170 (2010).
- Marraffini, L. A., Sontheimer, E. J. CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea. Nat Rev Genet. 11 (3), 181-190 (2010).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- Bellec, J., et al. CFTR inactivation by lentiviral vector-mediated RNA interference and CRISPR-Cas9 genome editing in human airway epithelial cells. Curr Gene Ther. 15 (5), 447-459 (2015).
- Kennedy, E. M., et al. Suppression of hepatitis B virus DNA accumulation in chronically infected cells using a bacterial CRISPR/Cas RNA-guided DNA endonuclease. Virology. 476, 196-205 (2015).
- Roehm, P. C., et al. Inhibition of HSV-1 Replication by Gene Editing Strategy. Sci Rep. 6, 23146 (2016).
- Wang, W., et al. CCR5 gene disruption via lentiviral vectors expressing Cas9 and single guided RNA renders cells resistant to HIV-1 infection. PLoS One. 9 (12), e115987 (2014).
- Kantor, B., Bailey, R. M., Wimberly, K., Kalburgi, S. N., Gray, S. J. Methods for gene transfer to the central nervous system. Adv Genet. 87, 125-197 (2014).
- Lebbink, R. J., et al. A combinational CRISPR/Cas9 gene-editing approach can halt HIV replication and prevent viral escape. Sci Rep. 7, 41968 (2017).
- Xu, L., et al. CRISPR/Cas9-Mediated CCR5 Ablation in Human Hematopoietic Stem/Progenitor Cells Confers HIV-1 Resistance In Vivo. Mol Ther. , (2017).
- Yiu, G., Tieu, E., Nguyen, A. T., Wong, B., Smit-McBride, Z. Genomic Disruption of VEGF-A Expression in Human Retinal Pigment Epithelial Cells Using CRISPR-Cas9 Endonuclease. Invest Ophthalmol Vis Sci. 57 (13), 5490-5497 (2016).
- Kabadi, A. M., Ousterout, D. G., Hilton, I. B., Gersbach, C. A. Multiplex CRISPR/Cas9-based genome engineering from a single lentiviral vector. Nucleic Acids Res. 42 (19), e147 (2014).
- Fu, Y., Sander, J. D., Reyon, D., Cascio, V. M., Joung, J. K. Improving CRISPR-Cas nuclease specificity using truncated guide RNAs. Nat Biotechnol. 32 (3), 279-284 (2014).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 31 (9), 827-832 (2013).
- Kim, S., Kim, D., Cho, S. W., Kim, J., Kim, J. S. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Res. 24 (6), 1012-1019 (2014).
- Pattanayak, V., et al. High-throughput profiling of off-target DNA cleavage reveals RNA-programmed Cas9 nuclease specificity. Nat Biotechnol. 31 (9), 839-843 (2013).
- Shalem, O., et al. Genome-scale CRISPR-Cas9 knockout screening in human cells. Science. 343 (6166), 84-87 (2014).
- Schaefer, K. A., et al. Unexpected mutations after CRISPR-Cas9 editing in vivo. Nat Methods. 14 (6), 547-548 (2017).
- Choi, J. G., et al. Lentivirus pre-packed with Cas9 protein for safer gene editing. Gene Ther. 23 (7), 627-633 (2016).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
- Truong, D. J., et al. Development of an intein-mediated split-Cas9 system for gene therapy. Nucleic Acids Res. 43 (13), 6450-6458 (2015).
- Nelson, C. E., Gersbach, C. A. Engineering Delivery Vehicles for Genome Editing. Annu Rev Chem Biomol Eng. 7, 637-662 (2016).
- Jaalouk, D. E., Crosato, M., Brodt, P., Galipeau, J. Inhibition of histone deacetylation in 293GPG packaging cell line improves the production of self-inactivating MLV-derived retroviral vectors. Virol J. 3, 27 (2006).
- Ellis, B. L., Potts, P. R., Porteus, M. H. Creating higher titer lentivirus with caffeine. Hum Gene Ther. 22 (1), 93-100 (2011).
- Hoban, M. D., et al. Delivery of Genome Editing Reagents to Hematopoietic Stem/Progenitor Cells. Curr Protoc Stem Cell Biol. 36, 1-10 (2016).
- Bayer, M., et al. A large U3 deletion causes increased in vivo expression from a nonintegrating lentiviral vector. Mol Ther. 16 (12), 1968-1976 (2008).
- Kantor, B., Ma, H., Webster-Cyriaque, J., Monahan, P. E., Kafri, T. Epigenetic activation of unintegrated HIV-1 genomes by gut-associated short chain fatty acids and its implications for HIV infection. Proc Natl Acad Sci U S A. 106 (44), 18786-18791 (2009).
- Ortinski, P. I., O’Donovan, B., Dong, X., Kantor, B. Integrase-Deficient Lentiviral Vector as an All-in-One Platform for Highly Efficient CRISPR/Cas9-Mediated Gene Editing. Mol Ther Methods Clin Dev. 5, 153-164 (2017).
- Kantor, B., et al. Notable reduction in illegitimate integration mediated by a PPT-deleted, nonintegrating lentiviral vector. Mol Ther. 19 (3), 547-556 (2011).
- Berkhout, B., Verhoef, K., van Wamel, J. L., Back, N. K. Genetic instability of live, attenuated human immunodeficiency virus type 1 vaccine strains. J Virol. 73 (2), 1138-1145 (1999).
- Gomez-Gonzalo, M., et al. The hepatitis B virus X protein induces HIV-1 replication and transcription in synergy with T-cell activation signals: functional roles of NF-kappaB/NF-AT and SP1-binding sites in the HIV-1 long terminal repeat promoter. J Biol Chem. 276 (38), 35435-35443 (2001).
- Kim, Y. S., et al. Artificial zinc finger fusions targeting Sp1-binding sites and the trans-activator-responsive element potently repress transcription and replication of HIV-1. J Biol Chem. 280 (22), 21545-21552 (2005).
- Ortinski, P. I., Lu, C., Takagaki, K., Fu, Z., Vicini, S. Expression of distinct alpha subunits of GABAA receptor regulates inhibitory synaptic strength. J Neurophysiol. 92 (3), 1718-1727 (2004).
- Van Lint, C., et al. Transcription factor binding sites downstream of the human immunodeficiency virus type 1 transcription start site are important for virus infectivity. J Virol. 71 (8), 6113-6127 (1997).
- Van Lint, C., Ghysdael, J., Paras, P., Burny, A., Verdin, E. A transcriptional regulatory element is associated with a nuclease-hypersensitive site in the pol gene of human immunodeficiency virus type 1. J Virol. 68 (4), 2632-2648 (1994).
- Xu, W., Russ, J. L., Eiden, M. V. Evaluation of residual promoter activity in gamma-retroviral self-inactivating (SIN) vectors. Mol Ther. 20 (1), 84-90 (2012).
- . Testing for Replication Competent Retrovirus (RCR)/Lentivirus (RCL) in Retroviral and Lentiviral Vector Based Gene Therapy Products – Revisiting Current FDA Recommendations Available from: https://sites.duke.edu/dvvc/files/2016/05/FDA-recommendation-for-RCR-testing.pdf (2017)
- . Biosafety in Microbiological and Biomedical Laboratories Available from: https://www.cdc.gov/biosafety/publications/bmbl5/bmbl.pdf (2017)
- Dull, T., et al. A third-generation lentivirus vector with a conditional packaging system. J Virol. 72 (11), 8463-8471 (1998).
- Liu, X. S., et al. Editing DNA Methylation in the Mammalian Genome. Cell. 167 (1), 233-247 (2016).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Zetsche, B., et al. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell. 163 (3), 759-771 (2015).

