Integrase-eksik Lentiviral vektörler üretimi için CRISPR/Cas9-aracılı Gene hücre bölünmesi içinde nakavt için bir iletişim kuralı
Summary
İntegrase-eksik lentiviral vektörler (IDLVs) üretim stratejisinin CRISPR/Cas9 hücrelere teslim etmek için Araçlar açıklanmaktadır. Hücrelerde hızlı ve sağlam gen düzenleme arabuluculuk için bir yetenek ile IDLVs bir daha güvenli sunmak ve eşit derecede etkili vektör platformu’gen dır integrase yetkili vektörlerinin karşılaştırıldığında.
Abstract
Lentiviral vektörel çizimler stabil geniş bir hücre aralığı transducing ve gen ekspresyonu yüksek düzeyde arabuluculuk için kendi kapasitesi nedeniyle hücrelere gen düzenleme bileşenleri teslim etmek için ideal bir seçim vardır. Ancak, konak hücre genomu entegre yeteneğini insertional mutagenisitesinin riskini artırır ve böylece güvenlik endişeleri yükseltir ve bunların kullanım klinik ayarları sınırlar. Ayrıca, gen düzenleme bileşenleri kalıcı ifade bu entegrasyon yetkili lentiviral vektörler (ICLVs) artışlar tarafından promiscuous gen hedefleme olasılığı teslim. Alternatif olarak, integrase-eksik lentiviral vektörler (IDLVs) yeni nesil birçok bu kaygıları gideren geliştirilmiştir. Burada CRISPR-aracılı gen düzenleme ve liste için yeni ve geliştirilmiş IDLV platform üretim protokolünden adımları arıtma yer ve konsantrasyon gibi vektörlerin anlatılan ve iletim ve gen Düzenleme verimliliği HEK-293T kullanarak hücreleri gösterdi. Bu iletişim kuralı kolayca ölçeklenebilir ve hücre içinde vitro ve içinde vivotransducing yeteneğine sahip yüksek titresi IDLVs oluşturmak için kullanılabilir. Ayrıca, bu iletişim kuralını ICLVs üretimi için kolayca adapte edilebilir.
Introduction
Kesin gen düzenleme genetik hastalıklar mücadele için yeni strateji geliştirme dahil önemli Biyomedikal gelişmeler dönüm noktası oluşturur. At gen düzenleme teknolojileri ön planda olduğunu lustered c regularly –ınterspaced short palindromic repeats (CRISPR) kullanımı hakkında güvenerek yöntemi / başlangıçta tespit edildi Cas9 sistemi Bakteriyel bağışıklık (başvurular1,2‘ gözden) viral genetik materyal işgali karşı bir bileşeni olarak. Çinko-parmak enzimler (ZFNs) ve (başvuru3gözden geçirme), transkripsiyon harekete geçirmek gibi efektör enzimler (TALENs) gibi diğer gen düzenleme araçları üzerinde büyük bir avantaj CRISPR/Cas9 sisteminin göreli basitliğidir plazmid tasarım ve İnşaat CRISPR bileşenlerinin — gen düzenleme birkaç özel laboratuvarları üzerinden daha geniş bir araştırma topluluk sadece bir genişleme powered bir özellik. Ayrıca, CRISPR/Cas9 programlama sadeliği ve çoğaltılmış hedef tanıma kapasitesini daha da popülaritesini düşük maliyetli ve kolay kullanımlı teknoloji olarak yol açtı. Araştırmacılar bu tür gen düzenleme bileşenleri hücrelere sunmak için kullanabileceği çeşitli yöntemler arasında viral vektörler farkla en popüler ve etkili sistem kalır.
Lentiviral vektörel çizimler (LVs) CRISPR/Cas9 sistem vivo içinde çeşitli uygulamalar4,5,6,7için bileşenleri sunmak için Seçim aracı olarak ortaya çıkmıştır. Birkaç temel özellikleri LVs hücrelerin bölünmesi ve sigara bölen, düşük immünojenisite hem en az hücresel toksisite (başvuru8‘ gözden) bulaştırmak onların da dahil olmak üzere bu işlem için popüler bir seçimdir. Sonuç olarak, LV-aracılı gen tedavisi tedaviler HIV-1, HBV ve HSV-1, gibi bulaşıcı hastalıkların yanı sıra insan kalıtsal hastalıklar, Kistik fibrozis ve neo-vasküler makula dejenerasyonu gibi temel hataları düzeltme istihdam edilmiştir 4 , 5 , 7 , 9 , 10 , 11. Ayrıca, LVs etkili bir şekilde değiştirilmiş bir tek vektör sistemi12kullanarak farklı genomik loci multiplex gen düzenleme işlemleri yapmak için.
Ancak, ana bilgisayar genom entegre LVs doğal özellik ve mutajenik olabilir sık sık onların programı transgene teslim araçlarda, özellikle klinik ayarları olarak yetersizlik. LVs stabil entegre sürdürülebilir yüksek düzeylerde onların transgenes hızlı, Ayrıca, bu sistem kötü CRISPR/Cas9 gibi gen düzenleme bileşenlerinin teslimatlar için uygun olduğu için; overexpression Cas9-guide RNA (gRNA) ve ZFNs gibi benzer proteinler yüksek seviyede istenmeyen mutasyonlar13,14,15,16 dahil hedef kapalı etkileri ile ilişkili , 17 ve potansiyel olarak sitotoksisite18geliştirebilirsiniz. Bu nedenle, kesin ulaşmak için gen düzenleme ile en az hedef sonuç, bu geçici Ifade gen bileşenlerinin düzenlenmesine izin tasarım sistemleri için zorunludur.
Son yıllarda, farklı platformlarda teslim geliştirilmiştir geçici hücreleri16,19,20,21 (başvuru22gözden) CRISPR/Cas9 ifade etmek için. Bunlar doğrudan uygun Kılavuzu RNA’lar ile birlikte saf Cas9 hücrelere, hangi hedeflenen gen düzenleme plazmid aracılıklı transfection16ile karşılaştırıldığında, daha etkili olduğu gösterilmiştir tanıtımı üzerinde itimat yöntemleri içerir. Çalışmalar bu Ribonükleoprotein (RNP) göstermiştir oluşan komplekslerin rehberlik RNA/Cas9 parçacıklar hızla devre DNA bölünme bu bileşenlerin kısa vadeli ifade ulaşmak için yeterli olduğunu düşündüren hedeflerine, arabuluculuk sonra sağlam gen16düzenleme. Makul, entegre adeno ilişkili viral vektörel çizimler (AAVs) gibi viral vektör platformlar hücrelere gen düzenleme makine sunmak için bir alternatif sağlayabilir. Ne yazık ki, önemli ölçüde daha düşük ambalaj yeteneği LVs daha AAV capsids sahip (< 5kb), hangi ciddi çok bileşenli CRISPR toolkit (başvuru8‘ gözden) tek bir vektör içinde paketlemek için yeteneklerini engellemektedir. Histon uyku (örneğin, sodyum bütrat23) inhibe veya hücre döngüsü (örneğin, kafein24) engel bileşikler ilavesi lentiviral titreleri artırmak için gösterilmiş olduğunu fazlalaştı. Son rağmen defa geliştirilen geçici ifade sistemleri hala azaltılmış viral titreleri ve düşük iletim verimliliği ile oluşturulan virüslerin yol birkaç eksiklikler, daha düşük üretim verimliliği gibi tarafından engellemiştir Böyle25yaklaşıyor.
AAV benzeri episomal bakım hücrelerdeki yararı ile LVs ambalaj kapasitesini AEI Integrase-eksik lentiviral vektörler (IDLVs) gen teslim araçların geliştirilmesinde önemli bir ilerleme temsil eder. Bu özellikler IDLVs büyük ölçüde vektörel çizimler, vis-à-vis sürekli overexpression olası genotoksik öğeleri ve entegrasyon-aracılı mutagenisitesinin entegre ile ilişkili önemli sorunları aşmak yardımcı olur. Daha önce IDLVs başarıyla episomal gen ifade26,27geliştirmek için değiştirilebilir gösterilmiştir. IDLV-aracılı CRISPR/Cas9 teslim açısından düşük üretim titreleri ve episome kaynaklı genleri integrase usta lentiviral sistemleri göre alt ifade sınırlar genom düzenleme teslim etmek için bona fide araçları olarak onların yardımcı programı transgenik yapıları. Biz son zamanlarda transgene ifade ve viral titreleri IDLV üretimle ilişkili önemli ölçüde siteleri viral ifade kaset28içinde transkripsiyon faktörü Sp1 için bağlama dahil tarafından geliştirilmiş olduğunu gösterdi. Değiştirilmiş IDLVs sağlam CRISPR-aracılı gen (HEK-293T hücrelerdeki) vitro ve in vivo (içinde sonrası Mitotik beyin sinir hücreleri), ICLV-aracılı ilgili karşılaştırıldığında çok az hedef kapalı mutasyonlar inducing düzenleme desteklenen sistemleri28. Genel olarak, bir roman geliştirdiğimiz, kompakt, tüm-içinde-bir CRISPR toolkit bir IDLV platformu üzerinde taşınan ve gelişmiş gen düzenleme gibi teslim araç kullanmanın çeşitli yararları sıraladı.
Burada, IDLV-CRISPR/Cas9 sisteminin üretim protokolü, derleme, arıtma, konsantrasyon ve titrasyon IDLVs, hem de stratejileri bu vektörel çizimler gen düzenleme etkinliğini doğrulamak için çeşitli adımlar da dahil olmak üzere tanımlanır. Bu iletişim kuralı farklı müfettişler ihtiyaçlarını karşılamak için kolayca ölçeklenebilir ve başarıyla birimleri (TU) transducing 1 x 1010 aralıkta titreleri ile LV vektörel çizimler oluşturmak için tasarlanmıştır / mL. Bu protokolü ile oluşturulan vektörel çizimler verimli bir şekilde birkaç farklı hücre tipleri, zor transduce embriyonik kök hücreler, hematopoetik hücreler (T-hücreleri ve makrofajlar) dahil olmak üzere ve kültürlü ve içinde vivobulaştırmak için kullanılması gereken- enjekte nöronlar. Ayrıca, protokol eşit integrase yetkili lentiviral vektörler benzer miktarlarda üretimi için uygundur.
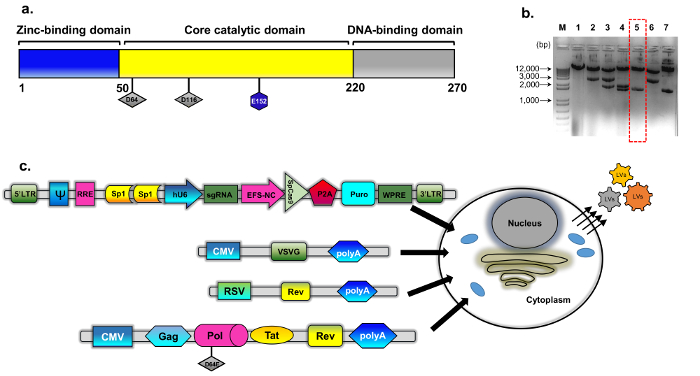
Şekil 1: IDLV ambalaj. (a) şeması değiştirilmiş plazmid psPAX2 elde edilen vahşi türü integrase protein (b) (bkz: yöntemleri, plazmid inşaat detayları için). Mutasyona uğramış integrase klonlar için ekranlı klonlar temsilcisi özel jel görüntüsü. Bir standart plazmid DNA izolasyon Mini kit kullanılarak hazırlanan DNA örnekleri sindirim EcoRV ve SphI tarafından analiz edildi. Doğru sindirmek klon (sayı 5, kesik çizgili kırmızı kutu) daha fazla doğrudan (Sanger) sıralama INTD64E değişimi için tarafından doğrulandı. İntegrase-eksik ambalaj kaset pBK43 seçildi. (c) 293T hücre transfected VSV-G, ambalaj ve transgene kaset (Sp1-CRISPR/Cas9 tüm-içinde-bir plazmid) ile gösterilen IDLV-CRISPR/Cas9 Vektörler, üretmek için şematik geçici transfection Protokolü’nün istihdam. Hücre zarının bud viral parçacıkların (transgene kaset ifade edilir) vektör tam uzunlukta RNA içerir. Tat düzenleyici proteinler içeren IDLV paket yönetim sistemi ikinci nesil kullanıldı ve Rev Rev ifade daha da bir ayrı kaset (RSV-REV-plazmid) desteklenmiştir. ABBREV: soldan sağa-uzun-terminal tekrar ediyorum, VSV-G, vesicular Stomatit virüs G-protein, pCMV-Sitomegalovirüs organizatörü; Rous sarkomu (RSV) virüs organizatörü; RRE-(Rev yanıt öğesi). Diğer düzenleyici elemanlarının ifade kasetin Sp1 bağlayıcı siteleri, Rev Response öğesi (RRE), dahil Dağ sıçanı hepatit virüsü Posttranscriptional düzenleyici eleman (WPRE), bir çekirdek-uzama faktör 1α organizatörü (EFS-NC), vektör ambalaj öğe ψ (PSI), insan Sitomegalovirüs (hCMV) organizatörü ve insan U6 organizatörü. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Protocol
Representative Results
Discussion
IDLVs seçim aracı vivo içinde gen-düzenleme, özellikle içinde belgili tanımlık bağlam teslim platformlar22 tümleştirmek için karşılaştırıldığında bu vektörel çizimler ile ilişkili mutagenesis düşük riski büyük ölçüde nedeniyle, genetik hastalıkların ortaya çıkmaya başladı , 28. geçerli yazının son zamanlarda bizim laboratuvar28geliştirilmiştir geliştirilmiş tüm-içinde-bir IDLV-CRISPR/C…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Duke Üniversitesi Tıp Okulu ve Dekanlık temel bilim, Duke Üniversitesi Nörobiyoloji bölümü teşekkür etmek istiyorum. Biz Ayrıca el yazması üzerinde üye Duke Viral vektör çekirdek yorum için teşekkür ederiz. Plazmid pLenti CRISPRv2 Feng Zhang (Broad Enstitüsü) hediye etmişti. Plazmid psPAX2 de dahil olmak üzere LV-ambalaj, VSV-G, pMD2.G ve pRSV-Rev sistemiydi Didier Trono (EPFL, İsviçre) bir tür hediye. University Of South Carolina Tıp Fakültesi tarafından bu iş için mali destek sağlanan RDF18080-E202 (B.K) verin.
Materials
| Equipment | |||
| Optima XPN-80 Ultracentrifuge | Beckman Coulter | A99839 | |
| Allegra 25R tabletop centrifuge | Beckman Coulter | 369434 | |
| xMark Microplate Absorbance plate reader | Bio-Rad | 1681150 | |
| BD FACS | Becton Dickinson | 338960 | |
| Inverted fluorescence microscope | Leica | DM IRB2 | |
| 0.45-μm filter unit, 500mL | Corning | 430773 | |
| Conical bottom ultracentrifugation tubes | Seton Scientific | 5067 | |
| Conical tube adapters | Seton Scientific | PN 4230 | |
| SW32Ti swinging-bucket rotor | Beckman Coulter | 369650 | |
| 15 mL conical centrifuge tubes | Corning | 430791 | |
| 50mL conical centrifuge tubes | Corning | 430291 | |
| High-binding 96-well plates | Corning | 3366 | |
| 150 mm TC-Treated Cell Culture dishes with 20 mm Grid | Corning | 353025 | |
| 100mm TC-Treated Culture Dish | Corning | 430167 | |
| 0.22 μM filter unit, 1L | Corning | 430513 | |
| QIAprep Spin Miniprep Kit (50) | Qiagen | 27104 | |
| Tissue culture pipettes, 5 mL | Corning | 4487 | |
| Tissue culture pipettes, 10 mL | Corning | 4488 | |
| Tissue culture pipettes, 25 mL | Corning | 4489 | |
| Hemacytometer with cover slips | Cole-Parmer | UX-79001-00 | |
| Name | Company | Catalog Number | Comments |
| Cell culture reagents | |||
| Human embryonic kidney 293T (HEK 293T) cells | ATCC | CRL-3216 | |
| 293FT cells | Thermo Fisher Scientific | R70007 | |
| DMEM, high glucose media | Gibco | 11965 | |
| Cosmic Calf Serum | Hyclone | SH30087.04 | |
| Antibiotic-antimycotic solution, 100X | Sigma Aldrich | A5955-100ML | |
| Sodium pyruvate | Sigma Aldrich | S8636-100ML | |
| Non-Essential Amino Acid (NEAA) | Hyclone | SH30087.04 | |
| RPMI 1640 media | Thermo Fisher Scientific | 11875-085 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Trypsin-EDTA 0.05% | Gibco | 25300054 | |
| BES (N, N-bis (2-hydroxyethyl)-2-amino-ethanesulfonic acid) | Sigma Aldrich | B9879 – BES | |
| Gelatin | Sigma Aldrich | G1800-100G | |
| Name | Company | Catalog Number | Comments |
| p24 ELISA reagents | |||
| Monoclonal anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | 3537 | |
| HIV-1 standards | NIH AIDS Research and Reference Reagent Program | SP968F | |
| Polyclonal rabbit anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | SP451T | |
| Goat anti-rabbit horseradish peroxidase IgG | Sigma Aldrich | 12-348 | Working concentration 1:1500 |
| Normal mouse serum, Sterile, 500mL | Equitech-Bio | SM30-0500 | |
| Goat serum, Sterile, 10mL | Sigma | G9023 | Working concentration 1:1000 |
| TMB peroxidase substrate | KPL | 5120-0076 | Working concentration 1:10,000 |
| Name | Company | Catalog Number | Comments |
| Plasmids | |||
| psPAX2 | Addgene | 12260 | |
| pMD2.G | Addgene | 12259 | |
| pRSV-Rev | Addgene | 12253 | |
| lentiCRISPR v2 | Addgene | 52961 | |
| Name | Company | Catalog Number | Comments |
| Restriction enzymes | |||
| BsrGI | New England Biolabs | R0575S | |
| BsmBI | New England Biolabs | R0580S | |
| EcoRV | New England Biolabs | R0195S | |
| KpnI | New England Biolabs | R0142S | |
| PacI | New England Biolabs | R0547S | |
| SphI | New England Biolabs | R0182S |
References
- Horvath, P., Barrangou, R. CRISPR/Cas, the immune system of bacteria and archaea. Science. 327 (5962), 167-170 (2010).
- Marraffini, L. A., Sontheimer, E. J. CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea. Nat Rev Genet. 11 (3), 181-190 (2010).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- Bellec, J., et al. CFTR inactivation by lentiviral vector-mediated RNA interference and CRISPR-Cas9 genome editing in human airway epithelial cells. Curr Gene Ther. 15 (5), 447-459 (2015).
- Kennedy, E. M., et al. Suppression of hepatitis B virus DNA accumulation in chronically infected cells using a bacterial CRISPR/Cas RNA-guided DNA endonuclease. Virology. 476, 196-205 (2015).
- Roehm, P. C., et al. Inhibition of HSV-1 Replication by Gene Editing Strategy. Sci Rep. 6, 23146 (2016).
- Wang, W., et al. CCR5 gene disruption via lentiviral vectors expressing Cas9 and single guided RNA renders cells resistant to HIV-1 infection. PLoS One. 9 (12), e115987 (2014).
- Kantor, B., Bailey, R. M., Wimberly, K., Kalburgi, S. N., Gray, S. J. Methods for gene transfer to the central nervous system. Adv Genet. 87, 125-197 (2014).
- Lebbink, R. J., et al. A combinational CRISPR/Cas9 gene-editing approach can halt HIV replication and prevent viral escape. Sci Rep. 7, 41968 (2017).
- Xu, L., et al. CRISPR/Cas9-Mediated CCR5 Ablation in Human Hematopoietic Stem/Progenitor Cells Confers HIV-1 Resistance In Vivo. Mol Ther. , (2017).
- Yiu, G., Tieu, E., Nguyen, A. T., Wong, B., Smit-McBride, Z. Genomic Disruption of VEGF-A Expression in Human Retinal Pigment Epithelial Cells Using CRISPR-Cas9 Endonuclease. Invest Ophthalmol Vis Sci. 57 (13), 5490-5497 (2016).
- Kabadi, A. M., Ousterout, D. G., Hilton, I. B., Gersbach, C. A. Multiplex CRISPR/Cas9-based genome engineering from a single lentiviral vector. Nucleic Acids Res. 42 (19), e147 (2014).
- Fu, Y., Sander, J. D., Reyon, D., Cascio, V. M., Joung, J. K. Improving CRISPR-Cas nuclease specificity using truncated guide RNAs. Nat Biotechnol. 32 (3), 279-284 (2014).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 31 (9), 827-832 (2013).
- Kim, S., Kim, D., Cho, S. W., Kim, J., Kim, J. S. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Res. 24 (6), 1012-1019 (2014).
- Pattanayak, V., et al. High-throughput profiling of off-target DNA cleavage reveals RNA-programmed Cas9 nuclease specificity. Nat Biotechnol. 31 (9), 839-843 (2013).
- Shalem, O., et al. Genome-scale CRISPR-Cas9 knockout screening in human cells. Science. 343 (6166), 84-87 (2014).
- Schaefer, K. A., et al. Unexpected mutations after CRISPR-Cas9 editing in vivo. Nat Methods. 14 (6), 547-548 (2017).
- Choi, J. G., et al. Lentivirus pre-packed with Cas9 protein for safer gene editing. Gene Ther. 23 (7), 627-633 (2016).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
- Truong, D. J., et al. Development of an intein-mediated split-Cas9 system for gene therapy. Nucleic Acids Res. 43 (13), 6450-6458 (2015).
- Nelson, C. E., Gersbach, C. A. Engineering Delivery Vehicles for Genome Editing. Annu Rev Chem Biomol Eng. 7, 637-662 (2016).
- Jaalouk, D. E., Crosato, M., Brodt, P., Galipeau, J. Inhibition of histone deacetylation in 293GPG packaging cell line improves the production of self-inactivating MLV-derived retroviral vectors. Virol J. 3, 27 (2006).
- Ellis, B. L., Potts, P. R., Porteus, M. H. Creating higher titer lentivirus with caffeine. Hum Gene Ther. 22 (1), 93-100 (2011).
- Hoban, M. D., et al. Delivery of Genome Editing Reagents to Hematopoietic Stem/Progenitor Cells. Curr Protoc Stem Cell Biol. 36, 1-10 (2016).
- Bayer, M., et al. A large U3 deletion causes increased in vivo expression from a nonintegrating lentiviral vector. Mol Ther. 16 (12), 1968-1976 (2008).
- Kantor, B., Ma, H., Webster-Cyriaque, J., Monahan, P. E., Kafri, T. Epigenetic activation of unintegrated HIV-1 genomes by gut-associated short chain fatty acids and its implications for HIV infection. Proc Natl Acad Sci U S A. 106 (44), 18786-18791 (2009).
- Ortinski, P. I., O’Donovan, B., Dong, X., Kantor, B. Integrase-Deficient Lentiviral Vector as an All-in-One Platform for Highly Efficient CRISPR/Cas9-Mediated Gene Editing. Mol Ther Methods Clin Dev. 5, 153-164 (2017).
- Kantor, B., et al. Notable reduction in illegitimate integration mediated by a PPT-deleted, nonintegrating lentiviral vector. Mol Ther. 19 (3), 547-556 (2011).
- Berkhout, B., Verhoef, K., van Wamel, J. L., Back, N. K. Genetic instability of live, attenuated human immunodeficiency virus type 1 vaccine strains. J Virol. 73 (2), 1138-1145 (1999).
- Gomez-Gonzalo, M., et al. The hepatitis B virus X protein induces HIV-1 replication and transcription in synergy with T-cell activation signals: functional roles of NF-kappaB/NF-AT and SP1-binding sites in the HIV-1 long terminal repeat promoter. J Biol Chem. 276 (38), 35435-35443 (2001).
- Kim, Y. S., et al. Artificial zinc finger fusions targeting Sp1-binding sites and the trans-activator-responsive element potently repress transcription and replication of HIV-1. J Biol Chem. 280 (22), 21545-21552 (2005).
- Ortinski, P. I., Lu, C., Takagaki, K., Fu, Z., Vicini, S. Expression of distinct alpha subunits of GABAA receptor regulates inhibitory synaptic strength. J Neurophysiol. 92 (3), 1718-1727 (2004).
- Van Lint, C., et al. Transcription factor binding sites downstream of the human immunodeficiency virus type 1 transcription start site are important for virus infectivity. J Virol. 71 (8), 6113-6127 (1997).
- Van Lint, C., Ghysdael, J., Paras, P., Burny, A., Verdin, E. A transcriptional regulatory element is associated with a nuclease-hypersensitive site in the pol gene of human immunodeficiency virus type 1. J Virol. 68 (4), 2632-2648 (1994).
- Xu, W., Russ, J. L., Eiden, M. V. Evaluation of residual promoter activity in gamma-retroviral self-inactivating (SIN) vectors. Mol Ther. 20 (1), 84-90 (2012).
- . Testing for Replication Competent Retrovirus (RCR)/Lentivirus (RCL) in Retroviral and Lentiviral Vector Based Gene Therapy Products – Revisiting Current FDA Recommendations Available from: https://sites.duke.edu/dvvc/files/2016/05/FDA-recommendation-for-RCR-testing.pdf (2017)
- . Biosafety in Microbiological and Biomedical Laboratories Available from: https://www.cdc.gov/biosafety/publications/bmbl5/bmbl.pdf (2017)
- Dull, T., et al. A third-generation lentivirus vector with a conditional packaging system. J Virol. 72 (11), 8463-8471 (1998).
- Liu, X. S., et al. Editing DNA Methylation in the Mammalian Genome. Cell. 167 (1), 233-247 (2016).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Zetsche, B., et al. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell. 163 (3), 759-771 (2015).

