Titolazione ELISA come un metodo per determinare la costante di dissociazione dell'interazione ligando del recettore
Summary
Un protocollo dettagliato per eseguire una titolazione ELISA è descritto. Inoltre, un algoritmo di romanzo è presentato per valutare titolazione ELISAs e ottenere una costante di dissociazione di legame di un ligando solubile ad un recettore di immobilizzato piastra di microtitolo.
Abstract
La costante di dissociazione viene descritta l’interazione tra due partner nell’equilibrio associazione ed è una misura della loro affinità. È un parametro fondamentale per confrontare diversi ligandi, per esempio, inibitori competitivi, isoforme della proteina e mutanti, per la loro forza vincolante ad un partner di associazione. Costanti di dissociazione sono determinate tracciando le concentrazioni di associato contro gratis ligando come curve di associazione. Al contrario, le curve di titolazione, in cui un segnale che è proporzionale alla concentrazione del ligando associato viene tracciato contro la concentrazione totale di ligando aggiunto, sono molto più facili da registrare. Il segnale può essere rilevato spettroscopicamente e dall’analisi enzima-collegata dell’immunosorbente (ELISA). Questo è esemplificato in un protocollo per una titolazione test ELISA che misura l’associazione del rhodocetin di derivata da veleno di serpente al proprio dominio di destinazione immobilizzato dell’integrina α2β1. Titolazione ELISAs sono versatile e ampiamente utilizzati. Qualsiasi coppia di proteine interagenti utilizzabile come immobilizzato recettore e ligando solubile, purché entrambe le proteine sono pure, e le loro concentrazioni sono noti. La difficoltà è stata finora per determinare la costante di dissociazione da una curva di titolazione. In questo studio, è stato introdotto una funzione matematica sottostante curve di titolazione. Senza qualsiasi stima errori grafico di una resa di saturazione, questo algoritmo consente l’elaborazione dei dati grezzi (intensità del segnale a differenti concentrazioni di ligando aggiunto) direttamente dalla valutazione matematica tramite regressione non lineare. Così, diverse curve di titolazione possono essere registrate simultaneamente e trasformate in un set di parametri caratteristici, tra cui la costante di dissociazione e la concentrazione del recettore vincolante-attivo, e possono essere valutati statisticamente. Quando combinato con questo algoritmo, titolazione ELISAs guadagnare il vantaggio di presentare direttamente la costante di dissociazione. Pertanto, essi possono essere utilizzati in modo più efficiente in futuro.
Introduction
La costante di dissociazione K è un parametro fondamentale per descrivere l’affinità di un recettore (R) per il suo ligando (L). Basato sulla legge di azione di massa, K è definito per l’equilibrio, in cui il RL complesso recettore-ligando si dissocia nel recettore R e il ligando l:
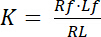 Equazione 1
Equazione 1
con gli indici f che indica lo stato di libero/non legata del recettore e ligando. La concentrazione del complesso recettore-ligando, RL, è identica alla concentrazione del ligando del recettore associato Lb. Come la concentrazione totale dei recettori Rt è la somma del recettore libero Rf e recettore-ligando Rb = Lb, la costante di dissociazione può essere scritta anche come:
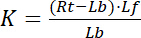 Equazione 2
Equazione 2
Quindi, la saturazione rendimento Y, definita come la frazione di ligando associato Lb in relazione alla concentrazione totale di recettore Rt,
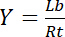 Equazione 3
Equazione 3
dipende dalla concentrazione del ligando libero Lf:
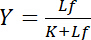 Equazione 4
Equazione 4
Questa relazione iperbolica descrive la curva di associazione di un’interazione recettore-ligando e sua trama indica la concentrazione del ligando associato Lb in funzione della concentrazione del ligando libero Lf. Dalla curva di associazione, la costante di dissociazione K può essere derivata come la concentrazione del ligando libero allo snervamento mezzo massima saturazione. Inoltre, sono stati istituiti diversi algoritmi per linearizzare le curve di associazione, come la trama di doppio-reciproco di Klotz1,2, o trasformazioni secondo Scatchard o Hanes (Recensito da Bisswanger3). Tuttavia, tutti gli algoritmi soffrono il problema che il valore massimo del rendimento saturazione, che si avvicina asintoticamente ad alte concentrazioni di ligando libero della curva di associazione, deve essere stimato in una pre-valutazione grafica e pertanto è soggetta a errori.
Inoltre, la determinazione di una curva di associazione richiede la quantificazione del ligando libero e rilegato durante l’equilibrio di associazione. A tal fine, il ligando libero deve essere separato dal ligando-recettore associato e quantificato. Di conseguenza, il ligando e recettore necessario differiscono nelle loro proprietà, ad esempio un ligando non proteici in contrasto con un ricevitore della proteina. Se entrambi i partner di associazione sono proteine, devono essere distinguibili nelle loro dimensioni, spese o altre caratteristiche molecolari. Tuttavia, la quantificazione delle concentrazioni di ligando in approcci di associazione su piccola scala è un compito difficile. Etichettatura radioattivo del ligando spesso è stato necessario per rilevare la bassa concentrazione del ligando associato, soprattutto se notevoli quantità di recettori non erano disponibili o accessibili. Inoltre, il ligando del recettore associato può dissociare durante e dopo l’isolamento in maniera non trascurabile. Quindi, metodi complessi, come equilibrio gel filtrazione4, elettroforesi capillare5e impulso proteolisi6, sono tenuti a quantificare il ligando del recettore associato e separarlo dal ligando libero.
In contrasto con queste analisi obbligatorie, esperimenti di titolazione non richiedono la separazione quantitativa del ligando legato e libero. A tal fine, un recettore ad una concentrazione costante viene titolato con differenti concentrazioni di ligando aggiunto. Legandosi al recettore, il ligando associato dispone di una proprietà biofisica che lo distingue dal ligando libero ed è misurabile con, per esempio, fotometria, fluorimetria o rilevazione dell’anticorpo. Così, un segnale S, che è proporzionale alla saturazione resa Y e di conseguenza anche alla concentrazione del ligando del recettore associato (Lb), è rilevato come una funzione della concentrazione totale di aggiunto ligand (Lt). Entrambi i parametri, il segnale S e la concentrazione totale di ligando aggiunto sono quantificati in modo diretto e agevole rispetto le concentrazioni di ligando legato e libero. In particolare, la rilevazione del ligando del recettore associato di analisi enzima-collegata dell’immunosorbente (ELISA) ha permesso la riduzione dei volumi di campione di sotto 100 µ l e misurazioni parallele di diverse concentrazioni di ligando anche in multi-pozzetto di microtitolo. In una titolazione ELISA, un recettore è fisicamente adsorbito alla micropiastra alla stessa concentrazione e titolato con legante solubile. Il recettore è immobilizzato per la superficie di plastica essenzialmente mediante adsorbimento idrofobo. La concentrazione della superficie di recettore immobilizzato correla con la concentrazione di rivestimento del recettore in una relazione non lineare, probabile secondo Langmuir´s adsorbimento isoterma7. Oltre al numero totale di molecole adsorbite recettore, il loro stato di attività è un altro parametro importante per le analisi di titolazione. Solo immobilizzato i ricevitori che hanno mantenuto l’attività di legame del ligando, sono rilevanti per il dosaggio di titolazione e infine contribuiscono alla concentrazione totale di recettori attivi Rt del test di titolazione, che non può essere determinato direttamente.
Siti sulla superficie di plastica, che non sono coperti dal recettore immobilizzato sono inclini ad assorbire altre proteine, come il ligando. Adsorbimento fisico del ligando a tali siti di superficie in plastica si tradurrebbe in un segnale simile come il ligando del recettore associato, ma in un modo non specifico. Per ridurre questo segnale aspecifico, i siti di superficie plastica delle piastre micrometodi che non sono state rivestite con proteina ancora verranno bloccate con albumina di siero bovino (BSA). Tuttavia, per alcuni test di titolazione del recettore-ligando, segnali aspecifici sfondo possono essere osservati. Poi, altri agenti di blocco, ad esempio una soluzione di 0,2% di gelatina o di 0,04% Tween 20, sono raccomandati.
Dopo il legame al recettore, il ligando libero viene rimosso mediante due passaggi del lavaggio. Ligando associato rimane con il recettore, che è immobilizzato per la superficie di plastica del pozzo microtitolo e facoltativamente rinforzato tramite la fissazione chimica. Per i successivi covalenti legame incrociato di associato ligando e recettore immobilizzato con glutaraldeide, la sostanza tampone TRIS è sostituita per HEPES, senza alcun cambiamento nel grippaggio del ligand. HEPES, in contrasto con TRIS, non inattivare glutaraldeide. Il legame covalente incrociato con glutaraldeide corregge il ligando associato con il suo recettore e impedisce la sua dissociazione durante i passaggi successivi di lavaggio e di incubazione. Così, l’interazione recettore-ligando chimicamente è congelato e garantisce una curva di titolazione che risente delle successive fasi di lavaggio e di incubazione. Tuttavia, la fissazione di glutaraldeide può modificare chimicamente il ligando e recettore in modo tale che la loro interazione è ridotto o abolito. Inoltre, modifica degli epitopi entro il ligando può modificare l’affinità di legame dell’anticorpo di rilevazione, soprattutto se un anticorpo monoclonale è utilizzato per quantificare il ligando associato. Anche se nessuno di questi effetti avversi della fissazione in glutaraldeide si verifica in questa titolazione ELISA, la sensibilità del test verso glutaraldeide dovrà essere testata per ogni interazione recettore-ligando prima dell’esperimento di titolazione. Dopo la fissazione, glutaraldeide in eccesso viene rimosso in tre lavaggi con tampone TRIS-contenente. TRIS inattiva restanti gruppi di aldeide, che non specifico potrebbero reagire con il rilevamento di anticorpi nel passaggio successivo.
La quantità di legante associato viene quantificata con gli anticorpi enzima-collegata, che forniscono un segnale fotometrico di ELISA S. Ciò è tracciata contro il ligando totale concentrazione Lt aggiunti a ciascun pozzetto. Nonostante la sua più facile acquisizione, la curva di titolazione non è una funzione iperbolica in contrasto con la curva di associazione. Inoltre, esso è stato poco chiaro come calcolare la costante di dissociazione K da una curva di titolazione. Anche se gli algoritmi per linearizzare le curve di titolazione spettroscopicamente acquisite sono stati riportati indipendentemente da Stockell8 e Heyn e Weischet9, sono caduto breve a causa della loro incertezza di stimare il segnale massimo valore che il resa di saturazione si avvicina alle alte concentrazioni di ligando aggiunto.
Qui, una titolazione ELISA e un algoritmo di regressione non lineare sono descritti per ricavare la costante di dissociazione K per un’interazione ligando del recettore da una curva di titolazione. Questo protocollo è esemplificato per l’interazione tra il dominio di A collagene-associazione dell’integrina α2β1 con un inibitore di derivati da veleno di serpente. Le integrine sono molecole di adesione cellulare, che mediano l’ancoraggio delle cellule alla matrice extracellulare circostante o il sottostante membrana basale10,11. Inoltre, le integrine trasmettono segnali importanti tra cellule e matrice extracellulare con l’assunzione di ulteriori molecole di segnalazione e formando nuovi organelli delle cellule, adhesomes, su cellula-matrice interazione12,13, 14. il collagene, il ligando di integrina α2β1, è la proteina più abbondante del corpo umano ed è un componente fondamentale dell’armatura del tessuto connettivo15. L’interazione tra integrina α2β1 e collagene è mediata dal dominio della subunità α2 integrine. L’integrina α2A-dominio contiene un catione bivalente, che è necessaria per l’associazione di collagene e stabilizza la sua struttura. Il selvaggio-tipo modulo nonché mutanti del dominio α2A, ad esempio quella in cui il residuo di superficie-esposta Y216 era stato sostituito per una glicina, possono essere facilmente prodotta recombinantly in un sistema di espressione batterica e isolati tramite loro oligo-His-tag con un NiNTA colonna di SuperFlow con una successiva dialisi contro di 2 mM MgCl2contenente soluzione fisiologica tamponata (TBS; 50 mM TRIS/HCl, pH 7.4, 150 mM NaCl)16. Le loro concentrazioni sono state determinate con l’analisi di acido bicinconinico (BCA) e loro purezze sono testate da convenzionale SDS-PAGE e macchiate con Coomassie Brilliant Blue R250.
L’interazione tra integrina α2β1 e collagene è bloccato dall’associazione del componente di veleno di serpente, rhodocetin, dalla vipera di pozzo malese (Calloselasma rhodostoma)16,17. Usato come un legante solubile in questa titolazione ELISA, rhodocetin è stato purificato dal greggio veleno come descritto in precedenza16. Esso è disciolto in soluzione salina tamponata HEPES (HBS; 10 mM HEPES/NaOH, pH 7.4, 150 mM NaCl) ed è conservato congelati a-20 ° C. La sua concentrazione è stata determinata da BCA e la sua purezza è stata dimostrata da SDS-PAGE. Come antagonista, rhodocetin non solo blocca collagene vincolanti per l’integrina α2β1 dominio, ma inoltre stabilizza la conformazione inattiva dell’integrina impedendo qualsiasi segnalazione da collagene nelle cellule o piastrine18. È di grande importanza biomedica per determinare la costante di dissociazione di rhodocetin con il suo obiettivo di recettore e svelare così il meccanismo molecolare e farmaceutici potenziali ad es., come agente antitrombotico. A tal fine, una titolazione ELISA è descritto compreso la sua valutazione, che è applicabile a quasi qualsiasi interazione recettore-ligando con una stechiometria 1:1 interazione.
Protocol
Representative Results
Discussion
La titolazione ELISA è un sistema versatile per determinare la dissociazione di un’interazione recettore-ligando. Come la titolazione ELISA elude la necessità di separare i leganti liberi e rilegati in modo efficace e per analizzare quantitativamente, le loro concentrazioni sostanzialmente più studi e pubblicazioni hanno impiegato titolazione ELISAs invece di registrare curve di associazione . Inoltre, titolazione ELISAs sono facili da eseguire e richiedono ragionevolmente basse quantità di recettore e ligando. Per u…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Il protocollo e l’algoritmo sono stati sviluppati all’interno di un progetto finanziato dalla Deutsche Forschungsgemeinschaft (DFG grant SFB1009 A09 ed EB177/13-1). L’autore ringrazia Barbara Schedding e Felix Schmalbein per il supporto tecnico e Dr. Niland per leggere criticamente il manoscritto.
Materials
| TRIS | neoFrox | 1125KG001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| NaCl | Applichem | 1,316,591,214 | |
| MgCl2 | Merck | 172571 | |
| integrin a2A, wild-type and mutant, recombinant | isolated in author's lab | ||
| NiNTA superflow column | Qiagen, Germany | 30821 | |
| Coomassie-Brilliant Blue R250 | Serva | 35050 | |
| bicinchoninic acid assay (BCA), protein concentration determination kit | Fisher Scientific | 23225 | |
| bovine serum albumine (BSA), fraction V | Applichem | A1391 | |
| 25 % solution of glutaraldehyde | Merck | 354400 | |
| anti-rabbit immunglobulin-antibodies from goat, conjugated with alkaline phosphatase | Sigma-Aldrich | A9919 | |
| Glycine | Applichem | A1377 | |
| Zn(II)-acetate | Applichem | A4324 | |
| NaOH | Applichem | A1551 | |
| Alkaline phosphatase substrate tablet (5 mg) | Sigma-Aldrich | S0942 | |
| Costar half-area microtiter plate | Thermo Scientific | Corning 3690 | |
| micro reaction tubes | Eppendorf | 30120086 | |
| Microplate ELISA reader | BioTek | Synergy HT |
References
- Klotz, I. M. The application of the law of mass action to binding by proteins; interactions with calcium. Arch Biochem. 9, 109-117 (1946).
- Klotz, I. M. Ligand-receptor complexes: origin and development of the concept. J Biol Chem. 279 (1), 1-12 (2004).
- Bisswanger, H. Ch. 1: Multiple Equilibria, Principles and Derivations. Enzyme Kinetics: Principles and Methods. , 1-26 (2017).
- Shimura, K., Kasai, K. Affinity gel titration: quantitative analysis of the binding equilibrium between immobilized protein and free ligand by a continuous titration procedure. Anal Biochem. 149 (2), 369-378 (1985).
- Gong, M., Nikcevic, I., Wehmeyer, K. R., Limbach, P. A., Heineman, W. R. Protein-aptamer binding studies using microchip affinity capillary electrophoresis. Electrophoresis. 29 (7), 1415-1422 (2008).
- Hanes, M. S., Ratcliff, K., Marqusee, S., Handel, T. M. Protein-protein binding affinities by pulse proteolysis: application to TEM-1/BLIP protein complexes. Protein Sci. 19 (10), 1996-2000 (2010).
- Latour, R. A. The Langmuir isotherm: a commonly applied but misleading approach for the analysis of protein adsorption behavior. J Biomed Mater Res A. 103 (3), 949-958 (2015).
- Stockell, A. The binding of diphosphopyridine nucleotide by yeast glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem. 234 (5), 1286-1292 (1959).
- Heyn, M. P., Weischet, W. O. Circular dichroism and fluorescence studies on the binding of ligands to the α subunit of tryptophan synthase. Biochem. 14 (13), 2962-2968 (1975).
- Campbell, I. D., Humphries, M. J. Integrin structure, activation, and interactions. Cold Spring Harb Perspect Biol. 3 (3), (2011).
- Zeltz, C., Gullberg, D. The integrin-collagen connection–a glue for tissue repair?. J Cell Sci. 129 (4), 653-664 (2016).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468 (7323), 580-584 (2010).
- Luo, B. H., Carman, C. V., Springer, T. A. Structural basis of integrin regulation and signaling. Annu Rev Immunol. 25, 619-647 (2007).
- Luo, B. H., Springer, T. A. Integrin structures and conformational signaling. Curr Opin Cell Biol. 18 (5), 579-586 (2006).
- Ricard-Blum, S. The collagen family. Cold Spring Harb Perspect Biol. 3 (1), a004978 (2011).
- Eble, J. A., Tuckwell, D. S. The α2β1 integrin inhibitor rhodocetin binds to the A-domain of the integrin α2 subunit proximal to the collagen-binding site. Biochem J. 376 (Pt 1), 77-85 (2003).
- Eble, J. A., et al. The α2β1 integrin-specific antagonist rhodocetin is a cruciform, heterotetrameric molecule. FASEB J. 23 (9), 2917-2927 (2009).
- Eble, J. A., et al. Dramatic and concerted conformational changes enable rhodocetin to block α2β1 integrin selectively. PLoS Biol. 15 (7), e2001492 (2017).
- Bracht, T., Figueiredo de Rezende, F., Stetefeld, J., Sorokin, L. M., Eble, J. A. Monoclonal antibodies reveal the alteration of the rhodocetin structure upon α2β1 integrin binding. Biochem J. 440 (1), 1-11 (2011).
- Harlow, E., Lane, D. Chapter 5: Immunizations. Antibodies, a laboratory manual. 5, 53-138 (1988).
- Lu, D. Analyzing interactions between SSB and proteins by the use of fluorescence anisotropy. Methods Mol Biol. 922, 155-159 (2012).
- Fielding, L. NMR methods for the determination of protein-ligand dissociation constants. Curr Top Med Chem. 3 (1), 39-53 (2003).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr Opin Struct Biol. 11 (5), 560-566 (2001).
- McDonnell, J. M. Surface plasmon resonance: towards an understanding of the mechanisms of biological molecular recognition. Curr Opin Chem Biol. 5 (5), 572-577 (2001).
- Rich, R. L., Myszka, D. G. Advances in surface plasmon resonance biosensor analysis. Curr Opin Biotechnol. 11 (1), 54-61 (2000).
- Pesquero, N. C., et al. Real-time monitoring and kinetic parameter estimation of the affinity interaction of jArtinM and rArtinM with peroxidase glycoprotein by the electrogravimetric technique. Biosens Bioelectron. 26 (1), 36-42 (2010).
- Scheuermann, T. H., Padrick, S. B., Gardner, K. H., Brautigam, C. A. On the acquisition and analysis of microscale thermophoresis data. Anal Biochem. 496, 79-93 (2016).

