Uso de Autometallography para localizar e quantificar semi prata em tecidos de cetáceos
Summary
Um protocolo é apresentado para localizar Ag em cetáceos tecidos de fígado e rim por autometallography. Além disso, um novo ensaio, chamado o ensaio de Ag histológico cetáceos (CHAA) é desenvolvido para estimar as concentrações de Ag desses tecidos.
Abstract
Nanopartículas de prata (AgNPs) têm sido usadas extensivamente em produtos comerciais, incluindo têxteis, cosméticos e itens de cuidados de saúde, devido aos seus fortes efeitos antimicrobianos. Eles também podem ser liberados no ambiente e se acumulam no oceano. Portanto, AgNPs são a principal fonte de contaminação de Ag, e está aumentando a consciência pública da toxicidade ambiental da Ag. Estudos anteriores têm demonstrado a bioacumulação (em produtores) e ampliação (em consumidores/predadores) da Ag. Cetáceos, como os predadores do apex do oceano, podem ter sido negativamente afetados pelos compostos Ag/Ag. Embora as concentrações dos compostos de Ag/Ag em cetáceos tecidos podem ser medidas por espectroscopia de massa de plasma indutivamente acoplado (ICP-MS), o uso de ICP-MS é limitado pelo seu elevado custo de capital e o requisito de armazenamento/preparação do tecido. Portanto, um autometallography (AMG) método com uma análise quantitativa de imagem usando formalin-fixas, parafina-encaixados do tecido (FFPE) pode ser um método adjuvante para localizar a distribuição de Ag a nível suborgan e estimar a concentração de Ag em cetáceos tecidos. Os sinais positivos de AMG são principalmente marrons a preto granulado de vários tamanhos no citoplasma das células de Kupffer, hepatócitos e epitélio tubular renal proximal. Ocasionalmente, alguns amorfo amarelo dourado a marrons sinais positivos de AMG são anotados no lúmen e membrana basal de alguns túbulos renais proximais. O ensaio para estimar a concentração de Ag é chamado o cetáceo histológica Ag ensaio (CHAA), que é um modelo de regressão estabelecido pelos dados da análise quantitativa de imagem do método AMG e ICP-MS. O uso de AMG com CHAA para localizar e quantificar semi metais fornece uma metodologia conveniente para estudos espácio-temporais e entre espécies.
Introduction
Nanopartículas de prata (AgNPs) têm sido usadas extensivamente em produtos comerciais, incluindo têxteis, cosméticos e itens de cuidados de saúde, devido a seus efeitos antimicrobianos grande1,2. Portanto, a produção de AgNPs e o número de produtos que contenham AgNP são aumentadas por tempo3,4. No entanto, AgNPs pode ser liberado para o ambiente e se acumulam no oceano5,6. Eles se tornaram a principal fonte de contaminação de Ag, e está aumentando a consciência pública da toxicidade ambiental da Ag.
O status de AgNPs e Ag no meio marinho é complicada e constante mudança. Estudos anteriores indicaram que os AgNPs podem permanecer como partículas, agregadas, dissolvem, reagem com diferentes espécies químicas ou ser regeneradas de íons de Ag+ 7,8. Vários tipos de compostos de Ag, como o AgCl, foram encontrados em sedimentos marinhos, onde eles podem ser ingeridos por organismos bênticos e digite a cadeia alimentar9,10. De acordo com um estudo anterior realizado na área de lagoa de Chi-ku ao longo da costa sudoeste de Taiwan, as concentrações de Ag de sedimentos marinhos são extremamente baixos e similares para a abundância da crosta terrestre, e do tecido do fígado de peixes são geralmente abaixo da deteção limite (< 0.025 μg/g úmido/úmido)11. No entanto, estudos anteriores realizados em diferentes países demonstraram relativamente altas concentrações de Ag em fígados de cetáceos12,13. A concentração de Ag em fígados de cetáceos é dependente da idade, sugerindo que a fonte da Ag em seus corpos provavelmente é sua presa12. Estes achados ainda mais sugerem a bioamplificação de Ag em animais em níveis tróficos superiores. Cetáceos, como os predadores do apex no oceano, podem ter sofrido impactos de saúde negativos causados por Ag/Ag compostos12,13,14. Mais importante ainda, como os cetáceos, os humanos são mamíferos e a saúde negativa impactos causados por compostos de Ag/Ag em cetáceos também podem ocorrer em humanos. Em outras palavras, os cetáceos poderiam ser animais de sentinela para a saúde do ambiente marinho e os seres humanos. Portanto, os efeitos na saúde, a distribuição tecidual e concentração de Ag em cetáceos são motivo de grande preocupação.
Embora as concentrações dos compostos de Ag/Ag em cetáceos tecidos podem ser medidas por espectroscopia de massa de plasma indutivamente acoplado (ICP-MS), a utilização de ICP-MS é limitada pelo seu elevado custo de capital (instrumento e manutenção) e os requisitos para armazenamento de tecidos /Preparation12,15. Além disso, é normalmente difícil de coletar amostras de tecido abrangente em todas as investigações de casos de Cetáceos encalhados devido a dificuldades logísticas, a escassez de mão de obra e uma falta de recursos relacionados12. As amostras de tecido congelado para análise de ICP-MS não são facilmente armazenadas por causa do espaço limitado de refrigeração, e amostras de tecido congelado podem ser descartadas devido à refrigeração quebrado equipamentos12. Esses obstáculos acima mencionados dificultam investigações dos níveis de contaminação em cetáceos tecidos por ICP-MS análise usando amostras de tecido congelado. Em contraste, formalina fixo amostras de tecido são relativamente fáceis de coletar durante a necropsia de cetáceos mortos-encalhado. Portanto, é necessário desenvolver um método fácil de usar e de baixo custo para detectar/medida os metais pesados em tecidos de cetáceos usando formalina fixada amostras de tecido.
Embora as distribuições de suborgan e concentrações de metais alcalinos e alcalinos terrosos podem ser alteradas durante o formalin-fixas, parafina processo (FFPE), apenas menores efeitos sobre metais de transição, tais como Ag, ter sido notável16. Daí, tecido FFPE tem sido considerado como um recurso de amostra ideal para localização de metal e medições16,17. Autometallography (AMG), um processo histoquímico, pode amplificar a metais pesados como variably tamanho amarelo dourado para sinais positivos de preto AMG em secções de tecido FFPE, e estes metais pesados amplificados pode ser visualizados sob microscopia de luz18, 19 , 20 , 21. portanto, o método AMG fornece informações sobre as distribuições de suborgan de metais pesados. Pode fornecer informações adicionais importantes para estudar as vias metabólicas de metais pesados em sistemas biológicos porque ICP-MS só pode medir a concentração de metais pesados no órgão nível18. Além disso, software de análise de imagem digital, tais como ImageJ, aplicou-se a análise quantitativa de tecido histológicas seções22,23. O amarelo dourado tamanho variável para sinais positivos de preto AMG FFPE de seções do tecido pode ser quantificado e utilizado para estimar as concentrações de metais pesados. Embora a concentração de Ag a absoluta não pode ser determinada diretamente pelo método AMG com análise quantitativa de imagem, pode ser calculada por um modelo de regressão com base nos dados obtidos a partir da análise quantitativa de imagem e ICP-MS, que é chamado de cetáceos ensaio de Ag histológico (CHAA). Considerando as dificuldades em medir as concentrações de Ag por análise de ICP-MS em cetáceos mais encalhados, CHAA é um método adjuvante valioso para estimar concentrações de Ag em tecidos de cetáceos, que não podem ser determinados pela análise de ICP-MS, devido à falta de congelados amostras de tecido. Este documento descreve o protocolo de uma técnica histochemical (método AMG) para localização de Ag a nível de suborgan e um ensaio chamado CHAA para estimar as concentrações de Ag nos tecidos fígado e rim de cetáceos.
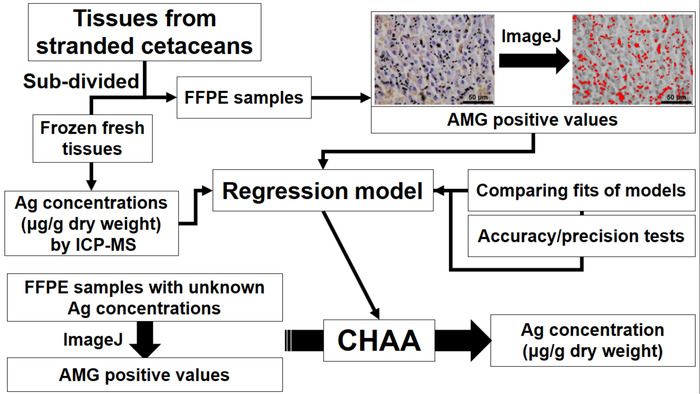
Figura 1: fluxograma representando o estabelecimento e aplicação de ensaio de Ag histológica cetáceos (CHAA) para estimar as concentrações de Ag. CHAA = cetáceos histológica Ag do ensaio, FFPE = Formalin-fixas, parafina, ICP-MS = espectroscopia de massa de plasma indutivo. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
O propósito do estudo do artigo é estabelecer um método adjuvante para avaliar a distribuição do Ag em níveis de suborgan e para estimar as concentrações de Ag em tecidos de cetáceos. Os protocolos atuais incluem 1) determinação das concentrações de Ag em cetáceos tecidos por ICP-MS, análise 2) AMG de amostras de tecido par-combinadas com concentrações conhecidas de Ag, 3) o estabelecimento do modelo de regressão (CHAA) para estimar as concentrações de Ag por valores positivos de AMG, 4) avaliação d…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos a rede de encalhe de cetáceos Taiwan para coleta e armazenamento, incluindo a sociedade de cetáceos de Taiwan, Taipé; o laboratório de pesquisa de cetáceos (Prof Lien-Siang Chou), o Instituto de ecologia e biologia evolutiva, Universidade Nacional de Taiwan, Taipé; Museu Nacional de ciências naturais (Dr. Yao Chiou-Ju), Taichung; e a biologia marinha & centro de pesquisa de cetáceos, Universidade Nacional de Cheng-Kung. Agradecemos também o departamento de silvicultura, Conselho de agricultura, Yuan executivo pela sua licença.
Materials
| HQ Silver enhancement kit | Nanoprobes | #2012 | |
| Surgipath Paraplast | Leica Biosystems | 39601006 | Paraffin |
| 100% Ethanol | Muto Pure Chemical Co., Ltd | 4026 | |
| Non-Xylene | Muto Pure Chemical Co., Ltd | 4328 | |
| Silane coated slide | Muto Pure Chemical Co., Ltd | 511614 | |
| Cover glass (25 x 50 mm) | Muto Pure Chemical Co., Ltd | 24501 | |
| Malinol | Muto Pure Chemical Co., Ltd | 20092 | |
| GM Haematoxylin Staining | Muto Pure Chemical Co., Ltd | 3008-1 | |
| 10% neutral buffered formalin solution | Chin I Pao Co., Ltd | — | |
| Tip (1000 μL) | MDBio, Inc. | 1000 | |
| PIPETMAN Classic P1000 | Gilson, Inc. | F123602 | |
| 15 ml Centrifuge Tube | GeneDireX, Inc. | PC115-0500 | |
| Dogfish liver | National Research Council of Canada | DOLT-2 | |
| Dogfish muscle | National Research Council of Canada | DORM-2 | |
| Inductively coupled plasma mass spectrometry (ICP-MS) | PerkinElmer Inc. | PE-SCIEX ELAN 6100 DRC | |
| FreeZone 6 liter freeze dry system | Labconco | 7752030 | For freeze drying |
| BRAND® SILBERBRAND volumetric flask | Merck | Z326283 | |
| 30 mL standard vial, flat interior with 33 mm closure | Savillex Corporation | 200-030-12 | For diagestion |
| Nitric acid, superpur®, 65.0% | Merck | 1.00441 | For diagestion |
| Hot Plate/Stirrers | Corning® | PC-220 | For diagestion |
| High Shear lab mixer | Silverson | SL2T | For homogenization |
| Sterile polypropylene sample jar (250mL) | Thermo Scientific™ | 6186L05 | For homogenization |
| Digital camera | Nikon Corporation | DS-Fi2 | |
| Light microscope | Nikon Corporation | ECLIPSE Ni-U | |
| Shandon™ Finesse™ 325 manual microtome | Thermo Scientific™ | A78100001H | |
| Accu-Cut® SRM™ 200 rotary microtome | Sakura | 1429 | |
| Microtome blade S35 | FEATHER® | 207500000 | |
| Slide staining dish and cover | Brain Research Laboratories | #3215 | |
| Steel staining rack | Brain Research Laboratories | #3003 | |
| Shandon embedding center | Thermo Scientific™ | S-EC | |
| Shandon Citadel® tissue processor | Thermo Scientific™ | 69800003 | |
| Slide warmer | Lab-Line Instruments | 26005 | |
| Water bath | Shandon Capshaw | 3964 | |
| Filter paper | Merck | 1541-070 | |
| Prism 6.01 for windows | GraphPad Software | Statistic software | |
| ImageJ | National Institutes of Health | ||
| Stainless steel tissue embedding mould | Shenyang Roundfin Trade Co., Ltd | RD-TBM003 | For paraffin emedding |
References
- McGillicuddy, E., et al. Silver nanoparticles in the environment: Sources, detection and ecotoxicology. Science Total Environment. 575, 231-246 (2017).
- Yu, S. J., Yin, Y. G., Liu, J. F. Silver nanoparticles in the environment. Environmental Science: Processes and Impacts. 15 (1), 78-92 (2013).
- Hansen, S. F., et al. Nanoproducts- what is actually available to European consumers?. Environmental Science: Nano. 3 (1), 169-180 (2016).
- Vance, M. E., et al. Nanotechnology in the real world: Redeveloping the nanomaterial consumer products inventory. Beilstein Journal of Nanotechnology. 6, 1769-1780 (2015).
- Farre, M., Gajda-Schrantz, K., Kantiani, L., Barcelo, D. Ecotoxicity and analysis of nanomaterials in the aquatic environment. Analytical and Bioanalytical Chemistry. 393 (1), 81-95 (2009).
- Walters, C. R., Pool, E. J., Somerset, V. S. Ecotoxicity of silver nanomaterials in the aquatic environment: a review of literature and gaps in nano-toxicological research. Journal of Environmental Science and Health. Part A, Toxic/hazardous Substances & Environmental Engineering. 49 (13), 1588-1601 (2014).
- Levard, C., Hotze, E. M., Lowry, G. V., Brown, G. E. Environmental transformations of silver nanoparticles: impact on stability and toxicity. Environmental Science & Technology. 46 (13), 6900-6914 (2012).
- Massarsky, A., Trudeau, V. L., Moon, T. W. Predicting the environmental impact of nanosilver. Environmental Toxicology and Pharmacology. 38 (3), 861-873 (2014).
- Wang, H., et al. Toxicity, bioaccumulation, and biotransformation of silver nanoparticles in marine organisms. Environmental Science and Technology. 48 (23), 13711-13717 (2014).
- Buffet, P. E., et al. A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species: the ragworm Hediste diversicolor and the bivalve mollusc Scrobicularia plana. Science of the Total Environment. 470, 1151-1159 (2014).
- Chen, M. H. Baseline metal concentrations in sediments and fish, and the determination of bioindicators in the subtropical Chi-ku Lagoon, S W Taiwan. Marine Pollution Bulletin. 44 (7), 703-714 (2002).
- Li, W. T., et al. Investigation of silver (Ag) deposition in tissues from stranded cetaceans by autometallography (AMG). Environmental Pollution. , 534-545 (2018).
- Chen, M. H., et al. Tissue concentrations of four Taiwanese toothed cetaceans indicating the silver and cadmium pollution in the western Pacific Ocean. Marine Pollution Bulletin. 124 (2), 993-1000 (2017).
- Li, W. T., et al. Immunotoxicity of silver nanoparticles (AgNPs) on the leukocytes of common bottlenose dolphins (Tursiops truncatus). Scientific Reports. , (2018).
- Bornhorst, J. A., Hunt, J. W., Urry, F. M., McMillin, G. A. Comparison of sample preservation methods for clinical trace element analysis by inductively coupled plasma mass spectrometry. American Journal of Clinical Pathology. 123 (4), 578-583 (2005).
- Bonta, M., Torok, S., Hegedus, B., Dome, B., Limbeck, A. A comparison of sample preparation strategies for biological tissues and subsequent trace element analysis using LA-ICP-MS. Analytical and Bioanalytical Chemistry. 409 (7), 1805-1814 (2017).
- Bischoff, K., Lamm, C., Erb, H. N., Hillebrandt, J. R. The effects of formalin fixation and tissue embedding of bovine liver on copper, iron, and zinc analysis. Journal of Veterinary Diagnostic Investigation. 20 (2), 220-224 (2008).
- Miller, D. L., Yu, I. J., Genter, M. B. Use of Autometallography in Studies of Nanosilver Distribution and Toxicity. International Journal of Toxicology. 35 (1), 47-51 (2016).
- Anderson, D. S., et al. Influence of particle size on persistence and clearance of aerosolized silver nanoparticles in the rat lung. Toxicological Sciences. 144 (2), 366-381 (2015).
- Kim, W. Y., Kim, J., Park, J. D., Ryu, H. Y., Yu, I. J. Histological study of gender differences in accumulation of silver nanoparticles in kidneys of Fischer 344 rats. Journal of Toxicology and Environmental Health, Part A. 72 (21-22), 1279-1284 (2009).
- Danscher, G. Applications of autometallography to heavy metal toxicology. Pharmacology Toxicology. 68 (6), 414-423 (1991).
- Deroulers, C., et al. Analyzing huge pathology images with open source software. Diagnostic Pathology. 8, 92 (2013).
- Shu, J., Dolman, G. E., Duan, J., Qiu, G., Ilyas, M. Statistical colour models: an automated digital image analysis method for quantification of histological biomarkers. BioMedical Engineering Online. 15, 46 (2016).
- Geraci, J. R., Lounsbury, V. J. Specimen and data collection. Marine mammals ashore: a field guide for strandings. , 167-230 (2005).
- Shih, C. -. C., Liu, L. -. L., Chen, M. -. H., Wang, W. -. H. . Investigation of heavy metal bioaccumulation in dolphins from the coastal waters off Taiwan. , (2001).
- Liang, C. S., et al. The relationship between the striatal dopamine transporter and novelty seeking and cognitive flexibility in opioid dependence. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 74, 36-42 (2017).
- Spiess, A. N., Neumeyer, N. An evaluation of R2 as an inadequate measure for nonlinear models in pharmacological and biochemical research: a Monte Carlo approach. BMC Pharmacology. 10, 6 (2010).
- Stoltenberg, M., Danscher, G. Histochemical differentiation of autometallographically traceable metals (Au, Ag, Hg, Bi, Zn): protocols for chemical removal of separate autometallographic metal clusters in Epon sections. Histochemical Journal. 32 (11), 645-652 (2000).
- Dimitriadis, V. K., Domouhtsidou, G. P., Raftopoulou, E. Localization of Hg and Pb in the palps, the digestive gland and the gills in Mytilus galloprovincialis (L.) using autometallography and X-ray microanalysis. Environmental Pollution. 125 (3), 345-353 (2003).
- Loumbourdis, N. S., Danscher, G. Autometallographic tracing of mercury in frog liver. Environmental Pollution. 129 (2), 299-304 (2004).
- Stoltenberg, M., Larsen, A., Kemp, K., Bloch, D., Weihe, P. Autometallographic tracing of mercury in pilot whale tissues in the Faroe Islands. International Journal of Circumpolar Health. 62 (2), 182-189 (2003).

