التقوية لكفاءة جسم السرطان بالعقاقير أنتينيوبلاستيك: الكشف عن التآزر جسم-المخدرات باستخدام معادلة الجمع بين مؤشر
Summary
ويصف هذا البروتوكول كيفية تقييم التآزر بين جسم السرطان والأدوية أنتينيوبلاستيك في نماذج السريرية باستخدام معادلة مؤشر الجمع بين تشو وتالالاي.
Abstract
التقوية مونوكلونل معادية (ماب) من وكلاء العلاج الكيميائي يشكل استراتيجية قيمة لتصميم العلاج فعالة وأكثر أماناً ضد السرطان. هنا نقدم بروتوكول لتحديد مجموعة رشيد في الخطوة الإكلينيكية. أولاً، يصف لنا تحليل يستند إلى الخلية لتقييم التآزر بين ماب السرطان والعقاقير السامة للخلايا، ويستخدم معادلة مؤشر تركيبة شو وتالالاي1. ويشمل هذا القياس لورم الخلية المخدرات-الأجسام المضادة-حساسية واستخدام مقايسة MTT، يليها تحليل الحاسوب الآلي لحساب قيم الفهرس (CI) الجمع بين. قيم CI < 1 تشير إلى التآزر بين مابس المختبرة ووكلاء السامة للخلايا1. للتأكد من صحة في المختبر النتائج التي توصل إليها في فيفو، يصف لنا كذلك وسيلة لتقييم فعالية نظام الجمع في نموذج ورم xenograft. في هذا النموذج، يؤخر النظام إلى حد كبير نمو الورم، مما يؤدي بقاء موسعة كبيرة بالمقارنة مع عامل واحد عناصر التحكم. الأهم من ذلك، والتجريب في فيفو يكشف أن نظام الجمع هو جيد التحمل. يسمح هذا البروتوكول للتقييم الفعال لتركيبات المخدرات السرطان في نماذج السريري وتحديد تركيبة عقلانية لتقييم في التجارب السريرية.
Introduction
وكان النهج التقليدي في علاج عدد كبير من أنواع مختلفة من السرطان استناداً إلى الأحادي. حتى ولو أنه يزال يستخدم في كثير من الحالات، اجتمع هذا الأسلوب العديد من العوائق التي تؤدي إلى اختيار العلاجات المجمعة2. وخاصة الخلايا السرطانية أكثر عرضه لتطوير المقاومة عندما تعامل مع دواء واحد بحمل بديلة بقاء الآليات3، مما تسبب في تعطل العلاجية في مرضى4. وعلاوة على ذلك، هي المخدرات في الأحادي، وعادة ما تدار بجرعة عالية. هذه الحالة كثيرا ما ينتج عن حدوث الآثار الجانبية تعتمد على جرعة قوية يمكن لا تطاق وإجبار الأطباء بوقف العلاج2. لهذه الأسباب، الرابطة لجزيئات السرطان الآن يفضل الأحادي.
مزيج مثالي من المخدرات ستكون تلك التي تعمل في تضافر الجهود ضد الخلايا السرطانية، دون زيادة السمية ضد الخلايا الطبيعية. ويشير التآزر للتفاعل بين اثنين أو أكثر من المخدرات التي تنتج تأثير علاجي أكبر من مجموع كل العقاقير فردية تعمل بشكل منفصل. قد يؤدي مثل هذه التفاعلات في تعزيز الفعالية العلاجية السريرية2. يحد من مقاومة العلاج، ويزيد من فعالية، ويمكن أيضا تقليل سمية2. وفي الواقع، يمكن تخفيض الجرعة لكل دواء لتقليل آثارها الجانبية التي تستهدف مسارات مختلفة. وبالإضافة إلى ذلك، واحدة من الجزيئات يمكن أن تخدم أيضا كعامل توعية ضد الخلايا السرطانية. تأثير المخدرات الثانية وقد تتعزز في خلايا توعية وجرعات أقل يمكن استخدامها5.
يمكن أن تشمل العلاج بالجمع بين اثنين أو أكثر من المخدرات العلاج الكيميائي أو البيولوجي، مثل [مونوكلونل]6. هذه مابس تستهدف على وجه التحديد خلايا معربا عن خلية للمستضد سطحي للفائدة، وهي قادرة على قتل الخلايا السرطانية من خلال مسارات المناعية بما في ذلك تعتمد على جسم الخلية بوساطة سيتوتوكسيسيتي (ADCC)، بمشاركة الخلايا المناعية المستجيب 7، وتعتمد على تكملة سيتوتوكسيسيتي (CDC)6. أنها يمكن أن تعمل أيضا عبر إليه غير مناعية توسط المبرمج8،9،،من1011. في هذه الحالة، قد تقلد عملية موت الخلايا المبرمج توعية الخلايا السرطانية وتضعف وظيفتها وتزيد من فعالية العلاج الكيميائي المخدرات المرتبطة بها في جرعة أقل. على هذا النحو، تعتبر ماب بروابوبتوتيك مرشحا جيدا لتصميم نظم تركيبة مع الأدوية أنتينيوبلاستيك.
وقد وصف مختلف النماذج الرياضية لتقييم التآزر المخدرات؛ واحد منهم يستند إلى الجمع بين مؤشر الأسلوب1. هذا الأسلوب يستند إلى مبدأ الوسطية-تأثير وضعتها شو1. معادلة تأثير متوسط يرتبط بجرعة المخدرات وأثر المخدرات على النحو التالي.
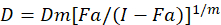
وهنا هي د جرعة المخدرات؛ مارك ألماني هو تأثير متوسط الجرعة؛ اتحاد كرة القدم هو الكسر تتأثر الجرعة؛ m هو إس الذي يدل على شكل الأرض تأثير الجرعة1. متوسط-تأثير الجرعة يستخدم لحساب الجرعة Dx من الدواء الذي يمنع أو يقتل “x” في المئة من الخلايا. ثم يتم حساب قيمة CI لتقييم تأثير المواد المضافة للجمع بين المخدرات، على النحو التالي1.
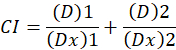
قيمة CI 1 يشير إلى تأثير المواد مضافة وقيمة CI 1 يشير إلى العداء1. تطبيق هذا الأسلوب هو زيادة تيسير توافر برنامج كمبيوتر، كومبوسين، الذي يحدد التآزر والعداء في كل جرعة أو مستويات تأثير محاكاة تلقائياً12.
مجموعتنا الخاصة 8B6 ماب س-أسيتيل-GD2 جانجليوسيدي (OAcGD2) نيوروبلاستوما مستضد13 وكذلك أظهرت أن هذا ماب قادرة على الحث على موت الخلايا مع سمات المبرمج11. لاختبار ما إذا كان يمكن توعية ماب 8B6 نيوروبلاستوما الخلايا توبوتيكان وكيل أنتينيوبلاستيك، نحن تكييف الأسلوب المذكورة أعلاه وضعتها شو1. أولاً، علينا أن نحدد الجرعة الفعالة 50 (ED50) قيم ماب 8B6 وتوبوتيكان. المقبل، تتعرض الخلايا نيوروبلاستوما مع نسب اكويبوتينت من المركبين استناداً إلى قيم50 اد لتحديد قيم CI باستخدام برامج المحاكاة المذكورة أعلاه. هذا الأسلوب يسمح لنا بإظهار التآزر بين ماب 8B6 وتوبوتيكان في المختبر. وبعد ذلك، يصف لنا بروتوكولا لمواصلة تقييم الفاعلية وسلامة هذا الجمع بين نظام في فيفو. يمكن بسهولة تطبيق هذا البروتوكول لتحديد ماب السرطان قوية وآمنة وتركيبات عوامل العلاج الكيميائي في الدراسات الإكلينيكية. ويرد تمثيل تخطيطي لهذه الدراسة في الشكل 1.
Protocol
Representative Results
Discussion
للتنبؤ بتأثير التفاعلات المخدرات، يمكن استخدام ثلاثة أساليب: منهجية إيسوبولوجرام17و نموذج الخليط غير الخطية18والتركيبة فهرس1. تحليل مؤشر تركيبة هو الأكثر استخداماً لأن تطبيقه هو تبسيط بتوافر برنامج كمبيوتر سهلة الاستعمال. لهذا الغرض، نحن أولاً تتسم…
Disclosures
The authors have nothing to disclose.
Acknowledgements
منح الدعم: مؤسسة de Projet de L ‘جامعة نانت، ليه باجوز’ à مانون، الدوري الفرنسي ضد السرطان اللجنة دي لوار-أتلانتيك، لجنة موربيهان دو، ولجنة دي فونديه، une ارتفع من أجل S.A.R.A.H ومارتن دي توال ولوس أنجليس الفرنسية Société de Lutte مكافحة ليه سرطانات et les leucémies الطفل et de شرور (سفسي). M.B. و J.F. معتمدة من قبل الرابطة La مكافحة السرطان. يشكر المؤلفون يوت-مرفق بونامي فرانسوا هيكل Fédérative البحوث. كما يشكر المؤلفون سوزين س. د. (Inserm، باريس) لتزويد الخلايا IMR5 والسيدة H. Estéphan لتقديم المساعدة التقنية لها.
Materials
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
References
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: “Postoperative validation of bone-anchored implants in the single-sided deafness population.” Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. 癌症研究. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. 癌症研究. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).

