Potenzierung der Anti-Krebs-Antikörper-Wirksamkeit von Zytostatika: Nachweis von Antikörper-Wirkstoff-Synergismus mit der Kombination-Index-Gleichung
Summary
Dieses Protokoll beschreibt die Synergien zwischen einem Anti-Krebs-Antikörper und Zytostatika in präklinischen Modellen zu bewerten, indem Sie unter Verwendung der Kombination Index Gleichung von Chou und Talalay.
Abstract
Potenzierung der feindlichen monoklonaler Antikörper (mAb) durch Chemotherapeutika stellt eine sinnvolle Strategie für die Gestaltung effektiver und sicherer Therapie gegen Krebs. Hier bieten wir ein Protokoll, um eine vernünftige Kombination in der präklinischen Phase zu identifizieren. Zunächst beschreiben wir eine zellbasierte Assays um den Synergismus zwischen Anti-Krebs-mAb und Zytostatika, zu beurteilen, der die Kombination Index Gleichsetzung von Chou und Talalay1verwendet. Dazu gehören die Messung des Tumor Zelle Droge – und Antikörper-Empfindlichkeit mit einem MTT-Assay, gefolgt von einer automatisierten Computeranalyse die Kombination Index (CI) Werte berechnen. CI-Werte der < 1 Synergismus zwischen getesteten mAbs und Zytostatika1anzugeben. Um die in-vitro- Ergebnisse in Vivobestätigen, beschreiben wir weiter eine Methode zur Bestimmung der Kombination Therapie Wirksamkeit in einem Xenograft-Tumor-Modell. In diesem Modell verzögert die kombinierte Therapie deutlich Tumorwachstum, führt zu einer erweiterten signifikanten Überlebensvorteil im Vergleich zu Single-Agent-Steuerelemente. Wichtig ist, zeigt der in-Vivo -Experimente, dass die Kombinationstherapie gut vertragen wird. Dieses Protokoll ermöglicht die effektive Bewertung der Anti-Krebs-Medikamenten-Kombinationen in präklinischen Modellen und die Identifizierung von rationalen Kombination, in klinischen Studien zu bewerten.
Introduction
Der konventionelle Ansatz bei der Behandlung einer großen Anzahl von verschiedenen Arten von Krebs beruhte auf Monotherapie. Auch wenn es noch in vielen Fällen verwendet wird, erfüllt diese Methode mehrere Hindernisse zu entscheiden sich für kombinierte Therapien2. Insbesondere sind Krebszellen anfälliger für Widerstand, wenn ein einzelnes Medikament behandelt, durch Induktion alternative überleben Mechanismen3, was zu therapeutischen Scheitern in Patienten4zu entwickeln. Darüber hinaus werden in Monotherapie, Medikamente in der Regel in einer hohen Dosis verwaltet. Diese Situation oft führt das Auftreten von starken dosisabhängige Nebenwirkungen, die Ärzte die Behandlung2stoppen erzwingen und unerträglich werden können. Aus diesen Gründen ist der Verband der Anti-Krebs-Moleküle nun lieber Monotherapie.
Ideale Wirkstoffkombinationen wäre diejenigen, die in Synergie gegen Tumorzellen, ohne erhöhte Toxizität gegen normale Zellen handeln. Synergismus bezieht sich auf die Interaktion von zwei oder mehr Medikamenten, die eine therapeutische Wirkung mehr als die Summe jedes einzelne Medikament handeln separat produziert. Solche Interaktionen können erweiterte klinische therapeutische Wirksamkeit2führen. Es begrenzt Therapieresistenz, erhöht die Wirksamkeit und Toxizität2auch verringern kann. In der Tat kann die Dosierung der einzelnen Drogen reduziert werden, um ihre Nebenwirkungen zu senken, indem Sie auf verschiedenen Wegen. Darüber hinaus kann eines der Moleküle auch als eine sensibilisierende Mittel gegen Krebszellen dienen. Die Wirkung des zweiten Medikaments kann auf sensibilisierte Zellen verstärkt werden und weniger Dosierungen können gebrauchte5.
Kombinierte Therapie kann zwei oder mehrere Chemotherapeutika und/oder Biologics wie monoklonale Antikörper6enthalten. Diese mAbs gezielt Zellen mit dem Ausdruck einer Zelle Oberflächenantigen von Interesse und sind in der Lage, Tumorzellen durch immunologische Wege einschließlich Antikörper-abhängige zellvermittelte Zytotoxizität (ADCC), töten unter Einbeziehung der immun Effektorzellen 7und Komplement-abhängige Zytotoxizität (CDC)6. Sie können auch über einen nicht-immunologischen Mechanismus vermittelt durch Apoptose8,9,10,11agieren. In diesem Fall kann die Induktion des Prozesses des programmierten Zelltods Krebszellen zu sensibilisieren, Schwächen ihre Funktion und der damit verbundenen Chemotherapeutikum mit einer niedrigeren Dosierung effektiver zu gestalten. Als solche Proapoptotic mAb sind gute Kandidaten für die Gestaltung von Kombination Therapien mit Zytostatika.
Verschiedene mathematische Modelle sind beschrieben worden, um Droge Synergismus zu beurteilen; eine davon basiert auf der Kombination Index Methode1. Diese Methode basiert auf dem Median-Wirkung-Prinzip von Chou1entwickelt. Die Median-Effekt-Gleichung korreliert die Medikamentendosis und Drogenwirkung wie folgt.
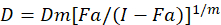
Dabei ist D die Medikamentendosis; DM ist die Median-Effekt-Dosis; FA ist der Bruchteil der Dosis davon betroffen; m ist ein Exponent, die die Form der Dosis-Wirkungs-Plot-1bedeutet. Die Median-Effekt-Dosis wird verwendet, um die Dosis Dx eines Medikaments zu berechnen, die hemmt oder tötet “X” Prozent der Zellen. Der CI-Wert errechnet dann um die additive Wirkung der Droge Kombination,1folgendermaßen zu bewerten.
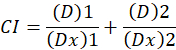
CI der Wert 1 gibt an, eine additive Wirkung und einem CI-Wert von 1 zeigt Antagonismus1. Die Anwendung dieser Methode wird weiter durch die Verfügbarkeit eines Computerprogramms, CompuSyn, die bestimmt Synergismus und Antagonismus bei allen Dosen erleichtert oder Effektstufen simulierte automatisch12.
Unsere Gruppe entwickelt die mAb 8B6 speziell für O-Acetyl-GD2 Gangliosid (OAcGD2) Neuroblastom Antigen13 und weiter gezeigt, dass diese mAb Zelltod mit Attributen der Apoptose11induzieren kann. Um zu testen ob mAb 8B6 Neuroblastom-Zellen, die antineoplastische Agenten Topotecan sensibilisieren können, haben wir die oben genannten Methode, entwickelt von Chou1angepasst. Zunächst bestimmen wir die wirksame Dosis 50 (ED50) Werte der mAb 8B6 und Topotecan. Als nächstes sind die Neuroblastom-Zellen mit zwar Verhältnisse der beiden Wirkstoffe basierend auf ED50 Werte ausgesetzt, um die CI-Werte mit den oben genannten Simulations-Software zu ermitteln. Diese Methode ermöglicht uns, Synergien zwischen mAb 8B6 und Topotecan in Vitrozu demonstrieren. Wir beschreiben Sie anschließend ein Protokoll, um weiter die Wirksamkeit und die Sicherheit dieser Kombination Therapie in Vivozu beurteilen. Dieses Protokoll kann leicht angewendet werden, um starke und sichere Anti-Krebs-mAb und Chemotherapeutikum Kombinationen in präklinischen Studien auszuwählen. Eine schematische Darstellung dieser Studie ist in Abbildung 1zur Verfügung gestellt.
Protocol
Representative Results
Discussion
Um die Auswirkungen von Wechselwirkungen mit anderen Medikamenten vorherzusagen, drei Methoden können verwendet werden: die Isobologram Methodik17, nichtlineare Mischung Modell18und die Kombination index1. Indexanalyse Kombination wird am häufigsten verwendet, da seine Anwendung durch die Verfügbarkeit eines benutzerfreundlichen Computerprogramms vereinfacht wird. Zu diesem Zweck gekennzeichnet wir zuerst die Dosis-Wirkungs-Antwort von jeder Agent…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Unterstützung gewähren: Fondation de Projet de L ‘Université de Nantes, Les Bagouz’ À Manon, La Ligue Contre le Cancer Comité de Loire-Atlantique, Comité du Morbihan und Comité de Vendée, Une rose Gießen S.A.R.A.H, L’Etoile de Martin und la Société Française de Lutte Contre Les Krebsarten et Les Leucémies de l ‘ Enfant et de L’adolescent (SFCE). M.b. und j. F. werden von La Ligue Contre Le Cancer unterstützt. Die Autoren danken die UTE-Anlage von der Struktur Fédérative de Recherche François Bonamy. Die Autoren danken auch Dr. S. Suzin (Inserm, Paris) für die Bereitstellung der IMR5 Zellen und Frau H. Estéphan für ihre technische Unterstützung.
Materials
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
References
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: “Postoperative validation of bone-anchored implants in the single-sided deafness population.” Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. 癌症研究. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. 癌症研究. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).

