Continue bloedafname in kleine dierlijke positron emissie tomografie/computertomografie maakt de meting van de arteriële ingangsfunctie mogelijk
Summary
Hier wordt een protocol voor continue bloed bemonstering tijdens PET/CT-beeldvorming van ratten beschreven om de arteriële invoer functie (AIF) te meten. De catheterisatie, de kalibratie en opzet van het systeem en de gegevensanalyse van de bloed radioactiviteit worden aangetoond. De gegenereerde gegevens bieden invoerparameters voor daaropvolgende bio-kinetische modellering.
Abstract
Voor kwantitatieve analyse en bio-kinetische modellering van positron emissie tomografie/computertomografie (PET/CT) gegevens, is de bepaling van de temporele bloed tijd-activiteit concentratie ook bekend als arteriële input functie (AIF) een belangrijk punt, vooral voor de karakterisering van dierziekte modellen en de introductie van nieuw ontwikkelde radiotracers. De kennis van de beschikbaarheid van radio Tracer in het bloed helpt bij het interpreteren van PET/CT-afgeleide gegevens van weefsel activiteit. Voor dit doel is online bloed bemonstering tijdens de PET/CT-beeldvorming raadzaam om de ABI te meten. In tegenstelling tot handmatige bloedafname en beeld-afgeleide benaderingen, continue online bloed bemonstering heeft verschillende voordelen. Naast het geminimaliseerde bloedverlies is er een verbeterde resolutie en een superieure nauwkeurigheid voor de meting van de bloed activiteit. Het grote nadeel van online bloedafname is echter de kostbare en tijdrovende voorbereiding om de femorale vaten van het dier te CATHETERISEREN. Hier beschrijven we een eenvoudige en complete workflow voor katheterisatie en continue bloed bemonstering tijdens kleine dierlijke PET/CT-beeldvorming en vergeleken deze met handmatige bloed bemonstering en een beeld-afgeleide aanpak. Met behulp van deze zeer gestandaardiseerde workflow wordt de bepaling van de ABI fluorodeoxyglucose ([18F] FDG) aangetoond. Verder kan deze procedure worden toegepast op elke radio Tracer in combinatie met verschillende diermodellen om fundamentele kennis van de Tracer kinetische en model kenmerken te creëren. Dit maakt een nauwkeuriger evaluatie mogelijk van het gedrag van farmaceutische producten, zowel voor diagnostische als therapeutische benaderingen in het preklinisch onderzoek van oncologische, neurodegeneratieve en myocardiale ziekten.
Introduction
Positron emissie tomografie/computertomografie (PET/CT) is een nucleaire beeldvormingstechnologie die visualisatie van metabole processen in het lichaam mogelijk maakt na injectie van een radioactief gelabelde ligand, ook wel Tracer genoemd. Terwijl de ligand een molecuul is dat betrokken is bij een metabolische route of gericht is op celoppervlakte eiwitten, is het radioactieve label een positron-uitstralende radionuclide. Gamma stralen worden indirect uitgestoten door het positron verval en laten de detectie van de verdeling in het organisme met Extracorporale PET detectoren toe. Op deze manier, verschillende cellulaire moleculen kunnen worden gericht: neurotransmitter receptoren en vervoerders, metabole processen zoals glycolyse of mitochondriale eiwitten zoals de trans Locator eiwit 18 kDa (TSPO) om geactiveerde glia cellen te detecteren.
In preklinisch onderzoek is PET/CT een aantrekkelijke methode om biochemische processen in vivo op een niet-invasieve manier te bestuderen, waardoor longitudinale studies mogelijk zijn. PET/CT-gegevens ondersteunen de analyses van ziekte mechanismen, de beoordeling van de kenmerken en farmacokinetiek van nieuwe geneesmiddelen en de validering van zowel huidige als nieuwe radiotracers voor translationeel onderzoek.
Tijdens PET/CT analyses kunnen drie Tracer toestanden worden gedefinieerd (voorbeeld van het 2-weefsel compartiment model): ten eerste, de Tracer stroomt binnen het bloed na de toepassing ervan (toestand 1; conc.[bloed]). Ten tweede, het voert het weefsel via het capillaire bed en kan er ofwel vrij bewegen binnen de extracellulaire ruimte of is niet specifiek gebonden aan diverse cellulaire of extracellulaire structuren (staat 2; conc.[unspec]). Ten derde kan de Tracer specifiek (met of zonder metabole overvulling) worden gebonden aan zijn doel molecuul (staat 3, conc.[spec]). Al deze dynamische processen tussen de compartimenten zijn tot op zekere hoogte bidirectioneel en de diffusie processen worden beschreven door de frequentie constanten (K1, K2, K3 en K4). Terwijl de concentratie van de Tracer in het bloed (dat wil zeggen, staat 1) heet “input”, de concentratie van onspecifiek en specifiek gebonden Tracer (dat wil zeggen, staat 2 en staat 3) heet “output” en kan direct worden afgeleid van het huisdier afbeelding. Deze fysiologische relatie kan worden weergegeven in het 2-weefsel compartiment model (Figuur 1).
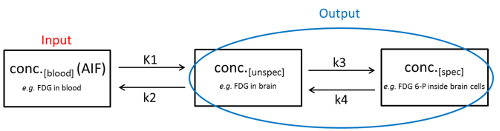
Figuur 1 : Het twee-weefsel compartimentele model. De fysiologische omstandigheden van de drie verschillende Tracer toestanden en de dynamische processen daartussen worden weergegeven. Klik hier om een grotere versie van dit cijfer te bekijken.
In het ideale geval is conc.[spec] evenredig aan de concentratie van het beoogde molecuul. De output van de PET/CT-meting is echter de som van conc.[spec] en conc.[unspec]. Om te bepalen conc.[spec] in het gebied van belang, parallel de conc.[unspec] van een referentiegebied verstoken van het doeleiwit/traject wordt bepaald. Door gebruik te maken van de juiste wiskundige vergelijkingen kan men nu conc.[spec] berekenen, meestal met behulp van het compartiment model (een bio-kinetische modellerings benadering). In veel gevallen is een dergelijk referentiegebied zonder het doeleiwit echter niet beschikbaar1,2. In deze gevallen kan de conc.[Blood] worden gebruikt om conc.[spec]te bepalen. Sinds de conc.[bloed] varieert als gevolg van verschillende lever-en nierklaring, uitscheiding, doorbloeding, verschillende hersen-bloed barrière penetratie en ziekte-gerelateerde factoren3, de huidige gouden standaard is het meten van de conc.[ bloed] parallel met de PET/CT-scan door continue bloed bemonstering. Dit geeft de arteriële input functie (AIF), die wordt gedefinieerd als conc.[bloed] na verloop van tijd4. Van nota, het uitvoeren van continue bloedafname wordt beschouwd als technisch zeer uitdagend, vooral bij kleine dieren zoals ratten of muizen5.
Hier bieden we een eenvoudig en praktisch protocol om continu bloed van ratten te proeven via een Arterioveneuze (a-v) shunt tussen de femorale ader en slagader. Gekoppeld aan een in de handel verkrijgbare detector-pompsysteem, zijn we in staat om een real-time, continue Abi te genereren tijdens Dynamic [18f] fluorodeoxyglucose ([18f] FDG)-PET/CT-scans bij ratten en vergeleken met alternatieve benaderingen. PET/CT beeldvorming werd uitgevoerd in mannelijke Sprague Dawley ratten op een leeftijd van 4 maanden met een gemiddeld gewicht van 462 g ± 33 g (gemiddelde ± standaarddeviatie) met behulp van een multimodaliteit PET/CT scanner.
Aangezien een breed scala aan apparaten wordt gebruikt tijdens de reeks metingen (dosis kalibrator, online bloed sampler, PET/CT en goed teller), is een kwaliteitscontroleprocedure bedoeld als kruis kalibratie nodig om de kwantitatieve nauwkeurigheid van alle systemen te controleren en compenseren voor verschillen. Kruis kalibratie in de context van online bloed bemonstering betekent dat het teltarief voor een bepaalde activiteitsconcentratie gemeten in gecorrigeerde PET-beelden kan worden omgezet in de concentratie gemeten met het twilite-systeem voor dezelfde concentratie. Daarom is een cross kalibratieprocedure tussen PET/CT, bloedbemonsterings systeem en goed teller vastgesteld.
Deze zeer gestandaardiseerde methodologie biedt een krachtige benadering voor het kwantificeren van metabole en cellulaire processen in preklinisch klein dierlijk onderzoek en is een elegante manier om de betrouwbaarheid en reproduceerbaarheid van de ABI te verbeteren. De ABI kan vervolgens worden gebruikt om de specifiek afhankelijke Tracer in weefsel in preklinische PET/CT-gegevens te kwantificeren met behulp van bio-kinetische modellering.
Protocol
Representative Results
Discussion
De gepresenteerde resultaten worden geëxtraheerd uit een grootschalig project over Neuronale activiteit in een transgene diermodel van de ziekte van Huntington in vergelijking met wild type ratten. Totaal 30 transgene en wild type ratten waren katheterized en handmatige en online bloed bemonstering parallel aan [18F] FDG-PET/CT werd uitgevoerd. Drie Abi’s van wild type ratten worden hier getoond om het bereik van mogelijke uitkomsten van het protocol aan te tonen. De resultaten van het volledige project over veranderingen van neuronale activiteit in een diermodel van de ziekte van Huntington zullen elders worden gepubliceerd.
De hier beschreven methode maakt snelle en nauwkeurige continue bloedafname in een grote cohort mogelijk en biedt een gapless ABI voor kinetische modellering van dynamische PET/CT-gegevens in kleine dieren. Er wordt een externe bloedcirculatie gegenereerd om de werkelijke tijd activiteit in het bloed van de dieren te detecteren; Hierdoor wordt een verlies van bloed vermeden. De chirurgische ingreep is gebaseerd op Jespersen et al.8 en werd aangepast om te voldoen aan de behoeften voor arteriële bloed bemonstering tijdens de PET/CT-metingen. Het shunt systeem werd gevalideerd door Weber et al.9. Met de hier gebruikte Setup, een externe bloed volume van ongeveer 1,1 mL loopt door de detector-pompsysteem. Een rat in de leeftijd van 4 maanden heeft een totaal bloed volume van ongeveer 30 mL. De diameter van de dijbeenader en slagader is ongeveer 0.45-0,6 mm10 en moet een beetje gesteven worden om de gebruikte katheter in te voegen.
De ABI kan ook worden gemeten via sporadische handmatige bloedafname of worden gereconstrueerd vanaf vroege tijdpunten van de PET-afbeeldingen zelf (afbeelding-afgeleid). Beide benaderingen werden uitgevoerd met de hier gepresenteerde gegevens en vergeleken met de continue bloedafname.
In vergelijking met handmatige bloedafname, met online bloed bemonstering een merkbare hogere temporele resolutie (hier: 1800 gegevenspunten per 30 min) wordt mogelijk. Handmatige bloed trekkingen (hier: 5 gegevenspunten per 30 min) zijn beperkt tot het bloed volume aanwezig in het kleine dier, omdat deze monsters niet terug in de circulatie van het dier worden gepompt. Bovendien is een maximum interval van 10-15 s technisch uitvoerbaar en wordt belangrijke informatie voor kinetische modellering gemist. Dit kan ook worden gezien in de gepresenteerde gegevens, als een verschil in het gedetecteerde maximum van continue en handmatige bloedafname is duidelijk (Figuur 3a, C, E). Bij online bloed bemonstering was de gedetecteerde piek hoger dan bij de input functie van de afbeelding van de oplopende aorta11 (Figuur 3B, D, F). De imaged input-functie is beperkt tot de ruimtelijke resolutie van PET-scanners, wat resulteert in gedeeltelijke volume-effecten12 en wordt beïnvloed door de gereconstrueerde tijdframes.
Een algemeen voordeel van deze continue bloedbemonsterings procedure is dat de Tracer kan worden aangebracht via de katheter, die minder vatbaar is voor verstoring dan injectie via de laterale staart ader. Houd er rekening mee dat de Tracer in een gematigd volume moet worden aangebracht om te voorkomen dat de Tracer in het begin van het buis systeem blijft. Om ervoor te zorgen dat er geen activiteit overblijft in het dode volume van het T-stuk, wordt het daarna gespoeld met een gehepariniseerde zoutoplossing. Bovendien wordt het gebruik van een infusiepomp geadviseerd omdat hiermee de snelheid van de Tracer injectie kan worden aangepast en kunnen bijdragen tot een meer gecoördineerde verwerving van de maximale radioactiviteitspiek met handmatige bloedafname13.
Er zijn een aantal mogelijke problemen die kunnen optreden tijdens het verwerken van het protocol en kunnen worden afgehandeld door de volgende probleemoplossing. Een suboptimale positie van de katheters kan leiden tot een onvolledige uitvoering van het Protocol, dus zorg ervoor dat ze nauwkeurig zijn bevestigd met de proximale hechting en dat de katheter 2-3 cm proximale in het vat wordt geduwd. Daarnaast kan fibrinelijm worden gebruikt. Ook de vorming van trombi kan de katheters verstoppen. Dit kan worden aangepakt door het verhogen van de heparine concentratie en daaropvolgende Flushing van de katheters of het buis systeem. Een dergelijke suboptimale uitkomst als gevolg van verstopping van de katheters wordt getoond in de resultaten, de maximale piek wordt gemist (Figuur 3E). Een ander kritisch punt met betrekking tot de bescherming van dieren en welzijn is de lengte van de Extracorporale bloedstroom. Daarom wordt voorgesteld om de lengte van het buis systeem tot een minimum te beperken.
Wanneer bloed bemonstering wordt uitgevoerd, moet rekening worden gehouden met drie correcties van de resulterende Abi. Eerste, plasma correctie. Tracers equilibreren tussen plasma en bloedcellen, voornamelijk erytrocyten. Afhankelijk van hoe snel deze diffusie processen zijn, is de beschikbare Tracer voornamelijk aanwezig in plasma. Voor sommige tracers, de verhouding van plasma tot volbloed moet worden overwogen, zoals meer lipofiele degenen. In deze gevallen moet de plasma activiteit worden bepaald. Als [18f] FDG wordt gebruikt, is het niet nodig om het bloed te centrifugeren om de plasma activiteit te bepalen, omdat het zeer snel tussen plasma en rode bloedcellen en de beschikbaarheid van [18f] FDG in plasma is vergelijkbaar met die in het hele bloed. Ten tweede, metaboliet correctie. Veel tracers worden gemetaboliseerd in volbloed en sommige van deze metabolieten zijn nog steeds radioactief gelabeld14. Deze breuk is aanwezig in de ABI, maar is niet beschikbaar voor weefsel opname. Voor sommige tracers moeten metabolieten in volbloed of plasma worden bepaald en moet de ABI worden gecorrigeerd. Ten derde, dispersie correctie. Dispersie wordt veroorzaakt door verschillende factoren, waaronder (a) het systematische tijdsverschil tussen de indicatoraankomst tijden in het weefsel ten opzichte van de perifere bemonsteringsplaats (delay-correctie) en (b) en het uitsmeren van de vorm van de ABI, aangezien het Tracer transport binnen het buis systeem wordt beïnvloed door de eerste orde lag (PT1) kinetiek. Er zijn verschillende correcties op basis van deconvolutie voorgesteld, voornamelijk gebaseerd op het model van iida et al.15, maar de meesten zijn vatbaar voor lawaai. Een correctiemethode die deconvolutie omzeilt en daardoor minder vatbaar is voor lawaai, is voorgesteld door Munk et al.16. De noodzakelijke metingen om de correctie parameters te schatten moeten worden uitgevoerd voor elke combinatie van slang en Tracer gebruikt. Dispersie correctie moet worden uitgevoerd voordat de correctie van de tijdvertraging17. Echter, voornamelijk snelle weefsel perfusie processen worden beïnvloed door dispersie en het is ook aangetoond, dat voor modellering van [18F] FDG studies een dispersie correctie is niet absoluut noodzakelijk18. Daarom is in de gepresenteerde voorbeelden de dispersie correctie van de ABI niet toegepast.
Een juiste kalibratie van de dosis kalibrator op locatie en de regelmatige kwaliteitscontrole is een voorwaarde voor het type cross kalibratieprocedures dat hier wordt gepresenteerd. Als de activiteit die aan het dier wordt toegediend echter met dezelfde dosis kalibrator wordt gemeten, wordt elke afwijking in nauwkeurigheid geannuleerd, op voorwaarde dat de afwijking constant is en de volledige procedure voor cross kalibratie is gevolgd, inclusief nuclide-specifieke correcties (bijvoorbeeld voor wisselende halfwaardetijd of verschillende vertakkings ratio). Met behulp van een dergelijke kalibratieprocedure voor het harmoniseren van PET/CT-systemen die worden gebruikt in de menselijke gezondheidszorg en het onderzoek, kan een nauwkeurigheid van ten minste 5-10% worden bereikt19,20.
De geijkte en gecorrigeerde Abi’s die door de succesvolle uitvoering van dit protocol worden gegenereerd, maken het mogelijk PET/CT-gegevens te kwantificeren voor de karakterisering van dierziekte modellen, het testen van nieuwe behandelingsopties, de oprichting van nieuwe tracers en het overdragen van bestaande tracers in een andere soort. Schijnbaar, continue bloedafname in [18] FDG-PET/CT bij ratten levert de meest betrouwbare informatie voor de berekening van de input in bio-kinetische modellering. Door rekening te houden met de individuele stofwisseling, met name de klaring van de lever, is een nauwkeuriger beoordeling van de relevante pathologische of therapeutische effecten mogelijk. Met dit haalbare protocol is een hogere efficiëntie van preklinische PET/CT-gegevensanalyse eenvoudig uitvoerbaar.
Disclosures
The authors have nothing to disclose.
Acknowledgements
De auteurs erkennen met name Susann Lehmann, Iloana Klamfuß en Petra Wolff voor dieren huis en verzorging en Matthias Wyss voor ondersteuning bij het opzetten van het online bloedbemonsterings systeem. De kleine dieren PET/CT werd gefinancierd door de Deutsche Forschungsgemeinschaft (INST 2268/6-1 FUGG).
Materials
| Sugery for arteriovenous shunt | |||
| anesthesia station | Groppler | ||
| aneurysm clips | Aesculap | FT190T | 5 mm, closing force 70 g |
| bulldog clamp | Aesculap | 35 mm | |
| dissectiong scissors BC165 | Aesculap | 490-866 | dull, for skin preparation |
| heating mat | |||
| insulin syringe | Braun | 30G | |
| needle holder | medicon | 11.62.18 | micro surgical |
| pliers for aneurysm clips | Aesculap | FT 470T | Yasargil |
| portex fine bore polythene tubing | Smith Medical | 800/100/200 | ID 0.58 mm, OD 0.96 mm; PE50 equivalent tubing |
| surgical microscope with camera | Leica | M50 + MC120 HD | |
| suture filaments 6.0 | 6.0, polypropylene | ||
| suture filaments 3.0 | 3.0, absorbable, braided | ||
| two anatomical forceps | Hammacher Soling | HSC601-11 | micro surgery, 45° |
| vascular or corneal scissors | Geuder | G19605 | micro surgery scissors |
| PET/CT imaging | |||
| dose calibrator ISOMED 2010 | nivia instruments GmbH | for tracer portioning | |
| Inveon PET/CT | Siemens | ||
| tracer (e.g. 18F-FDG) | |||
| manuel bloodsampling | |||
| capillary blood collection EDTA tube | KABE Labortechnik GmbH | GK 150 EDTA 200 µl | |
| test tubes | SARSTEDT | 5 ml, 75 x 12 mm, PS | |
| well counter CAPTUS 700t | Capintec | manuel measurement of blood activity | |
| automatic blood sampling | |||
| BD Venflon TM pro safety shielded IV catheter; 18 G (1.3 mm x 32 mm) | BD | 3932269 | luer connections (to fit in t-connections) |
| bloodsampler twilite two | swisstrace GmbH | ||
| combi stopper | Braun | 4495101 | |
| heparin | 50U/ml for tube flushing before the experiment and aspiration during catheter surgery | ||
| hypodermic needle | G23 x 1 1/4" / 0.6 x 30 mm | ||
| microprocessor controlled tubing pump | Ismatec/Cole-Parmer | ISM596 | 12 rollers, 2 channels |
| PSAMPLE modul of PMOD | PMOD | ||
| reduction connectors | Ismatec/Cole-Parmer | ISM569A | from ID 2.5 mm to ID 1.5 mm |
| silicone pump tubes | Ismatec/Cole-Parmer | 070535-17-ND /SC0065N | for roller pump (yellow/blue/yellow ID 1.52 mm, WT 0.84 mm, OD 3.2 mm) |
| silicone pump tubes – adapter tubing | Ismatec/Cole-Parmer | SC 0107 | black/black/black ID 0.76 mm, WT 0.86 mm, OD: 2.48 mm |
| t-piece or t-connections | Ismatec/Cole-Parmer | ISM 693A | ID 2.5 mm |
References
- Schain, M., et al. Arterial input function derived from pairwise correlations between PET-image voxels. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism. 33 (7), 1058-1065 (2013).
- Schain, M., Zanderigo, F., Mann, J. J., Ogden, R. T. Estimation of the binding potential BPND without a reference region or blood samples for brain PET studies. NeuroImage. 146, 121-131 (2017).
- Bentourkia, M. Determination of the Input Function at the Entry of the Tissue of Interest and Its Impact on PET Kinetic Modeling Parameters. Molecular Imaging and Biology. 17 (6), 748-756 (2015).
- Phelps, M. E. . PET. , (2004).
- Laforest, R., et al. Measurement of input functions in rodents: challenges and solutions. Nuclear Medicine and Biology. 32 (7), 679-685 (2005).
- Napieczynska, H., et al. Impact of the Arterial Input Function Recording Method on Kinetic Parameters in Small-Animal PET. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 59 (7), 1159-1164 (2018).
- Sijbesma, J. W. A., et al. Novel Approach to Repeated Arterial Blood Sampling in Small Animal PET: Application in a Test-Retest Study with the Adenosine A1 Receptor Ligand [(11)C]MPDX. Molecular Imaging and Biology: MIB: the Official Publication of the Academy of Molecular Imaging. 18 (5), 715-723 (2016).
- Jespersen, B., Knupp, L., Northcott, C. A. Femoral arterial and venous catheterization for blood sampling, drug administration and conscious blood pressure and heart rate measurements. Journal of Visualized Experiments. (59), e3496 (2012).
- Weber, B., Burger, C., Biro, P., Buck, A. A femoral arteriovenous shunt facilitates arterial whole blood sampling in animals. European Journal of Nuclear Medicine and Molecular Imaging. 29 (3), 319-323 (2002).
- Liu, H. -. L. Microvascular anastomosis of submillimeter vessels-a training model in rats. Journal of Hand and Microsurgery. 5 (1), 14-17 (2013).
- van der Weerdt, A. P., et al. Image-derived input functions for determination of MRGlu in cardiac (18)F-FDG PET scans. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 42 (18), 1622-1629 (2001).
- Alf, M. F., et al. Quantification of brain glucose metabolism by 18F-FDG PET with real-time arterial and image-derived input function in mice. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 54 (1), 132-138 (2013).
- Eriksson, O., et al. A computerized infusion pump for control of tissue tracer concentration during positron emission tomography in vivo pharmacokinetic/pharmacodynamic measurements. BMC Medical Physics. 8, 2 (2008).
- Burger, C., Buck, A. Tracer kinetic modelling of receptor data with mathematical metabolite correction. European Journal of Nuclear Medicine. 23 (5), 539-545 (1996).
- Iida, H., et al. Error analysis of a quantitative cerebral blood flow measurement using H2(15)O autoradiography and positron emission tomography, with respect to the dispersion of the input function. Journal of Cerebral Blood Flow and Metabolism: Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 6 (5), 536-545 (1986).
- Munk, O. L., Keiding, S., Bass, L. A method to estimate dispersion in sampling catheters and to calculate dispersion-free blood time-activity curves. Medical Physics. 35 (8), 3471-3481 (2008).
- Meyer, E. Simultaneous correction for tracer arrival delay and dispersion in CBF measurements by the H215O autoradiographic method and dynamic PET. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 30 (6), 1069-1078 (1989).
- Lanz, B., Poitry-Yamate, C., Gruetter, R. Image-derived input function from the vena cava for 18F-FDG PET studies in rats and mice. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 55 (8), 1380-1388 (2014).
- Geworski, L., et al. Multicenter comparison of calibration and cross calibration of PET scanners. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 43 (5), 635-639 (2002).
- Boellaard, R. Standards for PET image acquisition and quantitative data analysis. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 50, 11-20 (2009).

