דגימת דם רציפה בפליטת פוזיטרון של בעלי חיים קטנים טומוגרפיה ממוחשבת/טומוגרפיה ממוחשבת מאפשרת את המדידה של פונקציית הקלט העורקי
Summary
כאן פרוטוקול לדגימת דם רציפה במהלך הדמיה PET/CT של חולדות כדי למדוד את פונקציית קלט העורקים (AIF) מתוארת. הצנתור, הכיול והכיוונון של המערכת וניתוח הנתונים של הרדיואקטיביות בדם מומחש. הנתונים שנוצרו מספקים פרמטרי קלט למידול ביו-קינטי הבאים.
Abstract
עבור ניתוח כמותי ומידול ביו קינטי של פליטת פוזיטרונים טומוגרפיה/טומוגרפיה ממוחשבת (PET/CT) נתונים, קביעת הזמן דם זמני ריכוז המכונה גם פונקציית קלט עורקים (AIF) היא נקודת מפתח, במיוחד לאפיון מודלים של מחלות בעלי חיים והקדמה של רדיומשדרים חדשים שפותחו. הידע של זמינות רדיומעקב בדם מסייע לפרש נתונים הנגזרים מPET/CT של פעילות רקמות. למטרה זו, דגימת דם מקוונת במהלך הדימות PET/CT מומלץ למדוד את AIF. בניגוד לדגימת דם ידנית וגישות שנגזרות מתמונה, דגימת דם רציפה מקוונת מהווה מספר יתרונות. מלבד אובדן הדם הממוזער, קיימת רזולוציה משופרת ודיוק מעולה למדידת פעילות הדם. עם זאת, החיסרון העיקרי של דגימת דם מקוונת היא ההכנה היקרה וגוזלת הזמן לצנתור כלי הירך של החיה. כאן, אנו מתארים זרימת עבודה קלה ומלאה עבור צנתור ודגימת דם רציפה במהלך הדמיה של בעלי חיים קטנים/CT והשוותה לדגימת דם ידנית וגישה הנגזרת מהתמונה. באמצעות זרימת עבודה זו מאוד סטנדרטית, את ההגדרה של הגלוקוז פלואורודיט ([18F] fdg) AIF מומחש. יתר על כן, הליך זה ניתן להחיל על כל מעקב רדיומשולב עם מודלים בעלי חיים שונים כדי ליצור ידע בסיסי של מעקב מאפיינים קינטי ודגם. הדבר מאפשר הערכה מדויקת יותר של התנהגות התרופות, הן עבור גישות אבחוניות וטיפוליות במחקר טרום-קליני של מחלות אונלוגיות, ניווניות ושריר הלב.
Introduction
טומוגרפיה של פליטת פוזיטרון/טומוגרפיה ממוחשבת (PET/CT) היא טכנולוגיית הדמיה גרעינית המאפשרת ויזואליזציה של תהליכים מטבוליים בגוף לאחר ההזרקה של ligand המסומנים באופן פעיל, נקרא גם מעקב. בעוד ליגנד הוא מולקולה כי הוא מעורב מסלול מטבולית או מטרות משטח התאים חלבונים, התווית הרדיואקטיבית הוא מכשיר פוזיטרונים-פליטת-בסיס. קרני גמא הם הנפלטים בעקיפין על ידי הריקבון פוזיטרונים ולאפשר זיהוי של התפלגות שלה באורגניזם עם גלאים לחיות מחמד. בדרך זו, מולקולות הסלולר שונים יכולים להיות ממוקד: קולטני נוירוטרנסמיטר ומובילי, תהליכים מטבוליים כמו גליקוליזיס או חלבונים מיטוכונדריאלי כמו חלבון translocator 18 kDa (TSPO) כדי לזהות תאים מופעלים גליה.
במחקר טרום קליני, PET/CT היא שיטה אטרקטיבית ללמוד תהליכים ביוכימיים בצורה לא פולשנית ב vivo, ובכך מאפשר לימודי האורך. הנתונים של PET/CT תומכים בניתוח של מנגנוני מחלות, הערכת המאפיינים והפרמקוקינטיקה של תרופות חדשות והאימות של הן, הרדיו העדכני והחדשני לחקר הטרנסלטיטיות.
במהלך ניתוח PET/CT שלושה מצבי מעקב יכול להיות מוגדר (דוגמה של 2-רקמת תא דגם): ראשית, המעקב זורם בתוך הדם לאחר היישום שלה (המדינה 1; conc.[דם]). שנית, הוא נכנס לרקמה באמצעות מיטת נימי והוא יכול לנוע בחופשיות בתוך החלל החילוץ או אינו מאוגד במפורש מבנים סלולריים או בעלי מבנה מגוונים (המדינה 2; conc.[unspecifically]). שלישית, מכשיר המעקב יכול להיות מאוגד במיוחד (עם או בלי השמנה מטבולית) למולקולה היעד שלה (המדינה 3, conc.[spec]). כל התהליכים הדינמיים הללו בין התאים הם במידה מסוימת דו-כיווניים ותהליכי הדיפוזיה מתוארים באמצעות קבועי תעריפים (K1, k2, k3 וk4). בעוד הריכוז של המעקב בדם (כלומר, מצב 1) נקרא “קלט”, את הריכוז של מעקב בלתי ספציפי ומאוגד במיוחד (כלומר, מדינה 2 ומדינה 3) נקרא “פלט” והוא יכול להיות נגזר ישירות מהתמונה PET. ניתן להציג יחס פיזיולוגי זה בדגם של 2 הרקמה (איור 1).
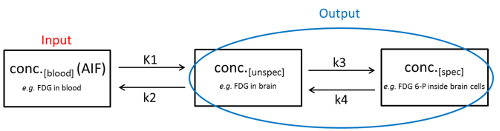
איור 1 : הדגם compartmental שתי הרקמה. התנאים הפיזיולוגיים של שלושת מצבי המעקב השונים והתהליכים הדינמיים ביניהם מוצגים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
במקרה האידיאלי, conc.[spec] הוא פרופורציונלי לריכוז של מולקולת היעד שלה. עם זאת, את התפוקה של מדידת PET/CT הוא סכום של conc.[spec] ו conc.[unspec]. כדי לקבוע conc.[spec] באזור העניין, במקביל את conc.[unspec] של אזור התייחסות נטול חלבון/מסלול היעד נקבע. באמצעות משוואות מתמטיות המתאימות ניתן כעת לחשב conc.[spec], הנפוץ ביותר באמצעות מודל התא (גישה מידול ביו קינטי). עם זאת, במקרים רבים, כגון אזור התייחסות נטול חלבון היעד אינו זמין1,2. במקרים אלה, ניתן להשתמש ב-conc. [דם] כדי לקבוע conc.[spec]. מאז הconc.[דם] הוא משתנה בשל כבד שונים הסיווג כליה, הפרשה, זרימת הדם, המוח שונים דם חדירה מכשול וגורמים הקשורים למחלות3, תקן הזהב הנוכחי הוא למדוד את conc.[ דם] במקביל לסריקת PET/CT על ידי דגימת דם רציפה. פעולה זו מעניקה את פונקציית הקלט העורקי (AIF), המוגדרת כ-conc.[דם] במשך הזמן4. של הערה, ביצוע דגימת דם רציפה נחשב מאוד מאתגר, במיוחד בבעלי חיים קטנים כגון חולדות או עכברים5.
כאן, אנו מספקים פרוטוקול קל ומעשי כדי לדגום ברציפות דם מחולדות באמצעות בריאוורידים (a-v) המחלף בין וריד הירך העורק. ביחד למערכת משאבת הזיהוי הזמין מסחרית, אנו מסוגלים לייצר AIF בזמן אמת, מתמשך במהלך דינמי [18F] fluorאודאוקסיטימסוכר ([18f] FDG)-PET/CT סריקות בחולדות והשוותה לגישות חלופיות. PET/CT הדמיה בוצעה ב הגברי הג מלבין חולדות בגיל 4 חודשים עם משקל ממוצע של 462 g ± 33 g (ממוצע ± סטנדרטי סטיית) באמצעות סורק PET/CT רב מודאליות.
מאז מגוון רחב של התקנים משמש במהלך סדרה של מדידות (מינון המינון, באינטרנט דוגם דם, PET/CT, וכן מונה), הליך בקרת איכות המכונה כיול הצלב נדרש כדי לבדוק את הדיוק הכמותי של כל המערכות ל פיצוי על הבדלים. כיול צולב בהקשר של דגימת דם מקוונת פירושו ששיעור הספירה עבור ריכוז של פעילות נתונה נמדד בתמונות PET מתוקנות ניתן להמיר לריכוז נמדד עם מערכת twilite לאותו ריכוז. לכן, הליך כיול צולב בין PET/CT, מערכת דגימת דם, ומונה היטב הוקם.
מתודולוגיה זו מאוד סטנדרטית מספקת גישה רבת עוצמה כדי לכמת תהליכים מטבוליים וסלולריים במחקר בעלי חיים קטנים מראש והוא דרך אלגנטית כדי לשפר את האמינות והתוכנות של AIF. ניתן להשתמש ב-AIF כדי לכמת את המעקב המאוגד הספציפי ברקמות בנתוני PET/CT באמצעות מידול ביו-קינטי.
Protocol
Representative Results
Discussion
התוצאות המוצגות מופקים מפרוייקט בקנה מידה גדול יותר על פעילות עצבית במודל חיות טרנסגניים של מחלת הנטינגטון בהשוואה לחולדות מסוג wildtype. בסך הכל 30 חולדות טרנסגניים ומסוג ווילטיפ היו צנתור ובדיקת דם ידנית ומקוונת במקביל [18F] fdg-PET/CT בוצע. שלושה AIFs של חולדות wildtype מוצגים כאן כדי להדגים את טווח התוצאות האפשריות של הפרוטוקול. התוצאות של הפרויקט המלא על שינויים של פעילות עצבית במודל החי של מחלת הנטינגטון יפורסמו במקום אחר.
השיטה המתוארת כאן מאפשרת דגימת דם רציפה מהירה ומדויקת בקבוצה גדולה ומספקת AIF שוטפת למידול קינטי של נתוני PET/CT דינמיים בבעלי חיים קטנים. זרימת דם חיצונית נוצרת כדי לזהות פעילות זמן בפועל בדם של בעלי החיים; עקב כך נמנע אובדן דם. ההליך הכירורגי מבוסס על Jespersen ואח ‘8 והוא השתנה כדי לענות על הצרכים של דגימת דם עורקים במהלך מדידות PET/CT. מערכת הדלף אומתה על ידי וובר ואח ‘9. עם ההתקנה השתמשו כאן, נפח דם חיצוני של כ 1.1 mL פועל באמצעות מערכת משאבת גלאי. חולדה בגיל 4 חודשים יש נפח דם מוחלט של כ 30 מ ל. קוטרו של וריד הירך עורק הוא כ 0.45-0.6 מ”מ10 והוא צריך להיות קצת כוכבים כדי להכניס את הקטטר בשימוש.
AIF יכול גם להיות נמדד באמצעות איסוף דם ידני או להיות משוחזר מנקודות הזמן המוקדמות של תמונות PET עצמו (התמונה נגזר). שתי הגישות בוצעו עם הנתונים המוצגים ולעומת דגימת הדם הרציפה.
בהשוואה לדגימת דם ידנית, עם דגימת דם מקוונת ברזולוציה הטמפורלית הגבוהה יותר מורגש (כאן: 1800 נקודות נתונים לכל 30 דקות) הופכת לאפשרית. דם ידני מושך (כאן: 5 נקודות נתונים לכל 30 דקות) מוגבלים לנפח הדם הקיים בבעל החיים הקטנים, כמו דגימות אלה אינם נשאבים בחזרה למחזור החיים של החיה. יתר על כן, מרווח מרבי של 10-15 s הוא מבחינה טכנית ומידע חשוב עבור מידול קינטי הוא החמיץ. זה יכול להיות גם ניתן לראות את הנתונים המוצגים, כהבדל של המרבי שאותרו דגימת דם רציפה וידנית הוא ברור (איור 3a, C, E). עם דגימת דם באינטרנט השיא שאותרו היה גבוה יותר מאשר עם פונקציית הקלט הנגזר התמונה של אב העורקים העולה11 (איור 3B, D, F). פונקציית הקלט הנגזרת מהדימות מוגבלת לרזולוציה המרחבית של סורקי PET שתוצאתה אפקטים חלקיים של אמצעי האחסון12 והיא מושפעת ממסגרות הזמן המשובלות.
יתרון כללי של הליך זה דגימת דם רציפה היא כי ניתן להחיל את המעקב דרך הקטטר, אשר נוטה פחות להפרעה מאשר הזרקה דרך הווריד זנב לרוחב. יש לשים לב שמעקב צריך להיות מיושם באמצעי אחסון מתון כדי למנוע מנותב להישאר בתחילת מערכת הצינורות. כדי להבטיח ששום פעילות לא נותרה בנפח המת של ה-T-piece, היא מסמיקה עם הפתרון התמיסת מלח heparinized לאחר מכן. יתר על כן, השימוש של משאבת אינפוזיה מומלץ כפי שהוא מאפשר התאמה של מהירות הזרקת מעקב והוא יכול לתרום לרכישה מתואמת יותר של הפסגה מקסימלית רדיואקטיביות עם דגימת דם ידנית13.
קיימים מספר קשיים אפשריים העלולים להתרחש במהלך עיבוד פרוטוקול וניתן לטפל בהם באמצעות פתרון הבעיות הבא. מיקום תת-אופטימלי של הקטטרים עשוי להוביל לביצוע לא שלם של הפרוטוקול, ולכן להבטיח כי הם קבועים במדויק עם התפר האבובית והקטטר הוא דחף 2-3 ס מ האבובית לתוך כלי הקיבול. בנוסף, ניתן להשתמש בדבק פיאין. כמו כן, היווצרות התרובי יכול לסתום את הקטטרים. זה יכול להיות מטופל על ידי הגדלת ריכוז הפארין והשטיפה הבאה של הקטטרים או מערכת הצינורית. תוצאה תת-אופטימלית כזו עקב סתימת הקטטרים מוצגת בתוצאות, השיא המקסימלי הוא החמיץ (איור 3E). נקודה קריטית נוספת בדבר הגנה על בעלי חיים ורווחה היא אורך זרימת הדם המוחדעת. לכן הוא הציע להקטין את אורך מערכת הצינורית למינימום.
כאשר מבוצע דגימת דם, יש לקחת בחשבון שלוש תיקונים של AIF שהתקבל. . קודם כל, תיקון פלזמה . בעיקר אריתרופוציטים בהתאם למהירות של תהליכי דיפוזיה אלה, המעקב הזמין נמצא בעיקר בפלזמה. עבור מראות מסוימים, היחס של פלזמה כדי דם שלם צריך להיחשב, כגון ליפופילית יותר. במקרים אלה, פעילות הפלזמה חייבת להיקבע. אם [18f] fdg משמש, אין צורך לצנטריפוגה את הדם כדי לקבוע את פעילות הפלזמה, כפי שהוא מדגיש מאוד מהר בין פלזמה וכדוריות הדם האדומות ואת הזמינות של [18f] fdg ב פלזמה דומה לזה בדם כולו. שנית, תיקון מטבוליט. מנותבים רבים הם מטבוליזם בדם שלם וחלק מטבוליטים אלה עדיין רדיואקטיבי מתויג14. שבר זה קיים ב-AIF אך אינו זמין לספיגת רקמות. עבור כמה מנותבים מטבוליטים צריך להיקבע בדם או פלזמה שלם ו-AIF צריך לתקן. שלישית, תיקון נפיצה. פיזור נגרמת על ידי מספר גורמים, כולל (א) הפרש זמן שיטתי בין זמני הגעה מעקב ברקמה ביחס לאתר הדגימה ההיקפית (תיקון עיכוב) ו (ב) ואת הכהיית של הצורה של AIF, כמו הובלה מעקב בתוך מערכת הצינור מושפע להשהיה הראשונה הסדר (PT1) קינטיקה. כמה תיקונים המבוססים על פירוק הוצעו, בעיקר מבוסס על המודל על ידי Iida ואח ‘15, אבל רובם רגישים לרעש. שיטת תיקון המהווה הרחבה ולכן היא נוטה פחות לרעש, הוצע על-ידי מונק ואח ‘16. המדידות הדרושות כדי להעריך את פרמטרי תיקון יש לבצע עבור כל שילוב של אבובים ומעקב בשימוש. תיקון נפיצה יש לעשות לפני תיקון זמן ההשהיה17. עם זאת, בעיקר תהליכים מהירים של רקמות העור מושפעים פיזור וזה הוכח גם, כי מידול של [18F] מחקרים fdg תיקון פיזור אינו הכרחי לחלוטין18. לכן, בדוגמאות שהוצגו, תיקון הפיזור של AIF לא הוחל.
כיול נאות של המינון באתר ובקרת האיכות הקבועה שלה הוא תנאי מוקדם לסוג הליכי הכיול הצולבים המוצגים כאן. עם זאת, אם הפעילות הניתנת לבעלי החיים נמדדת במינון זהה, כל סטייה בדיוק תבוטל, בתנאי שהסטייה תהיה קבועה וההליך המלא של כיול הצולב הסתיים, כולל nuclide-תיקונים ספציפיים (למשל, עבור שונים מחצית חיים או יחס הסתעפות שונים). באמצעות נוהל כיול כזה עבור הרמוניה מערכות PET/CT המשמשים בטיפול בריאות האדם ומחקר, דיוק של לפחות 5-10% יכול להיות מושגת19,20.
ה-aifs המכוילים והמתוקן שנוצר על-ידי יישום מוצלח של פרוטוקול זה מאפשרים כימות של נתוני PET/CT לאפיון מודלים של מחלות בעלי חיים, בדיקות של אפשרויות טיפול חדשות, הקמת מדפים חדשים והעברת מ מנותבים קיימים למין אחר. לכאורה, בדיקת דם רציפה ב [18] fdg-PET/CT בחולדות מספק את המידע האמין ביותר עבור חישוב הקלט במידול ביו קינטי. על-ידי לקיחת בחשבון את חילוף החומרים הפרטני, במיוחד סיווג הכבד, הערכה מדויקת יותר של ההשפעות הפתולוגית או הרפואית הרלוונטית אפשרית. עם פרוטוקול זה מעשית, יעילות גבוהה יותר של ניתוח נתונים מראש לחיות מחמד/CT ניתן ליישום בקלות.
Disclosures
The authors have nothing to disclose.
Acknowledgements
המחברים בהכרת תודה לסוזן להמן, ולגבי פטרה וולף לדיור ולטיפול בעלי חיים ומתיאס וילי לתמיכה במהלך הקמת מערכת דגימת הדם המקוונת. חיית המחמד הקטנה בעלי חיים/CT מומן על ידי הגרמני Forsch, מוגמססביסםירכתיים (INST 2268/6-1 FUGG).
Materials
| Sugery for arteriovenous shunt | |||
| anesthesia station | Groppler | ||
| aneurysm clips | Aesculap | FT190T | 5 mm, closing force 70 g |
| bulldog clamp | Aesculap | 35 mm | |
| dissectiong scissors BC165 | Aesculap | 490-866 | dull, for skin preparation |
| heating mat | |||
| insulin syringe | Braun | 30G | |
| needle holder | medicon | 11.62.18 | micro surgical |
| pliers for aneurysm clips | Aesculap | FT 470T | Yasargil |
| portex fine bore polythene tubing | Smith Medical | 800/100/200 | ID 0.58 mm, OD 0.96 mm; PE50 equivalent tubing |
| surgical microscope with camera | Leica | M50 + MC120 HD | |
| suture filaments 6.0 | 6.0, polypropylene | ||
| suture filaments 3.0 | 3.0, absorbable, braided | ||
| two anatomical forceps | Hammacher Soling | HSC601-11 | micro surgery, 45° |
| vascular or corneal scissors | Geuder | G19605 | micro surgery scissors |
| PET/CT imaging | |||
| dose calibrator ISOMED 2010 | nivia instruments GmbH | for tracer portioning | |
| Inveon PET/CT | Siemens | ||
| tracer (e.g. 18F-FDG) | |||
| manuel bloodsampling | |||
| capillary blood collection EDTA tube | KABE Labortechnik GmbH | GK 150 EDTA 200 µl | |
| test tubes | SARSTEDT | 5 ml, 75 x 12 mm, PS | |
| well counter CAPTUS 700t | Capintec | manuel measurement of blood activity | |
| automatic blood sampling | |||
| BD Venflon TM pro safety shielded IV catheter; 18 G (1.3 mm x 32 mm) | BD | 3932269 | luer connections (to fit in t-connections) |
| bloodsampler twilite two | swisstrace GmbH | ||
| combi stopper | Braun | 4495101 | |
| heparin | 50U/ml for tube flushing before the experiment and aspiration during catheter surgery | ||
| hypodermic needle | G23 x 1 1/4" / 0.6 x 30 mm | ||
| microprocessor controlled tubing pump | Ismatec/Cole-Parmer | ISM596 | 12 rollers, 2 channels |
| PSAMPLE modul of PMOD | PMOD | ||
| reduction connectors | Ismatec/Cole-Parmer | ISM569A | from ID 2.5 mm to ID 1.5 mm |
| silicone pump tubes | Ismatec/Cole-Parmer | 070535-17-ND /SC0065N | for roller pump (yellow/blue/yellow ID 1.52 mm, WT 0.84 mm, OD 3.2 mm) |
| silicone pump tubes – adapter tubing | Ismatec/Cole-Parmer | SC 0107 | black/black/black ID 0.76 mm, WT 0.86 mm, OD: 2.48 mm |
| t-piece or t-connections | Ismatec/Cole-Parmer | ISM 693A | ID 2.5 mm |
References
- Schain, M., et al. Arterial input function derived from pairwise correlations between PET-image voxels. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism. 33 (7), 1058-1065 (2013).
- Schain, M., Zanderigo, F., Mann, J. J., Ogden, R. T. Estimation of the binding potential BPND without a reference region or blood samples for brain PET studies. NeuroImage. 146, 121-131 (2017).
- Bentourkia, M. Determination of the Input Function at the Entry of the Tissue of Interest and Its Impact on PET Kinetic Modeling Parameters. Molecular Imaging and Biology. 17 (6), 748-756 (2015).
- Phelps, M. E. . PET. , (2004).
- Laforest, R., et al. Measurement of input functions in rodents: challenges and solutions. Nuclear Medicine and Biology. 32 (7), 679-685 (2005).
- Napieczynska, H., et al. Impact of the Arterial Input Function Recording Method on Kinetic Parameters in Small-Animal PET. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 59 (7), 1159-1164 (2018).
- Sijbesma, J. W. A., et al. Novel Approach to Repeated Arterial Blood Sampling in Small Animal PET: Application in a Test-Retest Study with the Adenosine A1 Receptor Ligand [(11)C]MPDX. Molecular Imaging and Biology: MIB: the Official Publication of the Academy of Molecular Imaging. 18 (5), 715-723 (2016).
- Jespersen, B., Knupp, L., Northcott, C. A. Femoral arterial and venous catheterization for blood sampling, drug administration and conscious blood pressure and heart rate measurements. Journal of Visualized Experiments. (59), e3496 (2012).
- Weber, B., Burger, C., Biro, P., Buck, A. A femoral arteriovenous shunt facilitates arterial whole blood sampling in animals. European Journal of Nuclear Medicine and Molecular Imaging. 29 (3), 319-323 (2002).
- Liu, H. -. L. Microvascular anastomosis of submillimeter vessels-a training model in rats. Journal of Hand and Microsurgery. 5 (1), 14-17 (2013).
- van der Weerdt, A. P., et al. Image-derived input functions for determination of MRGlu in cardiac (18)F-FDG PET scans. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 42 (18), 1622-1629 (2001).
- Alf, M. F., et al. Quantification of brain glucose metabolism by 18F-FDG PET with real-time arterial and image-derived input function in mice. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 54 (1), 132-138 (2013).
- Eriksson, O., et al. A computerized infusion pump for control of tissue tracer concentration during positron emission tomography in vivo pharmacokinetic/pharmacodynamic measurements. BMC Medical Physics. 8, 2 (2008).
- Burger, C., Buck, A. Tracer kinetic modelling of receptor data with mathematical metabolite correction. European Journal of Nuclear Medicine. 23 (5), 539-545 (1996).
- Iida, H., et al. Error analysis of a quantitative cerebral blood flow measurement using H2(15)O autoradiography and positron emission tomography, with respect to the dispersion of the input function. Journal of Cerebral Blood Flow and Metabolism: Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 6 (5), 536-545 (1986).
- Munk, O. L., Keiding, S., Bass, L. A method to estimate dispersion in sampling catheters and to calculate dispersion-free blood time-activity curves. Medical Physics. 35 (8), 3471-3481 (2008).
- Meyer, E. Simultaneous correction for tracer arrival delay and dispersion in CBF measurements by the H215O autoradiographic method and dynamic PET. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 30 (6), 1069-1078 (1989).
- Lanz, B., Poitry-Yamate, C., Gruetter, R. Image-derived input function from the vena cava for 18F-FDG PET studies in rats and mice. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 55 (8), 1380-1388 (2014).
- Geworski, L., et al. Multicenter comparison of calibration and cross calibration of PET scanners. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 43 (5), 635-639 (2002).
- Boellaard, R. Standards for PET image acquisition and quantitative data analysis. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 50, 11-20 (2009).

