Modellering van het maat spectrum voor macro-invertebraten en vissen in stroom ecosystemen
Summary
Dit is een protocol voor het modelleren van de grootte spectrum (schaal relatie tussen individuele massa en bevolkingsdichtheid) voor gecombineerde vissen en ongewervelde gegevens van wadable streams en rivieren. De methoden omvatten: veld technieken voor het verzamelen van kwantitatieve vissen en ongewervelde monsters; labmethoden om de veldgegevens te standaardiseren; en statistische gegevensanalyse.
Abstract
Het grootte spectrum is een inverse, allometrische schaal relatie tussen de gemiddelde lichaamsmassa (M) en de dichtheid (D) van individuen binnen een ecologische Gemeenschap of voedselweb. Belangrijk is dat het maat spectrum ervan uitgaat dat individuele grootte, in plaats van soorten gedrags-of levensgeschiedenis kenmerken, de belangrijkste determinant van overvloed binnen een ecosysteem is. In tegenstelling tot traditionele allometrische relaties die zich richten op gegevens op soorten niveau (bijv. gemiddelde lichaamsgrootte versus bevolkingsdichtheid), zijn maat Spectra analyses ‘ Ataxic ‘ – individuele specimens worden alleen door hun grootte geïdentificeerd, zonder rekening te houden met taxonomische identiteit. Grootte Spectra modellen zijn efficiënte representaties van traditionele, complexe voedsel webben en kunnen worden gebruikt in beschrijvende en voorspellende contexten (bijvoorbeeld, het voorspellen van reacties van grote consumenten op veranderingen in de basale bronnen). Empirische studies van diverse aquatische ecosystemen hebben ook een matige tot hoge mate van overeenstemming gerapporteerd in grootte Spectra hellingen, wat suggereert dat gemeenschappelijke processen de Abundances van kleine en grote organismen in zeer verschillende instellingen kunnen reguleren. Dit is een protocol voor het modelleren van het grootte spectrum op communautair niveau in wadable streams. Het protocol bestaat uit drie hoofdstappen. Verzamel eerst kwantitatieve benthische vissen en ongewervelde monsters die kunnen worden gebruikt om lokale dichtheden te schatten. Ten tweede, Standaardiseer de vissen en ongewervelde gegevens door alle individuen om te zetten in ataxische eenheden (d.w.z. individuen die worden geïdentificeerd op grootte, ongeacht de taxonomische identiteit) en het optellen van individuen binnen Log2 -formaat bakken. Ten derde, gebruik lineaire regressie om de relatie tussen Ataxic M -en D -schattingen te modelleren. Gedetailleerde instructies worden hierin beschreven om elk van deze stappen te voltooien, inclusief aangepaste software om D schatting en grootte Spectra Modeling te vergemakkelijken.
Introduction
Lichaam grootte schalen relaties, zoals de positieve associatie tussen lichaamsmassa en stofwisseling, zijn bekend op het niveau van de individuele organisme en worden nu bestudeerd op hogere niveaus van organisatie1,2,3 . Deze allometrische relaties zijn meestal Power-Law functies van de vorm y = amb, waarbij Y is de variabele van belang (bijvoorbeeld, metabolisme, overvloed, of huis bereik grootte), M is de lichaamsmassa van een enkele of gemiddelde individu, b is een schaal coëfficiënt, en a is een constante. Voor statistisch gemak zijn Y -en M -gegevens vaak log-getransformeerd voorafgaand aan de analyse en gemodelleerd met lineaire vergelijkingen van het formulier logboek (Y) = Log (a) + b log (M), waarbij b en log ( a) wordt de lineaire model helling en onderscheppen, respectievelijk.
Het grootte spectrum is een soort allometrische relatie die de dichtheid voorspelt (D, het aantal individuen per eenheid gebied) of biomassa (B, de samengevat massa van individuen per eenheid gebied) als een functie van M (zie rubriek 4 voor aanvullende informatie over het gebruik van “genormaliseerde” D -of B -schattingen.) Net als andere schaal relaties tussen m en D of tussen m en Bspeelt het maat spectrum een centrale rol in de basis-en toegepaste ecologie. Op bevolkingsniveau interpreteren biologen vaak negatieve D 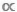 – M -relaties als bewijs van een dichtheids afhankelijke overleving of als modellen van het draagvermogen van het ecosysteem (d.w.z. de “zelf Verdunnende regel”)4, 5. Op het niveau van de Gemeenschap kunnen B
– M -relaties als bewijs van een dichtheids afhankelijke overleving of als modellen van het draagvermogen van het ecosysteem (d.w.z. de “zelf Verdunnende regel”)4, 5. Op het niveau van de Gemeenschap kunnen B 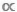 M -relaties worden gebruikt om de effecten van antropogene verstoringen op systeemniveau te bestuderen, zoals maat-selectieve visserij6,7. Allometrische schaling van D en B met M zijn ook centraal in recente inspanningen om bevolking, Gemeenschap en ecosysteem ecologie2,8,9te verenigen.
M -relaties worden gebruikt om de effecten van antropogene verstoringen op systeemniveau te bestuderen, zoals maat-selectieve visserij6,7. Allometrische schaling van D en B met M zijn ook centraal in recente inspanningen om bevolking, Gemeenschap en ecosysteem ecologie2,8,9te verenigen.
Een bijzonder belangrijk kenmerk van het grootte spectrum is het feit dat het geheel Ataxic9,10is. Dit punt is gemakkelijk te missen bij het vergelijken van scatterplots van D 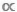 m -of B
m -of B 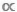 – m -gegevens, maar het onderscheid tussen taxic -en ataxische modellen is een kritische. In taxic modellen wordt één M -waarde gebruikt om de gemiddelde lichaamsmassa van elk individu van een bepaalde soort of taxa11weer te geven. In Ataxic-modellen worden alle personen binnen een gegevensset verdeeld over een reeks van intervallen van de lichaamsgrootte of M -bakken, ongeacht hun taxonomische identiteit12. Deze laatste, ataxische benadering is voordelig in aquatische ecosystemen waar veel taxa een onbepaalde groei vertonen en een of meer ontogenetische verschuivingen in het voedingsgedrag ervaren; in deze gevallen zal een enkel soort M -gemiddelde het feit verhullen dat een soort verschillende functionele rollen kan vervullen gedurende zijn levensgeschiedenis9,13,14.
– m -gegevens, maar het onderscheid tussen taxic -en ataxische modellen is een kritische. In taxic modellen wordt één M -waarde gebruikt om de gemiddelde lichaamsmassa van elk individu van een bepaalde soort of taxa11weer te geven. In Ataxic-modellen worden alle personen binnen een gegevensset verdeeld over een reeks van intervallen van de lichaamsgrootte of M -bakken, ongeacht hun taxonomische identiteit12. Deze laatste, ataxische benadering is voordelig in aquatische ecosystemen waar veel taxa een onbepaalde groei vertonen en een of meer ontogenetische verschuivingen in het voedingsgedrag ervaren; in deze gevallen zal een enkel soort M -gemiddelde het feit verhullen dat een soort verschillende functionele rollen kan vervullen gedurende zijn levensgeschiedenis9,13,14.
Hier presenteren we een compleet protocol om het grootte spectrum binnen wadable streams en rivieren te kwantificeren. Het protocol begint met veld bemonsteringsmethoden om de noodzakelijke vissen en benthische macroinvertevelde gegevens te verzamelen. Vis wordt verzameld door middel van een bemonsteringsproces met drie doorlaat depletie. De overvloed zal dan worden geschat op basis van de depletie gegevens met de Zippin methode15. Bij depletie bemonstering worden individuele vissen binnen een gesloten studie bereik (d.w.z. individuen kunnen noch het ingesloten bereik binnenkomen noch verlaten) uit het bereik gehaald door drie opeenvolgende monsters. Het aantal overgebleven vissen zal dus geleidelijk uitgeput raken. Uit deze uitputting trend, totale overvloed binnen het bereik van de studie kan worden geschat dan omgezet naar D (in vis per m2), met behulp van de bekende oppervlakte van het studie bereik. Benthische macroinvertebraten zullen worden verzameld met standaardsamplers met vaste oppervlakte en vervolgens worden geïdentificeerd en gemeten in het laboratorium.
Vervolgens worden de gecombineerde vis-en macro-Invertebrate gegevens gepartitioneerd tussen grootte opslaglocaties. Traditioneel, de octaaf of Log2 schaal (dat wil zeggen, verdubbelde intervallen) is gebruikt voor het instellen van de grootte bin grenzen16. Zodra een lijst met grootte opslaglocaties is vastgesteld, is het eenvoudig om afzonderlijke benthische macroinvertebraten onder hun respectieve grootte bakken te partitioneren, omdat ongewervelde dieren direct worden geïnventariseerd als aantallen individuen per eenheids gebied. Het schatten van visabundandansen binnen de grootte opslaglocaties is echter abstract, omdat deze schattingen uit de depletie gegevens worden afgeleid. Er worden daarom gedetailleerde instructies gegeven voor het inschatten van de overvloed van vis in grootte bakken, ongeacht de taxonomische identiteit, van depletie-steekproefgegevens.
Ten slotte wordt lineaire regressie gebruikt om het grootte spectrum te modelleren. Dit protocol is volledig compatibel met de originele, algemene methode van Kerr en Dickie16 en identiek aan de methoden gebruikt door McGarvey en Kirk, 201817 in een studie van vissen en ongewervelde grootte spectra in West Virginia streams. Door dit protocol te gebruiken, kunnen onderzoekers verzekeren dat hun resultaten direct vergelijkbaar zijn met andere studies die voortbouwen op Kerr en Dickie16, waardoor een breed en robuust begrip van de lichaamsgrootte relaties in zoet water wordt versneld ecosystemen en de mechanismen die hen aandrijmen.
Protocol
Representative Results
Discussion
Deze Ataxic size Spectra protocol kan worden gebruikt om te kwantificeren en model grootte structuur binnen gemeenschappen van stroom vissen en ongewervelde dieren. Eerdere maat Spectra studies in de stroom ecosystemen varieerden van basis beschrijvend onderzoek39,40 tot vergelijkingen langs een longitudinaal rivier profiel41 en tussen verschillende biogeografische regio’s42. Seizoensvergelijkingen zijn uitgevoerd<s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
De financiering van dit werk werd verzorgd door de National Science Foundation (Grant DEB-1553111) en de Eppley Foundation for Scientific Research. Dit manuscript is VCU Rice Rivers Center bijdrage #89.
Materials
| Chest waders | Multiple options | n/a | Personal protective equipment for use during electrofishing. Do NOT use 'breatheable' waders as electrical current will pass through them. |
| Rubber lineman's gloves | Multiple options | n/a | Personal protective equipment for use during electrofishing. |
| Dip nets with fiberglass poles | Multiple options | n/a | Used to capture stunned fishes during electrofishing. |
| Backpack electrofishing unit | Smith-Root; Halltech; Midwest Lake Management; Aqua Shock Solutions | www.smith-root.com; www.halltechaquatic.com; https://midwestlake.com; https://aquashocksolutions.com/ | Backpack electrofishers are currently manufactured and distributed by four independent companies in North America. Prices and warranty/technical support are the most important factors in choosing a vendor. |
| Block nets/seines (×2) | Duluth Nets | https://duluthfishnets.com/ | Necessary length will depend on stream width. 3/8 inch mesh is recommended. |
| Cam-action utility straps with 1 inch nylon webbing (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at auto supply, hardware, and department stores. |
| Large tent stakes (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at camping and department stores. |
| 5 gallon plastic buckets (×5) | Multiple options | n/a | Used to hold and transport fish during electrofishing. Available at hardware and paint supply stores. |
| 10-20 gallon totes (×3) | Multiple options | n/a | Used as livewells, sedation tanks, and recovery bins for captured fishes. Available at hardware and department stores. |
| Battery powered 'bait bucket' aeration pumps | Cabelas | IK-019008 | Used to aerate fish holding bins during field processing. |
| Fish anesthesia (Tricaine-S) | Syndel | www.syndel.com | Used to sedate fishes for field processing. Tricaine-S is regulated by the U.S. Food and Drug Administration. |
| Folding camp table and chairs | Cabelas | IK-518976; IK-552777 | Used to process fish samples. |
| Pop-up canopy | Multiple options | n/a | Used as necessary for sun and rain protection. |
| Fish measuring board | Wildco | 3-118-E40 | Used to measure fish lengths. |
| Battery powered field scale with weighing dish | Multiple options | n/a | Used to weigh fishes. Must weigh be accurate to 0.1 or 0.01 grams. |
| Clear plastic wind/rain baffle | Multiple options | n/a | Used to shield scale in rainy or windy conditions. Must be large enough to cover the scale and a weighing dish. |
| White plastic or enamel examination trays | Multiple options | n/a | Trays are essential for examining fishes in the field. |
| Stainless steel forceps | Multiple options | n/a | Forceps are helpful when examining small fishes and in transfering invertebrates to specimen jars. |
| Hand magnifiers | Multiple options | n/a | Magnification is often helpful when identifying fish specimens in the field. |
| Fish identification keys | n/a | n/a | Laminated keys that are custom prepared for specific locations are most effective. |
| Datasheets printed on waterproof paper | Rite in the Rain | n/a | Waterproof paper is essential when working with aquatic specimens. |
| Retractable fiberglass field tapes | Lufkin | n/a | Used to measure stream channel dimensions. |
| Surber sampler or Hess sampler | Wildco | 3-12-D56; 3-16-C52 | Either of these fixed-area benthic samplers will work well in shallow streams with gravel or pebble substrate. |
| 70% ethanol or isopropyl alcohol | Multiple options | n/a | Used as invertebrate preservative. |
| Widemouth invertebrate specimen jars (20-32 oz.) | U.S. Plastic Corp. | 67712 | Any widemouth plastic jars will work but these particular jars are durable and inexpensive. |
References
- Peters, R. H. . The ecological implications of body size. , (1983).
- Brown, J. H., Gillooly, J. F., Allen, A. P., Savage, V. M., West, G. B. Toward a metabolic theory of ecology. Ecology. 85 (7), 1771-1789 (2004).
- Marquet, P. A., et al. Scaling and power-laws in ecological systems. Journal of Experimental Biology. 208 (9), 1749-1769 (2005).
- Bohlin, T., Dellefors, C., Faremo, U., Johlander, A. The energetic equivalence hypothesis and the relation between population-density and body-size in stream-living salmonids. The American Naturalist. 143 (3), 478-493 (1994).
- Dunham, J. B., Vinyard, G. L. Relationships between body mass, population density, and the self-thinning rule in stream-living salmonids. Canadian Journal of Fisheries and Aquatic Sciences. 54 (5), 1025-1030 (1997).
- Jennings, S., Blanchard, J. L. Fish abundance with no fishing: predictions based on macroecological theory. Journal of Animal Ecology. 73 (4), 632-642 (2004).
- Petchey, O. L., Belgrano, A. Body-size distributions and size-spectra: universal indicators of ecological status?. Biology Letters. 6 (4), 434-437 (2010).
- Woodward, G., et al. Body size in ecological networks. Trends in Ecology and Evolution. 20 (7), 402-409 (2005).
- Trebilco, R., Baum, J. K., Salomon, A. K., Dulvy, N. K. Ecosystem ecology: size-based constraints on the pyramids of life. Trends in Ecology and Evolution. 28 (7), 423-431 (2013).
- White, E. P., Ernest, S. K. M., Kerkhoff, A. J., Enquist, B. J. Relationships between body size and abundance in ecology. Trends in Ecology and Evolution. 22 (6), 323-330 (2007).
- Schmid, P. E., Tokeshi, M., Schmid-Araya, J. M. Relation between population density and body size in stream communities. Science. 289 (5484), 1557-1560 (2000).
- Morin, A., Nadon, D. Size distribution of epilithic lotic invertebrates and implications for community metabolism. Journal of the North American Benthological Society. 10 (3), 300-308 (1991).
- Mittelbach, G. G., Persson, L. The ontogeny of piscivory and its ecological consequences. Canadian Journal of Fisheries and Aquatic Sciences. 55 (6), 1454-1465 (1998).
- Woodward, G., Hildrew, A. G. Body-size determinants of niche overlap and intraguild predation within a complex food web. Journal of Animal Ecology. 71 (6), 1063-1074 (2002).
- Zippin, C. The removal method of population estimation. Journal of Wildlife Management. 22 (1), 82-90 (1958).
- Kerr, S. R., Dickie, L. M. . The biomass spectrum: a predator-prey theory of aquatic production. , (2001).
- McGarvey, D. J., Kirk, A. J. Seasonal comparison of community-level size-spectra in southern coalfield streams of West Virginia (USA). Hydrobiologia. 809 (1), 65-77 (2018).
- Reynolds, J. B., Kolz, A. L., Zale, A. V., Parrish, D. L., Sutton, T. M. Electrofishing. Fisheries techniques. 8, 305-361 (2012).
- Bowker, J., Trushenski, J. Fish drug questions answered by the FDA. Fisheries. 38 (12), 549-552 (2013).
- Topic Popovic, N., et al. Tricaine methane-sulfonate (MS-222) application in fish anaesthesia. Journal of Applied Ichthyology. 28 (4), 553-564 (2012).
- Trautman, M. B. . The fishes of Ohio. , (1981).
- Riley, S. C., Fausch, K. D. Underestimation of trout population size by maximum-likelihood removal estimates in small streams. North American Journal of Fisheries Management. 12 (4), 768-776 (1992).
- Merritt, R. W., Cummins, K. W., Resh, V. H., Batzer, D. P., Merritt, R. W., Cummins, K. W., Berg, M. B. Sampling aquatic insects: collection devices, statistical considerations, and rearing procedures. An introduction to the aquatic insects of North America. , 15-37 (2008).
- Hauer, F. R., Resh, V. H., Hauer, F. R., Lamberti, G. A. Macroinvertebrates. Methods in stream ecology. 1, 297-319 (2017).
- Thorp, J. H., Covich, A. P. . Ecology and classification of North American freshwater invertebrates. , (2010).
- Merritt, R. W., Cummins, K. W., Berg, M. B. . An introduction to the aquatic insects of North America. , (2008).
- Stewart, K. W., Stark, B. P. . Nymphs of North American stonefly genera (Plecoptera). , (2002).
- Wiggins, G. B. . Larvae of the North American caddisfly genera (Trichoptera). , (1998).
- Benke, A. C., Huryn, A. D., Smock, L. A., Wallace, J. B. Length-mass relationships for freshwater macroinvertebrates in North America with particular reference to the Southeastern United States. Journal of the North American Benthological Society. 18 (3), 308-343 (1999).
- Smock, L. A. Relationships between body size and biomass of aquatic insects. Freshwater Biology. 10 (4), 375-383 (1980).
- Waters, T. F. Secondary production in inland waters. Adv. Ecol. Res. 10, 91-164 (1977).
- Carle, F. L., Strub, M. R. New method for estimating population-size from removal data. Biometrics. 34 (4), 621-630 (1978).
- Ogle, D. H., Wheeler, P., Dinno, A. FSA: fisheries stock analysis. R package version 0.8.22.9000. , (2018).
- Lockwood, R. N., Schneider, J. C., Schneider, J. C. Stream fish population estimates by mark-and-recapture and depletion methods. Manual of fisheries survey methods II: with periodic updates. 7, (2000).
- Blanco, J. M., Echevarría, F., García, C. M. Dealing with size-spectra: some conceptual and mathematical problems. Scientia Marina. 58 (1-2), 17-29 (1994).
- White, E. P., Enquist, B. J., Green, J. L. On estimating the exponent of power-law frequency distributions. Ecology. 89 (4), 905-912 (2008).
- Vidondo, B., Prairie, Y. T., Blanco, J. M., Duarte, C. M. Some aspects of the analysis of size spectra in aquatic ecology. Limnology and Oceanography. 42 (1), 184-192 (1997).
- Sprules, W. G., Barth, L. E. Surfing the biomass size spectrum: some remarks on history, theory, and application. Canadian Journal of Fisheries and Aquatic Sciences. 73 (4), 477-495 (2016).
- Poff, N. L., et al. Size structure of the metazoan community in a Piedmont stream. Oecologia. 95 (2), 202-209 (1993).
- Ramsay, P. M., et al. A rapid method for estimating biomass size spectra of benthic metazoan communities. Canadian Journal of Fisheries and Aquatic Sciences. 54 (8), 1716-1724 (1997).
- Solimini, A. G., Benvenuti, A., D’Olimpio, R., Cicco, M. D., Carchini, G. Size structure of benthic invertebrate assemblages in a Mediterranean river. Journal of the North American Benthological Society. 20 (3), 421-431 (2001).
- Huryn, A. D., Benke, A. C., Hildrew, A., Raffaelli, D., Edmonds-Brown, R. Relationship between biomass turnover and body size for stream communities. Body size: the structure and function of aquatic ecosystems. 4, 55-76 (2007).
- Gaedke, U. The size distribution of plankton biomass in a large lake and its seasonal variability. Limnology and Oceanography. 37 (6), 1202-1220 (1992).
- Stead, T. K., Schmid-Araya, J. M., Schmid, P. E., Hildrew, A. G. The distribution of body size in a stream community: one system, many patterns. Journal of Animal Ecology. 74 (3), 475-487 (2005).
- Brose, U., et al. Consumer-resource body-size relationships in natural food webs. Ecology. 87 (10), 2411-2417 (2006).
- Mehner, T., et al. Empirical correspondence between trophic transfer efficiency in freshwater food webs and the slope of their size spectra. Ecology. 99 (6), 1463-1472 (2018).
- Daan, N., Gislason, H. G., Pope, J. C., Rice, J. Changes in the North Sea fish community: evidence of indirect effects of fishing?. ICES Journal of Marine Science. 62 (2), 177-188 (2005).
- Murry, B. A., Farrell, J. M. Resistance of the size structure of the fish community to ecological perturbations in a large river ecosystem. Freshwater Biology. 59 (1), 155-167 (2014).
- Broadway, K. J., Pyron, M., Gammon, J. R., Murry, B. A. Shift in a large river fish assemblage: body-size and trophic structure dynamics. PLoS ONE. 10 (4), e0124954 (2015).
- Vila-Martínez, N., Caiola, N., Ibáñez, C., Benejam, L., Brucet, S. Normalized abundance spectra of fish community reflect hydro-peaking on a Mediterranean large river. Ecological Indicators. 97, 280-289 (2019).
- Brucet, S., et al. Size-based interactions across trophic levels in food webs of shallow Mediterranean lakes. Freshwater Biology. 62 (11), 1819-1830 (2017).
- Ersoy, Z., et al. Size-based interactions and trophic transfer efficiency are modified by fish predation and cyanobacteria blooms in Lake Mývatn, Iceland. Freshwater Biology. 62 (11), 1942-1952 (2017).
- Arranz, I., Hsieh, C. H., Mehner, T., Brucet, S. Systematic deviations from linear size spectra of lake fish communities are correlated with predator–prey interactions and lake-use intensity. Oikos. 128 (1), 33-44 (2019).
- Jennings, S., et al. Long-term trends in the trophic structure of the North Sea fish community: evidence from stable-isotope analysis, size-spectra and community metrics. Marine Biology. 141 (6), 1085-1097 (2002).
- Guiet, J., Poggiale, J. C., Maury, O. Modelling the community size-spectrum: recent developments and new directions. Ecological Modelling. 337, 4-14 (2016).
- Robinson, J. P. W., et al. Fishing degrades size structure of coral reef fish communities. Global Change Biology. 23 (3), 1009-1022 (2017).
- Reuman, D. C., Mulder, C., Raffaelli, D., Cohen, J. E. Three allometric relations of population density to body mass: theoretical integration and empirical tests in 149 food webs. Ecology Letters. 11 (11), 1216-1228 (2008).
- Huryn, A. D., Wallace, J. B., Anderson, N. H., Merritt, R. W., Cummins, K. W., Berg, M. B. Habitat, life history, secondary production, and behavioral adaptations of aquatic insects. An introduction to the aquatic insects of. 5, 55-103 (2008).
- Werner, E. E., Gilliam, J. F. The ontogenetic niche and species interactions in size-structured populations. Annual Review of Ecology and Systematics. 15 (1), 393-425 (1984).
- Edwards, A. M., Robinson, J. P. W., Plank, M. J., Baum, J. K., Blanchard, J. L. Testing and recommending methods for fitting size spectra to data. Methods in Ecology and Evolution. 8 (1), 57-67 (2017).
- Roell, M., Orth, D. Production of three crayfish populations in the New River of West Virginia, USA. Hydrobiologia. 228 (3), 185-194 (1992).
- Hawkins, C. P., Murphy, M. L., Anderson, N. H., Wilzbach, M. A. Density of fish and salamanders in relation to riparian canopy and physical habitat in streams of the northwestern United States. Canadian Journal of Fisheries and Aquatic Sciences. 40 (8), 1173-1185 (1983).
- Rabeni, C. F., Collier, K. J., Parkyn, S. M., Hicks, B. J. Evaluating techniques for sampling stream crayfish (Paranephrops planifrons). New Zealand Journal of Marine and Freshwater Research. 31 (5), 693-700 (1997).
- DiStefano, R. J., Gale, C. M., Wagner, B. A., Zweifel, R. D. A sampling method to assess lotic crayfish communities. Journal of Crustacean Biology. 23 (3), 678-690 (2003).
- Price, J. E., Welch, S. M. Semi-quantitative methods for crayfish sampling: sex, size, and habitat bias. Journal of Crustacean Biology. 29 (2), 208-216 (2009).
- Sheldon, R. W., Sutcliffe, W. H., Paranjape, A. M. Structure of pelagic food chain and relationship between plankton and fish production. Journal of the Fisheries Research Board of Canada. 34 (12), 2344-2353 (1977).
- Andersen, K., et al. Asymptotic size determines species abundance in the marine size spectrum. The American Naturalist. 168 (1), 54-61 (2006).

