Détermination de l’état fonctionnel de la tractaire corticospinal dans une semaine d’AVC
Summary
Ce protocole est pour évaluer la fonction corticospinal de région dans un délai de 1 semaine de course. Il peut être utilisé pour sélectionner et stratifier les patients dans les essais d’interventions visant à améliorer la récupération et les résultats du moteur des membres supérieurs et dans la pratique clinique pour prédire les résultats fonctionnels des membres supérieurs 3 mois après l’AVC.
Abstract
La variabilité interindividuelle élevée dans le rétablissement de la fonction supérieure de membre (UL) après course signifie qu’il est difficile de prévoir le potentiel d’une personne pour le rétablissement basé sur des évaluations cliniques seules. L’intégrité fonctionnelle du tractus corticospinal est un biomarqueur pronostique important pour le rétablissement de la fonction d’UL, particulièrement pour ceux avec l’affaiblissement initial grave d’UL. Cet article présente un protocole pour évaluer la fonction corticospinal de région dans un délai de 1 semaine de course. Ce protocole peut être utilisé pour sélectionner et stratifier les patients dans les essais d’interventions conçues pour améliorer la récupération motrice UL et les résultats après un AVC. Le protocole fait également partie de l’algorithme PREP2, qui prédit la fonction UL pour les patients individuels 3 mois après l’AVC. L’algorithme combine séquentiellement une évaluation de la force UL, l’âge, la stimulation magnétique transcrânienne et la gravité de l’AVC, dans les quelques jours suivant l’AVC. Les avantages de l’utilisation de PREP2 dans la pratique clinique sont décrits ailleurs. Cet article se concentre sur l’utilisation d’une évaluation de force d’UL et de stimulation magnétique transcrânienne pour évaluer la fonction corticospinal de région.
Introduction
La fonction des membres supérieurs est généralement altérée après un AVC, et le rétablissement de la fonction UL est important pour retrouver l’indépendance dans les activités quotidiennes1. Les essais de réadaptation en cas d’AVC visent souvent à améliorer le rétablissement et les résultats de l’UL après un AVC. La majorité de la recherche sur la réadaptation des accidents vasculaires cérébraux est menée auprès de patients à l’étape chronique (6 mois après l’AVC), mais la plupart des réadaptations se produisent tôt après l’AVC2,3. D’autres recherches doivent être menées avec les patients peu de temps après un AVC afin d’établir une base de données probantes pour la pratique de la réadaptation.
L’un des plus grands défis lors de la réalisation de recherches peu de temps après l’AVC est de détecter les effets de l’intervention dans le contexte de la récupération survenant au cours des premières semaines et mois après l’AVC. La variabilité intersoumise élevée dans la présentation et la récupération cliniques crée le bruit qui peut obscurcir les effets bénéfiques des interventions. Les groupes d’intervention et de contrôle sont généralement équilibrés sur les mesures cliniques de l’affaiblissement neurologique initial. Cependant, ces mesures sont souvent de mauvais prédicteurs du potentiel du patient pour le rétablissement ultérieur, particulièrement ceux avec l’affaiblissement initial grave4,5. Cela signifie que les groupes peuvent être jumelés à des mesures cliniques de base et non à leur potentiel de rétablissement, ce qui rend plus difficile de déterminer les effets de l’intervention. Les biomarqueurs peuvent relever ce défi en identifiant le potentiel d’un patient individuel pour la récupération motrice, de sorte que les groupes peuvent être correctement appariés et stratifiés6,7,8. Les biomarqueurs peuvent également être utilisés pour sélectionner les patients les plus susceptibles de répondre aux mécanismes d’action connus ou hypothétiques de l’intervention6.
L’intégrité fonctionnelle de la région corticospinal (CST) est un biomarqueur clé qui prédit la récupération de la fonction UL après un AVC5,8,9,10,11,12. Le CST transmet la sortie descendante du cortex moteur primaire à la moelle épinière et est essentiel pour la coordination et le contrôle du moteur fin. Les patients atteints d’un TCS fonctionnel après un AVC sont plus susceptibles de retrouver la force, la coordination et la dextérité que les patients qui n’en ont pas. Une évaluation clinique peut être suffisante pour confirmer que le CST est fonctionnel chez les patients légèrement altérés13,14,15. Cependant, les patients présentant l’affaiblissement initial plus grave peuvent ou peuvent ne pas avoir un CST fonctionnel, et une évaluation neurophysiologique utilisant la stimulation magnétique transcrânienne (TMS) est nécessaire9,10,11,16,17.
TMS est une technique non invasive et indolore qui peut être utilisée pour tester la fonction CST18. La bobine TMS délivre un stimulus magnétique sur le cortex moteur primaire qui génère une volée descendante dans le CST, suscitant un potentiel moteur-évoqué (MEP) dans les muscles du membre contralatéral19. La présence d’un eurodéputé dans le bras ou la main parétique (MEP) indique un CST fonctionnel et est associée à un plus grand potentiel de récupération de la fonction UL. Les patients qui sont eurodéputés- sont les plus susceptibles d’avoir un pire rétablissement UL, sans retour de la fonction de la main coordonnée et habile4,6,9,12,16.
Le dépistage de tous les patients atteints de SMT n’est pas pratique et inutile, car ceux qui ont une déficience initiale légère ont très probablement un TCS fonctionnel17. Par conséquent, une approche hiérarchique est nécessaire de sorte que TMS est seulement utilisé pour les patients présentant une déficience initiale plus grave. L’algorithme PREP2 a été développé à l’aide d’une combinaison de mesures cliniques et de TMS pour évaluer la fonction du TCS et prédire les résultats probables de l’UL à 3 mois après l’AVC (figure 1)17. PREP2 commence au jour 3 après l’AVC en testant la force de l’enlèvement de l’épaule et l’extension du doigt dans le bras parétique (score SAFE), en utilisant les grades du Conseil de recherches médicales. Si la somme de ces notes est de 5 ou plus sur 10, il est « sûr » de supposer que le patient est mep. On s’attend à ce que ces patients aient un bon ou excellent résultat d’UL par 3 mois après l’AVC, selon leur âge17. Ces patients n’ont pas besoin de TMS pour déterminer le statut de MEP, minimisant le coût et les tests inutiles pour le patient.
Les patients ayant obtenu un score SAFE de moins de 5 au jour 3 après l’AVC ont besoin de TMS pour déterminer l’intégrité fonctionnelle de leur TCS. Si un eurodéputé peut être obtenu à partir de l’extenseur pareti carpi radialis (ECR) ou le premier interosseus dorsal (FDI) muscles, le patient est MEP et on s’attend à récupérer le contrôle moteur fin de la main par 3 mois après l’AVC. Environ la moitié des patients ayant obtenu un score SAFE inférieur à 5 au jour 3 après l’AVC sont des MEPMD. Fait important, les patients peuvent avoir un score SAFE aussi bas que zéro et être mep. Ceci illustre le besoin de TMS dans ce sous-groupe de patients, car l’évaluation clinique seule ne peut pas distinguer entre les patients avec et sans un CST fonctionnel. Les patients qui sont eurodéputés- ont des dommages importants de CST. On s’attend à ce que ces patients aient un résultat fonctionnel limité ou pauvre d’UL selon leur sévérité globale d’AVC, mesurée avec l’institut national de l’échelle de course de santé (NIHSS) (figure 1)17. On ne s’attend pas à ce que ces patients de MEP reprennent le contrôle coordonné et habile de doigt et peuvent être regroupés ensemble pour des buts de recherche.
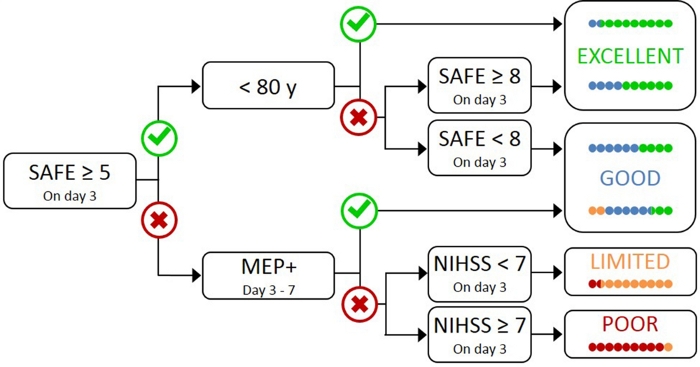
Figure 1 : L’algorithme PREP2. SAFE – Enlèvement de l’épaule, score d’extension des doigts, qui est la somme des notes du Conseil de recherches médicales pour chacun de ces mouvements sur 5, pour un score total SAFE sur 10. Les potentiels évoqués par le moteur de l’épéandieux peuvent être obtenus à partir des muscles parétiaux de l’extenseur carpi radialis (ECR) et/ou des premiers muscles interossés dorsaires (IDE) de l’UL parétique à l’aide d’une stimulation magnétique transcrânienne. NIHSS – National Institutes of Health Stroke Scale. L’algorithme prédit l’un des quatre résultats fonctionnels possibles uL à 3 mois après l’AVC. Chaque catégorie de prédiction est associée à un foyer de réadaptation qui peut être utilisé pour adapter la thérapie UL2. Les points colorés représentent, proportionnellement, la précision de l’algorithme PREP2. Les points sont codés en couleur en fonction de la catégorie de résultats effectivement atteint 3 mois après l’AVC (Vert – Excellent; Bleu et bien; Orange et Limitée; Rouge et pauvre). Figure reproduite à partir de Stinear et coll.17. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
En pratique clinique, PREP2 prédit l’une des quatre catégories de résultats qui peuvent être utilisées pour adapter la réadaptation pour les patients individuels et aider les patients et les familles à comprendre ce qu’ils peuvent attendre pour leur rétablissement uL. À ce jour, PREP2 est le seul outil de prédiction UL validé à l’externe qui combine l’évaluation clinique et l’information sur les biomarqueurs dans un arbre de décision17. C’est aussi le seul outil de prédiction UL avec des recherches sur les effets de la mise en œuvre dans la pratique clinique20,21. Les prédictions PREP2 sont exactes pour environ 75% des patients, trop optimistes pour 17% et trop pessimistes pour 8% des patients à 3 mois après l’AVC17. La précision est la plus élevée pour les patients de MEP-(précis pour 90% de MEP-patients), soulignant la valeur d’utiliser TMS pour identifier ces patients présentant des dommages graves aux voies motrices descendantes17. PREP2 reste correct pour environ 80% des patients à 2 ans post-AVC22. Ceci soutient l’utilisation de PREP2 pour prévoir des résultats fonctionnels de moteur d’UL à 3 mois et à plus long terme. L’information sur la réalisation des prédictions PREP2 et leur utilisation dans la pratique clinique est en dehors du champ d’application de ce document de méthodes, mais des ressources détaillées sont disponibles en ligne23.
PREP2 fournit aux chercheurs un outil pour sélectionner et stratifier les patients pour les essais cliniques. Cela permet aux patients d’être regroupés non seulement en fonction des caractéristiques cliniques de base, mais aussi de leur potentiel neurobiologique pour le rétablissement de l’UL. En dépit des preuves croissantes pour l’utilisation de TMS comme biomarqueur pronostique pour le rétablissement d’UL, le manque de familiarité avec des protocoles de TMS dans des arrangements d’hôpital avec des patients subaigus de course peut être un obstacle à son utilisation dans la recherche. Par conséquent, ce protocole vise à démontrer comment utiliser le score SAFE et TMS pour évaluer la fonction CST chez les patients dans un milieu hospitalier tôt après l’AVC.
Protocol
Representative Results
Discussion
La fonction CST évaluée avec le statut de MEP est un biomarqueur pronostique clé pour le rétablissement et les résultats d’UL après course. Un total de 95% des patients avec un CST fonctionnel à 1 semaine après l’AVC atteindre un test de bras de recherche d’action (ARAT) score d’au moins 34 sur 57 par 3 mois après l’AVC17. Inversement, 100% des patients sans CST fonctionnel à 1 semaine après l’AVC obtiennent un score ARAT de moins de 34 par 3 mois après l’AVC<sup class="x…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Les auteurs remercient le professeur Winston Byblow et Harry Jordan pour leur précieuse contribution à ce travail. Ces travaux ont été financés par le Health Research Council of New Zealand.
Materials
| alcohol/skin cleansing wipes | Reynard | alcohol prep pads | |
| electromyography electrodes | 3M | red dot electrodes | |
| Magstim TMS coil | Magstim | flat figure-8 coil | |
| razors | any | ||
| skin prep tape | 3M | red dot skin prep tape | |
| TMS stimulator | Magstim | Magstim 200 single pulse stimulator |
References
- Veerbeek, J. M., Kwakkel, G., van Wegen, E. E., Ket, J. C., Heymans, M. W. Early prediction of outcome of activities of daily living after stroke: a systematic review. Stroke. 42 (5), 1482-1488 (2011).
- Lohse, K. R., Schaefer, S. Y., Raikes, A. C., Boyd, L. A., Lang, C. E. Asking New Questions with Old Data: The Centralized Open-Access Rehabilitation Database for Stroke. Frontiers in Neurology. 7, 153 (2016).
- Stinear, C., Ackerley, S., Byblow, W. Rehabilitation is initiated early after stroke, but most motor rehabilitation trials are not: a systematic review. Stroke. 44 (7), 2039-2045 (2013).
- Stinear, C. M. Prediction of recovery of motor function after stroke. Lancet Neurology. 9 (12), 1228-1232 (2010).
- Byblow, W. D., Stinear, C. M., Barber, P. A., Petoe, M. A., Ackerley, S. J. Proportional recovery after stroke depends on corticomotor integrity. Annals of Neurology. 78 (6), 848-859 (2015).
- Stinear, C. M. Prediction of motor recovery after stroke: advances in biomarkers. Lancet Neurology. 16 (10), 826-836 (2017).
- Kim, B., Winstein, C. Can Neurological Biomarkers of Brain Impairment Be Used to Predict Poststroke Motor Recovery? A Systematic Review. Neurorehabilitation and Neural Repair. 31 (1), 3-24 (2016).
- Boyd, L. A., et al. Biomarkers of stroke recovery: Consensus-based core recommendations from the Stroke Recovery and Rehabilitation Roundtable. International Journal of Stroke. 12 (5), 480-493 (2017).
- Escudero, J. V., Sancho, J., Bautista, D., Escudero, M., Lopez-Trigo, J. Prognostic value of motor evoked potential obtained by transcranial magnetic brain stimulation in motor function recovery in patients with acute ischemic stroke. Stroke. 29 (9), 1854-1859 (1998).
- Pennisi, G., et al. Absence of response to early transcranial magnetic stimulation in ischemic stroke patients: prognostic value for hand motor recovery. Stroke. 30 (12), 2666-2670 (1999).
- Rapisarda, G., Bastings, E., de Noordhout, A. M., Pennisi, G., Delwaide, P. J. Can motor recovery in stroke patients be predicted by early transcranial magnetic stimulation?. Stroke. 27 (12), 2191-2196 (1996).
- Bembenek, J. P., Kurczych, K., Karli Nski, M., Czlonkowska, A. The prognostic value of motor-evoked potentials in motor recovery and functional outcome after stroke – a systematic review of the literature. Functional Neurology. 27 (2), 79-84 (2012).
- Smania, N., et al. Active finger extension: a simple movement predicting recovery of arm function in patients with acute stroke. Stroke. 38 (3), 1088-1090 (2007).
- Nijland, R. H., van Wegen, E. E., Harmeling-van der Wel, B. C., Kwakkel, G. EPOS Investigators. Presence of finger extension and shoulder abduction within 72 hours after stroke predicts functional recovery: early prediction of functional outcome after stroke: the EPOS cohort study. Stroke. 41 (4), 745-750 (2010).
- Katrak, P., et al. Predicting upper limb recovery after stroke: the place of early shoulder and hand movement. Archives of Physical Medicine and Rehabilitation. 79 (7), 758-761 (1998).
- Stinear, C. M., Barber, P. A., Petoe, M., Anwar, S., Byblow, W. D. The PREP algorithm predicts potential for upper limb recovery after stroke. Brain. 135 (Pt 8), 2527-2535 (2012).
- Stinear, C. M., et al. PREP2: A biomarker-based algorithm for predicting upper limb function after stroke. Annals of Clinical and Translational Neurology. 4 (11), 811-820 (2017).
- Groppa, S., et al. A practical guide to diagnostic transcranial magnetic stimulation: report of an IFCN committee. Clinical Neurophysiology. 123 (5), 858-882 (2012).
- Barker, A. T., Jalinous, R., Freeston, I. L. Non-invasive magnetic stimulation of human motor cortex. Lancet. 1 (8437), 1106-1107 (1985).
- Stinear, C. M., Byblow, W. D., Ackerley, S. J., Barber, P. A., Smith, M. C. Predicting Recovery Potential for Individual Stroke Patients Increases Rehabilitation Efficiency. Stroke. 48 (4), 1011-1019 (2017).
- Connell, L. A., Smith, M. C., Byblow, W. D., Stinear, C. M. Implementing biomarkers to predict motor recovery after stroke. NeuroRehabilitation. 43 (1), 41-50 (2018).
- Smith, M. C., Ackerley, S. J., Barber, P. A., Byblow, W. D., Stinear, C. M. PREP2 Algorithm Predictions Are Correct at 2 Years Poststroke for Most Patients. Neurorehabilitation and Neural Repair. 33 (8), 635-642 (2019).
- Rossi, S., Hallett, M., Rossini, P. M., Pascual-Leone, A. Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research. Clinical Neurophysiology. 120 (12), 2008-2039 (2009).
- Talelli, P., Greenwood, R. J., Rothwell, J. C. Arm function after stroke: neurophysiological correlates and recovery mechanisms assessed by transcranial magnetic stimulation. Clinical Neurophysiology. 117 (8), 1641-1659 (2006).

