Bestimmung des Funktionellen Status des Corticospinal Tract innerhalb einer Woche nach dem Schlaganfall
Summary
Dieses Protokoll dient zur Bewertung der Funktion des Kortikospinaltraktes innerhalb von 1 Woche nach dem Schlaganfall. Es kann verwendet werden, um Patienten in Studien mit Interventionen auszuwählen und zu schichten, die entwickelt wurden, um die motorische Erholung und Ergebnisse der oberen Gliedmaßen zu verbessern, und in der klinischen Praxis zur Vorhersage der funktionellen Ergebnisse der oberen Gliedmaßen 3 Monate nach dem Schlaganfall.
Abstract
Eine hohe interindividuelle Variabilität bei der Wiederherstellung der Funktion der oberen Extremität (UL) nach einem Schlaganfall bedeutet, dass es schwierig ist, das Erholungspotenzial einer Person allein auf der Grundlage klinischer Bewertungen vorherzusagen. Die funktionelle Integrität des Kortikospinaltraktes ist ein wichtiger prognostischer Biomarker für die Wiederherstellung der UL-Funktion, insbesondere für Personen mit schwerer anfänglicher UL-Beeinträchtigung. Dieser Artikel stellt ein Protokoll zur Bewertung der Funktion des Kortikospinaltraktes innerhalb von 1 Woche nach dem Schlaganfall vor. Dieses Protokoll kann verwendet werden, um Patienten in Studien mit Interventionen zur Verbesserung der UL-Motorrückgewinnung und der Ergebnisse nach einem Schlaganfall auszuwählen und zu schichten. Das Protokoll ist auch Teil des PREP2-Algorithmus, der die UL-Funktion für einzelne Patienten 3 Monate nach dem Schlaganfall vorhersagt. Der Algorithmus kombiniert sequenziell eine UL-Stärkebeurteilung, Alter, transkranielle magnetische Stimulation und Schlaganfall-Schwere innerhalb weniger Tage nach dem Schlaganfall. Die Vorteile der Verwendung von PREP2 in der klinischen Praxis werden an anderer Stelle beschrieben. Dieser Artikel konzentriert sich auf die Verwendung einer UL-Stärkebewertung und transkraniellen magnetischen Stimulation zur Bewertung der Funktion des Kortikospinaltraktes.
Introduction
Die Funktion der oberen Gliedmaßen ist häufig nach einem Schlaganfall beeinträchtigt, und die Wiederherstellung der UL-Funktion ist wichtig, um die Unabhängigkeit in den täglichen Lebensaktivitäten wiederzuerlangen1. Schlaganfall-Rehabilitationsstudien zielen oft darauf ab, die UL-Wiederherstellung und die Ergebnisse nach einem Schlaganfall zu verbessern. Die Mehrheit der Schlaganfall-Rehabilitationsforschung wird mit Patienten im chronischen Stadium (>6 Monate nach dem Schlaganfall) durchgeführt, aber die meisten Rehabilitationen erfolgen früh nach Schlaganfall2,3. Mehr Forschung muss mit Patienten bald nach einem Schlaganfall durchgeführt werden, um eine Evidenzbasis für die Rehabilitationspraxis zu bauen.
Eine der größten Herausforderungen bei der Forschung kurz nach dem Schlaganfall ist die Erkennung der Auswirkungen des Eingriffs vor dem Hintergrund der Erholung, die in den ersten Wochen und Monaten nach dem Schlaganfall auftritt. Eine hohe intersubjekte Variabilität in der klinischen Präsentation und Erholung erzeugt Lärm, der die positiven Auswirkungen von Interventionen verschleiern kann. Interventions- und Kontrollgruppen sind in der Regel auf klinische Maßnahmen der anfänglichen neurologischen Beeinträchtigung enden. Diese Maßnahmen sind jedoch oft schlechte Prädiktoren für das Potenzial des Patienten für eine spätere Genesung, insbesondere solche mit schwerer Anfangsbeeinträchtigung4,5. Dies bedeutet, dass Gruppen für klinische Basismaßnahmen und nicht für ihr Wiederherstellungspotenzial abgeglichen werden können, was es schwieriger macht, die Auswirkungen der Intervention zu ermitteln. Biomarker können diese Herausforderung angehen, indem sie das Potenzial eines einzelnen Patienten zur motorischen Rückgewinnung identifizieren, so dass Gruppen genau aufeinander abgestimmt und geschichtet werden können6,7,8. Biomarker können auch verwendet werden, um Patienten auszuwählen, die am ehesten auf diebekannten oder hypothetischen Wirkmechanismen der Intervention 6 reagieren.
Die funktionelle Integrität des Kortikospinaltraktes (CST) ist ein wichtiger Biomarker, der die Wiederherstellung der UL-Funktion nach Schlaganfall5,8,9,10,11,12vorhersagt. Der CST transportiert absteigende Motorleistung vom primären Motorkortex bis zum Rückenmark und ist für die Koordination und Feinmotorik unerlässlich. Patienten mit einem funktionellen CST nach einem Schlaganfall sind wahrscheinlicher, Kraft, Koordination und Geschicklichkeit wiederzuerlangen als Patienten ohne. Eine klinische Bewertung kann ausreichen, um zu bestätigen, dass das CST bei leicht behinderten Patienten13,14,15funktionsfähig ist. Jedoch, Patienten mit schwereren Anfänglichen Beeinträchtigung kann oder auch nicht eine funktionelle CST haben, und eine neurophysiologische Bewertung mit transkraniellen magnetischen Stimulation (TMS) wird benötigt9,10,11,16,17.
TMS ist eine nichtinvasive und schmerzlose Technik, die verwendet werden kann, um CST-Funktion18zu testen. Die TMS-Spule liefert einen magnetischen Stimulus über den primären motorischen Kortex, der einen absteigenden Volley im CST erzeugt und ein motorisch evoziertes Potential (MEP) in den Muskeln der kontralateralen Extremität19auslöst. Das Vorhandensein eines MEP im paretischen Arm oder der paretischen Hand (MEP+) weist auf einen funktionellen CST hin und ist mit einem größeren Potenzial für die Wiederherstellung der UL-Funktion verbunden. Patienten, die MEP- sind am ehesten eine schlechtere UL-Erholung haben, ohne Rückkehr der koordinierten und geschickten Handfunktion4,6,9,12,16.
Die Untersuchung aller Patienten mit TMS ist unpraktisch und unnötig, da Patienten mit leichter Anfangsbeeinträchtigung höchstwahrscheinlich eine funktionelle CST17haben. Daher ist ein hierarchischer Ansatz erforderlich, so dass TMS nur für Patienten mit schwererer Anfangsbeeinträchtigung angewendet wird. Der PREP2-Algorithmus wurde mit einer Kombination aus klinischen Maßnahmen und TMS entwickelt, um die CST-Funktion zu bewerten und das wahrscheinliche UL-Ergebnis nach 3 Monaten nach dem Schlaganfall vorherzusagen (Abbildung 1)17. PREP2 beginnt am Tag 3 nach dem Schlaganfall, indem die Stärke der Schulterentführung und Fingerverlängerung im paretischen Arm (SAFE-Score) unter Verwendung von Noten des Medical Research Council getestet wird. Wenn die Summe dieser Noten 5 oder mehr von 10 ist, ist es “sicher”, davon auszugehen, dass der Patient MEP+ ist. Von diesen Patienten wird erwartet, dass sie je nach Alter von17Jahren bis zu 3 Monate nach dem Schlaganfall ein gutes oder ausgezeichnetes UL-Ergebnis haben. Diese Patienten benötigen kein TMS, um den MEP-Status zu bestimmen, wodurch kostendeckend und unnötige Tests für den Patienten minimiert werden.
Patienten mit einem SAFE-Score von weniger als 5 am Tag 3 nach dem Schlaganfall benötigen TMS, um die funktionelle Integrität ihres CST zu bestimmen. Wenn ein MEP aus der paretischen Extensor-Carpi-Radialis (ECR) oder den ersten dorsalen Interosseus-Muskeln (FDI) entlockt werden kann, ist der Patient MEP+ und wird voraussichtlich nach 3 Monaten nach dem Schlaganfall die Feinmotorik der Hand wiederherstellen. Ungefähr die Hälfte der Patienten mit einem SAFE-Score unter 5 am Tag 3 nach dem Schlaganfall sind MEP+. Wichtig ist, dass Patienten einen SAFE-Score bis Null haben und MEP+ sein können. Dies verdeutlicht die Notwendigkeit von TMS in dieser Untergruppe von Patienten, da die klinische Bewertung allein nicht zwischen Patienten mit und ohne funktionellem CST unterscheiden kann. Patienten, die MEP sind, haben erhebliche CST-Schäden. Es wird erwartet, dass diese Patienten je nach Gesamtschwere des Schlaganfalls ein begrenztes oder schlechtes UL-Funktionsergebnis haben, gemessen mit dem National Institute of Health Stroke Scale (NIHSS) (Abbildung 1)17. Von diesen MEP-Patienten wird nicht erwartet, dass sie eine koordinierte und geschickte Fingerkontrolle wiedererlangen und zu Forschungszwecken gruppiert werden können.
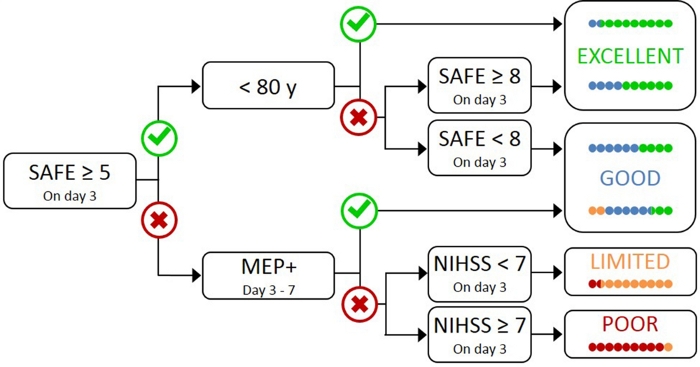
Abbildung 1: Der PREP2-Algorithmus. SAFE = Schulterentführung, Fingerextension Score, die die Summe der Medizinischen Forschungsratsnoten für jede dieser Bewegungen von 5 ist, für eine Gesamtnote SAFE von 10. MEP+ = Motor Evoked Potentials können aus den paretischen Extensor-Carpi-Radialis (ECR) und/oder den ersten dorsalen Interossen(FDI) Muskeln der paretischen UL mit transkranieller Magnetstimulation entlockt werden. NIHSS = National Institutes of Health Stroke Scale. Der Algorithmus sagt eines von vier möglichen UL-Funktionsergebnissen nach 3 Monaten nach dem Schlaganfall voraus. Jede Vorhersagekategorie ist mit einem Rehabilitationsschwerpunkt verbunden, der für die Anpassung der UL-Therapie2verwendet werden kann. Die farbigen Punkte stellen proportional die Genauigkeit des PREP2-Algorithmus dar. Die Punkte sind farbkodiert basierend auf der Ergebniskategorie, die tatsächlich 3 Monate nach dem Schlaganfall erreicht wurde (Grün = Ausgezeichnet; Blau = Gut; Orange = Begrenzt; Rot = Schlecht). Abbildung reproduziert von Stinear et al.17. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
In der klinischen Praxis sagt PREP2 eine von vier Ergebniskategorien voraus, die verwendet werden können, um die Rehabilitation für einzelne Patienten zu maßschneidern und Patienten und Familien zu helfen, zu verstehen, was sie für ihre UL-Wiederherstellung erwarten können. Bis heute ist PREP2 das einzige extern validierte UL-Vorhersagetool, das klinische Bewertung und Biomarkerinformationen in einem Entscheidungsbaum17kombiniert. Es ist auch das einzige UL-Vorhersageinstrument mit Forschung über die Auswirkungen der Umsetzung in der klinischen Praxis20,21. PREP2-Prognosen sind für etwa 75% der Patienten genau, zu optimistisch für 17% und zu pessimistisch für 8% der Patienten nach 3 Monaten nach dem Schlaganfall17. Die Genauigkeit ist für MEP-Patienten am höchsten (genau für 90% der MEP-Patienten), wobei der Wert der Verwendung von TMS zur Identifizierung dieser Patienten mit schweren Schäden an den absteigenden motorischen Wegen17hervorgehoben wird. PREP2 bleibt bei ca. 80% der Patienten nach 2 Jahren nach dem Schlaganfall22korrekt. Dies unterstützt den Einsatz von PREP2 zur Vorhersage der ul-Funktionsmotorergebnisse nach 3 Monaten und längerfristig. Informationen über die Bereitstellung von PREP2-Vorhersagen und deren Verwendung in der klinischen Praxis fallen nicht in den Anwendungsbereich dieses Methodenpapiers, detaillierte Ressourcen sind jedoch online verfügbar23.
PREP2 bietet Forschern ein Werkzeug, um Patienten für klinische Studien auszuwählen und zu schichten. Auf diese Weise können Patienten nicht nur nach klinischen Ausgangsmerkmalen gruppiert werden, sondern auch nach ihrem neurobiologischen Potenzial für die UL-Wiederherstellung. Trotz der zunehmenden Beweise für die Verwendung von TMS als prognostischem Biomarker für die UL-Wiederherstellung kann mangelnde Vertrautheit mit TMS-Protokollen in Krankenhausumgebungen mit subakuten Schlaganfallpatienten ein Hindernis für seine Verwendung in der Forschung sein. Daher soll dieses Protokoll zeigen, wie der SAFE-Score und TMS zur Bewertung der CST-Funktion bei Patienten in einem Krankenhaus frühzeitig nach einem Schlaganfall verwendet werden können.
Protocol
Representative Results
Discussion
Die mit MEP-Status ausgewertete CST-Funktion ist ein wichtiger prognostischer Biomarker für die UL-Wiederherstellung und das Ergebnis nach einem Schlaganfall. Insgesamt 95% der Patienten mit einem funktionellen CST bei 1 Woche Nachschlag erreichen einen Action Research Arm Test (ARAT) Score von mindestens 34 von 57 durch 3 Monate poststroke17. Umgekehrt erreichen 100% der Patienten ohne funktionelles CST nach 1 Woche nach dem Schlaganfall einen ARAT-Score von weniger als 34 bis 3 Monaten nach dem…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren danken Professor Winston Byblow und Harry Jordan für ihren wertvollen Beitrag zu dieser Arbeit. Diese Arbeit wurde vom Health Research Council of New Zealand finanziert.
Materials
| alcohol/skin cleansing wipes | Reynard | alcohol prep pads | |
| electromyography electrodes | 3M | red dot electrodes | |
| Magstim TMS coil | Magstim | flat figure-8 coil | |
| razors | any | ||
| skin prep tape | 3M | red dot skin prep tape | |
| TMS stimulator | Magstim | Magstim 200 single pulse stimulator |
References
- Veerbeek, J. M., Kwakkel, G., van Wegen, E. E., Ket, J. C., Heymans, M. W. Early prediction of outcome of activities of daily living after stroke: a systematic review. Stroke. 42 (5), 1482-1488 (2011).
- Lohse, K. R., Schaefer, S. Y., Raikes, A. C., Boyd, L. A., Lang, C. E. Asking New Questions with Old Data: The Centralized Open-Access Rehabilitation Database for Stroke. Frontiers in Neurology. 7, 153 (2016).
- Stinear, C., Ackerley, S., Byblow, W. Rehabilitation is initiated early after stroke, but most motor rehabilitation trials are not: a systematic review. Stroke. 44 (7), 2039-2045 (2013).
- Stinear, C. M. Prediction of recovery of motor function after stroke. Lancet Neurology. 9 (12), 1228-1232 (2010).
- Byblow, W. D., Stinear, C. M., Barber, P. A., Petoe, M. A., Ackerley, S. J. Proportional recovery after stroke depends on corticomotor integrity. Annals of Neurology. 78 (6), 848-859 (2015).
- Stinear, C. M. Prediction of motor recovery after stroke: advances in biomarkers. Lancet Neurology. 16 (10), 826-836 (2017).
- Kim, B., Winstein, C. Can Neurological Biomarkers of Brain Impairment Be Used to Predict Poststroke Motor Recovery? A Systematic Review. Neurorehabilitation and Neural Repair. 31 (1), 3-24 (2016).
- Boyd, L. A., et al. Biomarkers of stroke recovery: Consensus-based core recommendations from the Stroke Recovery and Rehabilitation Roundtable. International Journal of Stroke. 12 (5), 480-493 (2017).
- Escudero, J. V., Sancho, J., Bautista, D., Escudero, M., Lopez-Trigo, J. Prognostic value of motor evoked potential obtained by transcranial magnetic brain stimulation in motor function recovery in patients with acute ischemic stroke. Stroke. 29 (9), 1854-1859 (1998).
- Pennisi, G., et al. Absence of response to early transcranial magnetic stimulation in ischemic stroke patients: prognostic value for hand motor recovery. Stroke. 30 (12), 2666-2670 (1999).
- Rapisarda, G., Bastings, E., de Noordhout, A. M., Pennisi, G., Delwaide, P. J. Can motor recovery in stroke patients be predicted by early transcranial magnetic stimulation?. Stroke. 27 (12), 2191-2196 (1996).
- Bembenek, J. P., Kurczych, K., Karli Nski, M., Czlonkowska, A. The prognostic value of motor-evoked potentials in motor recovery and functional outcome after stroke – a systematic review of the literature. Functional Neurology. 27 (2), 79-84 (2012).
- Smania, N., et al. Active finger extension: a simple movement predicting recovery of arm function in patients with acute stroke. Stroke. 38 (3), 1088-1090 (2007).
- Nijland, R. H., van Wegen, E. E., Harmeling-van der Wel, B. C., Kwakkel, G. EPOS Investigators. Presence of finger extension and shoulder abduction within 72 hours after stroke predicts functional recovery: early prediction of functional outcome after stroke: the EPOS cohort study. Stroke. 41 (4), 745-750 (2010).
- Katrak, P., et al. Predicting upper limb recovery after stroke: the place of early shoulder and hand movement. Archives of Physical Medicine and Rehabilitation. 79 (7), 758-761 (1998).
- Stinear, C. M., Barber, P. A., Petoe, M., Anwar, S., Byblow, W. D. The PREP algorithm predicts potential for upper limb recovery after stroke. Brain. 135 (Pt 8), 2527-2535 (2012).
- Stinear, C. M., et al. PREP2: A biomarker-based algorithm for predicting upper limb function after stroke. Annals of Clinical and Translational Neurology. 4 (11), 811-820 (2017).
- Groppa, S., et al. A practical guide to diagnostic transcranial magnetic stimulation: report of an IFCN committee. Clinical Neurophysiology. 123 (5), 858-882 (2012).
- Barker, A. T., Jalinous, R., Freeston, I. L. Non-invasive magnetic stimulation of human motor cortex. Lancet. 1 (8437), 1106-1107 (1985).
- Stinear, C. M., Byblow, W. D., Ackerley, S. J., Barber, P. A., Smith, M. C. Predicting Recovery Potential for Individual Stroke Patients Increases Rehabilitation Efficiency. Stroke. 48 (4), 1011-1019 (2017).
- Connell, L. A., Smith, M. C., Byblow, W. D., Stinear, C. M. Implementing biomarkers to predict motor recovery after stroke. NeuroRehabilitation. 43 (1), 41-50 (2018).
- Smith, M. C., Ackerley, S. J., Barber, P. A., Byblow, W. D., Stinear, C. M. PREP2 Algorithm Predictions Are Correct at 2 Years Poststroke for Most Patients. Neurorehabilitation and Neural Repair. 33 (8), 635-642 (2019).
- Rossi, S., Hallett, M., Rossini, P. M., Pascual-Leone, A. Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research. Clinical Neurophysiology. 120 (12), 2008-2039 (2009).
- Talelli, P., Greenwood, R. J., Rothwell, J. C. Arm function after stroke: neurophysiological correlates and recovery mechanisms assessed by transcranial magnetic stimulation. Clinical Neurophysiology. 117 (8), 1641-1659 (2006).

