Utilisation de dispositifs d’assistance ventriculaire percutanée dans l’infarctus aigu du myocarde compliqué par un choc cardiogénique
Summary
Les dispositifs d’assistance ventriculaire percutanée sont de plus en plus utilisés chez les patients atteints d’infarctus aigu du myocarde et de choc cardiogénique. Ici, nous discutons du mécanisme d’action et des effets hémodynamiques de tels dispositifs. Nous passons également en revue les algorithmes et les meilleures pratiques pour l’implantation, la gestion et le sevrage de ces dispositifs complexes.
Abstract
Le choc cardiogénique est défini comme une hypotension persistante, accompagnée de signes d’hypo-perfusion de l’organe final. Les dispositifs d’assistance ventriculaire percutanée (PVAD) sont utilisés pour le traitement du choc cardiogénique dans le but d’améliorer l’hémodynamique. Impella est actuellement le PVAD le plus courant et pompe activement le sang du ventricule gauche dans l’aorte. Les PVAD déchargent le ventricule gauche, augmentent le débit cardiaque et améliorent la perfusion coronaire. Les PVAD sont généralement placés dans le laboratoire de cathétérisme cardiaque sous guidage fluoroscopique via l’artère fémorale lorsque cela est possible. En cas de maladie artérielle périphérique grave, les PVAD peuvent être implantés par un autre accès. Dans cet article, nous résumons le mécanisme d’action du PVAD et les données soutenant leur utilisation dans le traitement du choc cardiogénique.
Introduction
Le choc cardiogénique (CS) est défini comme une hypotension persistante (pression artérielle systolique , ou besoin de vasopresseurs ou d’inotropes), hypo-perfusion des organes terminaux (débit urinaire 2 mmol/L), congestion pulmonaire (pression du coin capillaire pulmonaire (PCWP) ≥ 15 mmHg) et diminution des performances cardiaques (indice cardiaque <2,2 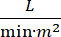 )1, 2 en raison d’un trouble cardiaque primaire. L’infarctus aigu du myocarde (IAM) est la cause la plus fréquente de CS3. Le CS survient dans 5 à 10 % des AMI et a toujours été associé à une mortalité importante3,4. Les dispositifs de soutien circulatoire mécanique (MCS) tels que la pompe à ballonnet intra-aortique (IABP), les dispositifs d’assistance ventriculaire percutanée (PVAD), l’oxygénation par membrane extracorporelle (ECMO) et les dispositifs percutanés auriculaires gauches à aortiques sont fréquemment utilisés chez les patients atteints de CS5. L’utilisation systématique de l’IABP n’a démontré aucune amélioration des résultats cliniques ou de la survie dans AMI-CS1. Compte tenu des mauvais résultats associés à l’AMI-CS, des difficultés à mener des essais dans l’AMI-CS et des résultats négatifs de l’utilisation de l’IABP dans l’AMI-CS, les cliniciens se tournent de plus en plus vers d’autres formes de MCS.
)1, 2 en raison d’un trouble cardiaque primaire. L’infarctus aigu du myocarde (IAM) est la cause la plus fréquente de CS3. Le CS survient dans 5 à 10 % des AMI et a toujours été associé à une mortalité importante3,4. Les dispositifs de soutien circulatoire mécanique (MCS) tels que la pompe à ballonnet intra-aortique (IABP), les dispositifs d’assistance ventriculaire percutanée (PVAD), l’oxygénation par membrane extracorporelle (ECMO) et les dispositifs percutanés auriculaires gauches à aortiques sont fréquemment utilisés chez les patients atteints de CS5. L’utilisation systématique de l’IABP n’a démontré aucune amélioration des résultats cliniques ou de la survie dans AMI-CS1. Compte tenu des mauvais résultats associés à l’AMI-CS, des difficultés à mener des essais dans l’AMI-CS et des résultats négatifs de l’utilisation de l’IABP dans l’AMI-CS, les cliniciens se tournent de plus en plus vers d’autres formes de MCS.
Les PVAD sont de plus en plus utilisés chez les patients atteints d’AMI-CS6. Dans cet article, nous allons concentrer notre discussion principalement sur l’Impella CP, qui est le PVAD le plus couramment utilisé actuellement6. Ce dispositif utilise une pompe à vis d’Archimède à flux axial qui propulse activement et continuellement le sang du ventricule gauche (LV) dans l’aorte ascendante(Figure 1). Le dispositif est le plus souvent placé dans le laboratoire de cathétérisme cardiaque sous guidage fluoroscopique via l’artère fémorale. Alternativement, il peut être implanté par un accès axillaire ou transcaval si nécessaire7,8.
Protocol
Representative Results
Discussion
Minimiser les risques et les complications de la PVAD (Tableau 2)
Les avantages hémodynamiques de la PVAD peuvent être considérablement neutralisés si des complications de l’accès de gros calibre se produisent, telles que des saignements majeurs et une ischémie aiguë des membres28,29. Il est donc essentiel de minimiser les risques et les complications de l’appareil.
Afin de réduire les complications du s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Aucun
Materials
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
References
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d’intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O’Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O’neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).

