Использование чрескожных желудочковых вспомогательных устройств при остром инфаркте миокарда, осложненном кардиогенным шоком
Summary
Чрескожные желудочковые вспомогательные устройства все чаще используются у пациентов с острым инфарктом миокарда и кардиогенным шоком. Здесь мы обсуждаем механизм действия и гемодинамические эффекты таких устройств. Мы также рассматриваем алгоритмы и лучшие практики для имплантации, управления и отъема этих сложных устройств.
Abstract
Кардиогенный шок определяется как стойкая гипотензия, сопровождающаяся признаками гипоперфузии конечных органов. Чрескожные желудочковые вспомогательные устройства (ПВАД) используются для лечения кардиогенного шока в целях улучшения гемодинамики. Импелла в настоящее время является наиболее распространенной PVAD и активно перекачивает кровь из левого желудочка в аорту. ПВАД разгружают левый желудочек, увеличивают сердечный выброс и улучшают коронарную перфузию. ПВАД обычно помещают в лабораторию катетеризации сердца под флюороскопическим руководством через бедренную артерию, когда это возможно. В случаях тяжелого заболевания периферических артерий ПВАД могут быть имплантированы через альтернативный доступ. В данной статье мы обобщим механизм действия PVAD и данные, подтверждающие их применение при лечении кардиогенного шока.
Introduction
Кардиогенный шок (КС) определяется как стойкая гипотензия (систолическое артериальное давление 30 минут, или потребность в вазопрессорах или инотропах), гипоперфузия конечного органа (диурез 2 ммоль/л), застой в легких (легочное капиллярное клиновое давление (PCWP) ≥ 15 мм рт.ст.) и снижение сердечной деятельности (сердечный индекс <2,2) 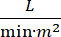 1, 2 из-за первичного сердечного расстройства. Острый инфаркт миокарда (ОИМ) является наиболее распространенной причиной CS3. КС встречается в 5-10% ОИМ и исторически была связана со значительной смертностью3,4. Устройства механической поддержки кровообращения (MCS), такие как внутриаортальный баллонный насос (IABP), чрескожные желудочковые вспомогательные устройства (PVAD), экстракорпоральная мембранная оксигенация (ЭКМО) и чрескожные левые предсердные до аортальных устройств, часто используются у пациентов с CS5. Рутинное применение IABP не продемонстрировало улучшения клинических результатов или выживаемости в AMI-CS1. Учитывая плохие результаты, связанные с AMI-CS, трудности в проведении испытаний в AMI-CS и отрицательные результаты использования IABP при AMI-CS, клиницисты все чаще обращаются к другим формам MCS.
1, 2 из-за первичного сердечного расстройства. Острый инфаркт миокарда (ОИМ) является наиболее распространенной причиной CS3. КС встречается в 5-10% ОИМ и исторически была связана со значительной смертностью3,4. Устройства механической поддержки кровообращения (MCS), такие как внутриаортальный баллонный насос (IABP), чрескожные желудочковые вспомогательные устройства (PVAD), экстракорпоральная мембранная оксигенация (ЭКМО) и чрескожные левые предсердные до аортальных устройств, часто используются у пациентов с CS5. Рутинное применение IABP не продемонстрировало улучшения клинических результатов или выживаемости в AMI-CS1. Учитывая плохие результаты, связанные с AMI-CS, трудности в проведении испытаний в AMI-CS и отрицательные результаты использования IABP при AMI-CS, клиницисты все чаще обращаются к другим формам MCS.
ПВАД все чаще используются у пациентов с AMI-CS6. В этой статье мы сосредоточим наше обсуждение в первую очередь на Impella CP, который является наиболее распространенным PVAD, используемым в настоящее время6. В этом устройстве используется осевой винтовой насос Архимеда, который активно и непрерывно продвигает кровь из левого желудочка (LV) в восходящую аорту(рисунок 1). Аппарат чаще всего помещается в лабораторию катетеризации сердца под флюороскопическим контролем через бедренную артерию. Альтернативно, он может быть имплантирован через подмышечный или транскавальный доступ принеобходимости7,8.
Protocol
Representative Results
Discussion
Минимизация рисков и осложнений PVAD (Таблица 2)
Гемодинамические преимущества PVAD могут быть значительно нейтрализованы, если возникают осложнения от доступа с большим отверстием, такие как сильное кровотечение и острая ишемия конечностей28,29. Т…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Никакой
Materials
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
References
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d’intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O’Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O’neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).

