Nano Ölçekli Malzemelerin Zaman-Evrimini Durdurulmuş Akış ve Küçük Açılı Nötron Saçılması ile Ölçme
Summary
Bu protokol, küçük açılı nötron saçılma ölçümü sırasında birden fazla sıvı çözeltisini yerinde hızlı bir şekilde karıştırmak ve nanometre uzunluk ölçeklerinde ve ikinci zaman ölçeklerinde kinetik süreçleri incelemek için durdurulmuş akışlı bir numune ortamının kullanımını sunar.
Abstract
Bu makale, sıvı numuneleri hızlı bir şekilde karıştırmak ve nano ölçekli kinetik süreçleri saniyeler ila dakikalar arasındaki zaman ölçeklerinde incelemek için durdurulmuş akışlı küçük açılı nötron saçılması (SANS) numune ortamının kullanımını sunmaktadır. Durdurulmuş akışlı numune ortamı, istenen hacimlerde sıvı numuneleri karıştırmak için piyasada satılan şırınga pompalarını kullanır ve bunlar daha sonra dinamik bir karıştırıcıdan yaklaşık 1 sn içinde bir kuvars cam hücresine enjekte edilir. Zaman çözümlü SANS veri toplama, karıştırmadan sonra çözeltideki nanoyapının evrimini takip etmek için numune karıştırma ile senkronize edilir.
Nötron ışını zamanını en verimli şekilde kullanmak için, ölçümler arasında hücreyi otomatik olarak yüklemek, durulamak ve kurutmak için bir dizi akış seçici valf kullanıyoruz ve bu da birden fazla numune enjeksiyonu boyunca tekrarlanan veri toplanmasına izin veriyor. Yeterli nötron saçılma istatistikleri toplanana kadar numune enjeksiyonları tekrarlanır. Karıştırma kurulumu, farklı karıştırma oranlarında, numune konsantrasyonlarında, katkı konsantrasyonlarında ve sıcaklıklarda kinetiği ölçmek için koşulları sistematik olarak değiştirecek şekilde programlanabilir. Enjeksiyon başına gereken minimum numune hacmi, kuvars hücresinin yol uzunluğuna bağlı olarak yaklaşık 150 μL’dir.
Bu durdurulmuş akışlı numune ortamını kullanan temsili sonuçlar, bir katkı maddesi, siklodekstrin varlığında hızlı lipit değişim kinetiği için sunulmuştur. Veziküller, dış broşür (dış) lipitleri saniyeler içinde değiştirir ve saatler içinde hem iç hem de dış lipitleri tamamen değiştirir. Lipid değişim kinetiğinin ölçülmesi, daha hızlı (saniye) ve daha yavaş (dakika) süreçleri yakalamak ve kinetik hız sabitlerini çıkarmak için yerinde karıştırma gerektirir. Aynı numune ortamı, lipit nanopartikülleri, proteinler, yüzey aktif maddeler, polimerler, emülsiyonlar veya inorganik nanopartiküller gibi diğer sıvı numune türlerinde moleküler değişimi araştırmak için de kullanılabilir. Nano ölçekli yapısal dönüşümleri ve değişim veya reaksiyona giren sistemlerin kinetiğinin ölçülmesi, nano ölçekte gelişen süreçlere yeni bakış açıları sağlayacaktır.
Introduction
Küçük açılı nötron saçılması (SANS), çeşitli malzemelerin boyutlarını, şekillerini, etkileşimlerini ve organizasyonlarını ≈1 nm ila ≈100 nm 1,2,3 arasındaki uzunluk ölçeklerinde ölçmek için benzersiz bir yol sağlar. Odaklama aynalı VSANS (çok küçük açılı nötron saçılımı) cihazları da dahil olmak üzere yeni cihazlar, ≈1000 nm 4,5’e kadar daha büyük uzunluktaki ölçekleri ölçmeye yönelik sınırları zorlamaktadır. Genel olarak, nötron saçılma yöntemlerine özgü benzersiz saçılma kontrastı, farmasötik formülasyonlardaki bileşenlerin toplanması6, polimer sistemlerde çapraz bağlanma ve jelasyon reaksiyonları7,8, membran proteinlerinin mezo kristalizasyonunda 9,10, proteinlerin parçalanması ve açılması11,12 gibi nano ölçekli yapıların zaman evrimini ölçmede çeşitli avantajlar sunar ve silika bazlı malzemelerin büyümesi13,14,15. Benzersiz saçılma kontrastı, zaman çözümlü SANS’I (TR-SANS) diğer durdurulmuş akış tabanlı ölçümler için kullanışlı bir tamamlayıcı haline getirir.
Durdurulmuş akışlı karıştırma yöntemleri genellikle küçük açılı X-ışını saçılması (SAXS)16,17,18,19,20,21, floresan spektroskopisi 22,23,24,25,26 ve ışık saçılması 27,28,29,30, Kinetik süreçleri milisaniye zaman ölçeklerinde incelemek için 31,32 deney. SANS ve SAXS arasındaki önemli bir fark, nötron saçılmasının tahribatsız bir karakterizasyon tekniği olmasıdır ve bu nedenle, SANS, aynı numuneyi, numuneye iyonlaştırıcı radyasyon hasarı vermeden saatlerce hatta günlerce ölçmek için kullanılabilir; bu, daha yüksek akılı X-ışını saçılma deneyleri sırasında meydana gelebilir33. Tekrarlanan SANS ölçümleri prob molekülünün veya numunenin kimyasal yapısını değiştirmeyeceğinden, zaman evrimi, örneğin floresan23,24’e dayanan kinetik ölçümleri zorlaştırabilecek fotobeyazlatmanın etkileri olmadan incelenebilir. Dahası, SANS, dinamik ışık saçılması gibi ışığa dayalı tekniklerle karakterize edilmesi genellikle zor olan yüksek konsantrasyonlu ve optik olarak opak numuneleri ölçmek için kullanılabilir.
Nano ölçekte yapısal bilgi sağlamanın yanı sıra, SANS, nötron saçılma uzunluğu yoğunluk kontrastındaki varyasyon yoluyla bu yapıların yerel bileşimini araştırmak için kullanılabilir. Farklı elementlerin saçılma uzunluğu yoğunluğu (SLD) periyodik tablo boyunca rastgele değişir ve aynı elementin farklı izotoplarına göre değişir. Yaygın olarak kullanılan bir örnek, çok farklı nötron saçılma uzunluklarına sahip olan hidrojen (1H veya H) ve döteryumdur (2H veya D). Bu nedenle, yüzey aktif maddeler, lipitler, proteinler, RNA, DNA ve diğer polimerler gibi hidrojen bakımından zengin malzemeler, sistemin fiziksel özelliklerini önemli ölçüde değiştirmeden SANS kullanılarak deuterated çözücülerden ayırt edilebilir. Bununla birlikte, H / D değişiminin numunedeki yoğunluğu, hidrojen bağını ve faz geçiş sıcaklıklarını etkileyebileceğini belirtmek önemlidir. Bununla birlikte, SANS’ın hidrojen bakımından zengin malzemelere karşı benzersiz duyarlılığı, özellikle ilgilenilen numunelerin SAXS gibi X-ışını tabanlı tekniklerde daha düşük saçılma kontrastına ve sinyaline sahip olduğu yumuşak madde araştırmalarında yararlıdır. İzotopik ikame aynı zamanda SANS’ı, H etiketli ve D etiketli molekülleri karıştırarak hidrojen bakımından zengin malzemelerdeki moleküler değişim kinetiği incelemek için güçlü bir araç haline getirir. İzotopik ikame, hacimli floresan boyaların ilgilenilen yüzey aktif madde veya lipit moleküllerinden daha büyük olduğu ve değişim kinetiğini etkileyebileceği sistemlerde özellikle yararlıdır34,35.
Zaman çözümlü SANS ölçümleri avantajlıdır çünkü ölçülen yoğunluk zaman, uzunluk ölçeği ve SLD kontrastının bir fonksiyonudur. Bu nedenle, TR-SANS deneyleri, mekansal dağılımlardaki ve örneklerin kompozisyonlarındaki zamana bağlı değişiklikleri araştırmak için tasarlanabilir. SANS’ın bu benzersiz avantajları, yüzey aktif maddeler 36,37,38, emülsiyonlar39,40,41, lipitler 34,42,43,44,45,46,47,48,49 gibi birçok yumuşak malzeme sisteminde kinetik süreçler hakkında önemli bilgiler edinmiştir ,50 ve polimerler 51,52,53,54,55,56,57,58,59,60,61,62. TR-SANS çalışmalarının çoğu, dakikalar ila saatler arasındaki zaman ölçeklerine odaklanmıştır. Bununla birlikte, ilgilenilen birçok kinetik süreç ikinci zaman ölçeğinde meydana gelir ve altta yatan mekanizmaları anlamak için gereklidir. Bu erken zaman noktalarının yakalanması, çözeltilerin hızlı bir şekilde karıştırılmasını ve yerinde ölçülmesini gerektirir; burada karıştırma, durdurulmuş akışlı ışık saçılması 27,28,29,30,31,32, floresan 22,23,24,25,26 ve X-ışını sırasında veri toplama ile senkronize edilir 16,17,18,19,20,21 deney. Bu çalışma, TR-SANS ölçümleri için birden fazla sıvı numuneyi hızlı bir şekilde karıştırmak ve karışımı bir kuvars cam hücresine enjekte etmek için tasarlanmış bir numune ortamının kullanımını açıklamaktadır. Karıştırma cihazı, yakın zamanda geliştirilen kılcal reoSANS cihazı63’ün bir uyarlamasıdır ve numune karıştırmayı kontrol etmek ve hücre temizliğini otomatikleştirmek için birden fazla şırınga pompası ve valfi kullanır. Şırınga pompalarını bir dizi akış seçici vanaya bağlayarak, TR-SANS ölçümlerini saniye zaman ölçeğinde kolaylaştırmak için birden fazla giriş akışı tekrar tekrar karıştırılabilir, ölçülebilir, durulanabilir ve kurutulabilir.
Mevcut prosedür, ilgilenilen örneklerin tanımlandığını ve hazırlandığını varsaymaktadır. TR-SANS verilerini toplamak için yerinde karıştırma kurulumuna ve yöntemlerine odaklanıyoruz. Nötron saçılma verileri, NIST Nötron Araştırma Merkezi’ndeki (NCNR) VSANS cihazında toplandı; ancak, prosedür diğer SANS cihazlarına uygulanabilir olmalıdır. Benzer protokolleri diğer SANS cihazlarına uygulamak isteyen okuyucular, ilgilenilen kinetik süreçlerle en alakalı istenen uzunluk ölçeğinde ve zaman ölçeğinde nötron akısını en üst düzeye çıkarmak için en uygun cihaz konfigürasyonunu belirlemek için yerel cihaz bilim insanlarına danışmalıdır. Burada sunulan veriler, uzamsal çözünürlük5 kaybında nötron sayımlarını en üst düzeye çıkarmak için VSANS üzerindeki yüksek akı ‘beyaz ışın’ konfigürasyonu kullanılarak toplanmıştır. Dedektör taşıyıcıları, ≈130 nm ila ≈13 nm uzunluk ölçeklerine karşılık gelen 0,005 Å-1 < q < 0,5 Å-1 aralığındaki bir dizi saçılma vektörünü (q) kapsayacak şekilde konumlandırılmıştır. Saçılma vektörü, q = 4π / λ günah (θ / 2) olarak tanımlanır; burada λ, nötron dalga boyu ve θ, saçılma açısıdır.
TR-SANS ölçümleri için kullanılan durdurulmuş akışlı karıştırma cihazı, Şekil 1’de görüldüğü gibi birden fazla pompa, durulama şırıngası, numune şırıngası, akış seçicilerin yanı sıra adinamik karıştırıcı, numune hücresi ve karışık numune kabından oluşmaktadır. Tüm sızdırmaz sıvı yolları, şırıngaları, vanaları, bağlantı borularını, dinamik karıştırıcıyı ve numune hücrelerini içeren klimalı bir muhafazanın içine yerleştirilmiştir. Muhafaza sıcaklığını ±1 °C içinde 10 °C ila 50 °C aralığında kontrol etmek için programlanabilir bir termoelektrik klima kullanılır. Cihazın çalışan parçalarını göstermek için muhafaza yalıtımının bir kısmının kaldırıldığını unutmayın. Ana karıştırma cihazı muhafazası, NCNR’deki NG3 VSANS ışın hattındaki bir çeviri aşamasına yerleştirilmiştir. Muhafaza konumu, numune hücresini nötron ışınının yoluna (sarı kesikli çizgi) yerleştirmek için çeviri aşaması kullanılarak ayarlanır.

Şekil 1: NIST Nötron Araştırma Merkezi’ndeki VSANS ışın hattında durdurulmuş akışlı karıştırma ve küçük açılı nötron saçılma ölçümlerini birleştirmek için örnek bir kurulum. Kurulumda dört şırınga pompası, solvent durulama için iki şırınga ve numune enjeksiyonu için iki şırınga, dört pompa seçici valf, iki karıştırıcı seçici valf, bir dinamik karıştırıcı, bir akışlı kuvars hücresi ve bir karışık numune kabı bulunur. Gelen nötronlar, numune hücresinin içinde bulunan karışık numuneyi saçar. Kuvars pencereli yalıtımlı bir muhafaza ve termoelektrik klimalı bir ünite, numuneyi ve tüm ekipmanı sabit bir sıcaklıkta kontrol etmek için kullanılır. Sarı kesikli çizgi nötron ışını yolunu gösterir. Ölçek çubuğu = 10 cm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Şekil 1’de gösterilen cihaz, iki numune şırıngası, iki durulama şırıngası ve bir numune hücresi ile yapılandırılmıştır. Protokolün farklı adımları için karşılık gelen akış diyagramları Şekil 2’de gösterilmiştir. İki farklı numunenin istenilen hacimleri miksere ve numune hücresine enjekte edilir (Şekil 2A). Numune hücresi doldurulduktan sonra, numune hücresini dinamik karıştırıcıdan izole etmek ve TR-SANS veri toplama sırasında numunenin hücreye geri difüzyonunu önlemek için Giriş Anahtar Vanası (ISV) ve Çıkış Anahtar Vanası (OSV) kapatılır (Şekil 2B). Dinamik karıştırıcıdan önce, bağlantı borusunun uzunluğu 10 cm ila 1 m arasında değişir ve karıştırma gecikme süresini etkilemez. Bununla birlikte, dinamik karıştırıcı ile numune hücresi arasındaki boru bağlantıları, karıştırma gecikme süresini ve gerekli numune enjeksiyon hacmini etkileyecektir. Dinamik karıştırıcıyı, Mikser Seçici Vanaları (MSV1 ve MSV2) ve ISV ve OSV’yi bağlamak için 0,04 inç (1 mm) iç çapa ve 100 mm uzunluğa sahip önceden kesilmiş paslanmaz çelik borular kullanılır. ISV ve OSV’yi (veya dinamik karıştırıcı çıkışını) numune hücresine bağlamak için 1 mm iç çapa ve 115 mm uzunluğa sahip florlu boru kullanılır. Karıştırma gecikme süresini etkileyen toplam boşluk hacmi, mikser boşluk hacmini (0,15 mL), karıştırıcı çıkışı ile numune hücresi girişi arasındaki boruyu (0,09 mL) ve numune hücresi hacmini (0,16 mL) içerir. Bu örnekte, toplam boşluk hacmi 0,4 mL’dir. Vanaların iç boşluk hacimleri, boru, karıştırıcı ve numune hücresi boşluk hacimlerine kıyasla ihmal edilebilir. Örneğin, kullanılan düşük basınçlı seçici valfler (0,75 mm delik çapı) yaklaşık 4 μL’lik boşluk hacimleri içerirken, yüksek basınçlı seçici valfler ve anahtar valfleri (0,25 mm delik çapı) yaklaşık 0,5 μL’lik boşluk hacimleri içerir.
TR-SANS ölçümü tamamlandıktan sonra, numune çözücü ile hücre dışına itilir ve artık numuneyi çıkarmak ve numune hücresini temizlemek için durulama çözücüsü hücre içinden tekrar tekrar pompalanır (Şekil 2C). Durulama şırıngalarının, ölçüm çalışmaları arasında numune hücresini temizlemek için yeterli çözücü hacminin mevcut olduğundan emin olmak için pompa seçici değerleri aracılığıyla daha büyük çözücü rezervuarlarına (örn. su ve etanol) bağlandığını unutmayın. Solvent kaynakları, numune kaynakları ve yanıcı sıvılar içeren karışık numune kapları, olası tüm ateşleme kaynaklarını ortadan kaldırmak için elektrikli ekipman içermeyen ayrı bir muhafazaya yerleştirilir. Ek olarak, yanıcı buharları ve çözücü buharlaşmasını en aza indirmek için buhar kilitlemeli şişe kapakları kullanılır. Son olarak, artık durulama çözücüsünü uzaklaştırmak için numune hücresi bir azot gazı akışı ile kurutulur (Şekil 2D). Karıştırıcı seçici vanasına giriş azot gazı basıncı, azot gazı silindiri üzerinde bulunan manuel bir basınç regülatörü kullanılarak yaklaşık 2 bar’a (0,2 MPa, gösterge basıncı) ayarlanır. Numune hücresi yeterince temizlendikten ve kurutulduktan sonra, bir sonraki ölçüm döngüsü için numune hücresine yeni karıştırılmış bir numune enjekte edilir ( Şekil 2A’daki akış diyagramında gösterilen karıştırma ve enjeksiyonu tekrarlayarak).
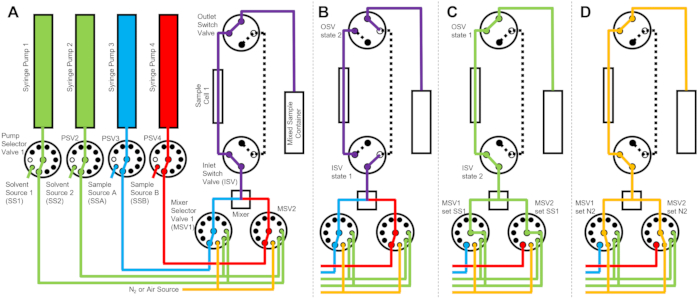
Şekil 2: Bir numune hücresi, iki numune karıştırma ve temizlik için iki durulama çözücüsü kullanan örnek akış diyagramı . (A) Numune A (mavi) ve numune B’nin (kırmızı) karıştırılması ve daha sonra karıştırılan numunenin (mor) numune hücresine akıtılması. (B) Veri toplama sırasında, numune hücresini izole etmek ve veri toplama sırasında numunenin geri yayılmasını önlemek için ISV ve OSV anahtar valflerinin kapatıldığı durdurulmuş akışlı cihaz durumu. (C) Veri toplandıktan sonra numune hücresinin SS1’den (yeşil) durulama çözücüsü ile durulandığı temizleme adımları. (D) Numune hücresinin azot gazı (turuncu) ile kurutulduğu kurutma adımı. Kısaltmalar: PSV = pompa seçici valf; MSV = mikser seçici vana; OSV = çıkış anahtar valfi; ISV = giriş anahtarı valfi; SS1 = çözücü kaynağı 1; SSA = örnek kaynak A; N2 = azot gazı kaynağı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Şekil 3, karıştırma kurulumunun aynı şalt vanalarına bağlı iki ayrı numune hücresiyle yapılandırıldığı biraz farklı bir versiyon için akış diyagramlarını göstermektedir (Şekil 3A). TR-SANS verileri Örnek Hücre 1’de toplanırken, Örnek Hücre 2 durulanır (Şekil 3B) ve kurutulur (Şekil 3C). Örnek Hücre 1 için veri toplama tamamlandığında, Giriş Anahtar Vanası yeni karıştırılmış bir numuneyi veri toplama için Örnek Hücre 2’ye yönlendirir (Şekil 3D). TR-SANS verileri Örnek Hücre 2’de toplanırken, Örnek Hücre 1 durulanır ve kurutulur (Şekil 3E). İki numune hücresi arasındaki bu alternatif, paralel işlem, sonraki numune enjeksiyonları arasındaki süreyi en aza indirir ve nötron ışını zamanının kullanımını en üst düzeye çıkarır.
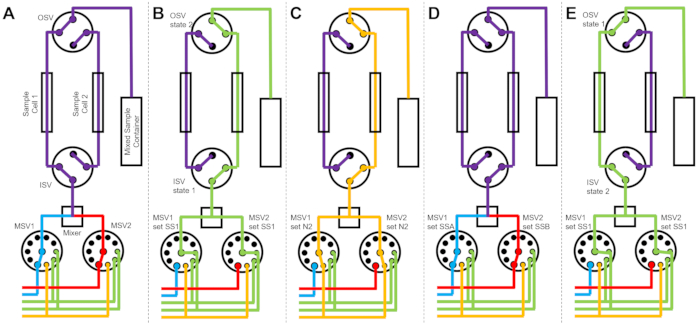
Şekil 3: İki numuneli hücre, iki numune karıştırma ve temizlik için iki durulama çözücüsü kullanan örnek akış diyagramı. (A) Numune A (mavi) ve numune B’nin (kırmızı) karıştırılması ve daha sonra karıştırılan numunenin (mor) numune hücre 1’e akıtılması. (B) Numune hücresi 2, SS1’den (yeşil) çözücü ile durulanırken, numune hücresi 1’de veri toplama sırasında durdurulan akış cihazı durumu. (C) Numune hücresi 1’de veri toplanması sırasında durdurulan akış cihazı durumu, numune hücresi 2 ise azot gazı (turuncu) ile kurutulur. (D) Örnek hücre 1’in veri toplanması tamamlandıktan sonra, yeni bir numune (mor) derhal karıştırılır ve numune hücresi 2’ye akar. (E) Numune hücresi 1, SS1’den (yeşil) çözücü ile durulanırken, numune hücresi 2’de veri toplama sırasında durdurulan akış cihazı durumu. Bir örnek hücre ölçülürken, diğer örnek hücre temizlenir ve kurutulur. Durdurulmuş akış ölçüm prosesi, sonraki numune karıştırma enjeksiyonları arasındaki süreyi en aza indirmek için iki numune hücresi arasında geçiş yapar. Kısaltmalar: PSV = pompa seçici valf; MSV = mikser seçici vana; OSV = çıkış anahtar valfi; ISV = giriş anahtarı valfi; SS1 = çözücü kaynağı 1; SSA = örnek kaynak A; N2 = azot gazı kaynağı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Pompaların ve boru hatlarının bağlanması, sistemin astarlanması, numune hücresinin durulanması ve kurutulması ve karışık numunenin enjekte edilmesi için adım adım bir protokol aşağıda açıklanmıştır. Tek hücreli konfigürasyon basitlik için gösterilse de (Şekil 2), esnek modüler kurulum, protokol ve komut dosyaları, Şekil 3’te gösterilen iki örnekli hücre konfigürasyonu gibi daha fazla şırınga pompası, vana, karıştırıcı veya numune hücre konfigürasyonu uygulamak için kolayca değiştirilebilir. Karıştırma ve temizleme enjeksiyon döngüleri boyunca toplanan temsili ham nötron sayım oranı verileri Şekil 4’te gösterilirken, 3 farklı sıcaklıkta ölçülen lipit değişim kinetiği ve değiştirilen lipitlerin fraksiyonuna karşılık gelen ekstrakte edilmiş normalize dağılmış yoğunluk sırasıyla Şekil 5 ve Şekil 6’da gösterilmiştir.
Protocol
Representative Results
Discussion
Mevcut prosedür, karıştırma cihazını ve durdurulmuş akışlı TR-SANS ölçümlerini gerçekleştirme adımlarını açıklamaktadır. Cihaz ve protokol, ilgilenilen zaman ölçeklerinin ≈1 s ila 5 dakika olduğu düşük viskoziteli sıvı numuneler için optimize edilmiştir. 5 dakikadan daha uzun zaman ölçekleri için, numunelerin manuel olarak karıştırılması ve standart saçılma hücrelerine yüklenmesi, özellikle yüksek viskoziteli numuneler, jeller veya macunlar için daha kolay ve arzu edilebili…
Disclosures
The authors have nothing to disclose.
Acknowledgements
NG3 VSANS’a erişim, DMR-2010792 sayılı Anlaşma kapsamında Ulusal Standartlar ve Teknoloji Enstitüsü ile Ulusal Bilim Vakfı arasındaki bir ortaklık olan Yüksek Çözünürlüklü Nötron Saçılma Merkezi tarafından sağlanmıştır. M.H.L.N, Mitacs Globalink (Kanada) tarafından sağlanan finansmanı kabul eder. Herhangi bir ticari ürünün veya ticari adın tanımlanması, anlayışı teşvik etmek içindir ve Ulusal Standartlar ve Teknoloji Enstitüsü tarafından onaylandığı veya tavsiye edildiği anlamına gelmez.
Materials
| Dynamic mixer | Analytical Scientific Instruments | 462-0150A | Magnetically coupled rotor, binary dynamic mixer assembly (ternary type available), 0.15 mL dead volume (larger dead volume available) |
| Fluoropolymer tubing | IDEX Health & Science | 1507L | PFA Tubing Natural 1/16 inch OD x 0.040 inch ID x 50 ft |
| Fluoropolymer 1/4-28 flangeless fittings | IDEX Health & Science | XP-245 | PFA flangeless fitting with ferrules, 1/4-28 threading, 1/16 inch OD tubing |
| Glass syringes | Hamilton Company | 81660 | Hamilton 1000 series syringes, 10 mL (81660), model 1010 C syr, 1/4"-28 thread termination, other volumes available |
| High-pressure flow selector valves | Vici Valco | C85X-1570EUTB | Vici 10 position selector valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure switch valves | Vici Valco | C82X-1574EUHB | Vici 4 port switch valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure syringes | Cetoni | A2019000358 | 3 mL stainless steel syringe, 510 bar max, 21 mL/min flow rate max |
| Low-pressure flow selector valves | Vici Valco | C25-3180EUHB | Vici 10 position selector valves, max 250 psi liquid, 0.75 mm bore, 1/16 inch OD tubing, 1/4-28 threaded ports, USB universal actuator |
| neMESYS high-pressure syringe pumps | Cetoni | A3921000103 | Max force 2600 N |
| neMESYS mid-pressure syringe pumps | Cetoni | A3921000131 | Max force 1000 N |
| Power supply | Cetoni | A3921000127 | Base 600, supplies power for up to 4 high pressure pumps |
| Quartz flow-through sample cell | Starna Scientific | 3-2.30-Q-1/TC | Quartz micro flow cells, 2 mm path length (1 mm available), 2 mm by 2 mm by 30 mm internal dimension |
| Quartz windows | Technical Glass Products | NA | GE 124 Clear fused quartz ground and polished plates, 11.75 inch by 23.75 inch by 0.375 inch thick |
| Stainless steel 10-32 coned compression fittings | IDEX Health & Science | U-321X, U-320X | 316 stainless steel ferrule (U-321X) and nut (U-320X) -Valco type, 10-32 coned, for 1/16 inch OD stainless steel tubing |
| Stainless steel tubing | IDEX Health & Science | U-102 | Stainless Steel Tubing 1/16 inch OD x 0.020 inch ID, 10 cm, various precut lengths available |
| Syringe pump control software | Cetoni | T6000000004 | QmixElements software for nemesys pumps, QmixSDK software development kit |
| Thermoelectric air conditioner | EIC Solutions | AAC-140C-4XT-HC | Thermoelectric air conditioner mounted on insulated enclosure to control the pump, valve, mixer, and sample temperature |
| T-slot railing | McMaster-Carr | 47065T103 | Aluminum t-slotted railing (1.5 inch by 1.5 inch) cut to various lengths |
| Vapor locking bottle caps | Cole-Parmer | EW-12018-02 | Four 304 SS port inserts, 1/4"-28 threads, GL45 bottle cap size, PTFE body, SS threads, PP collar |
References
- Melnichenko, Y. B., Wignall, G. D. Small-angle neutron scattering in materials science: Recent practical applications. Journal of Applied Physics. 102 (2), 021101 (2007).
- Grillo, I., Borsali, R., Pecora, R. Small-angle neutron scattering and applications in soft condensed matter. Soft Matter Characterization. , (2008).
- Hollamby, M. J. Practical applications of small-angle neutron scattering. Physical Chemistry Chemical Physics. 15 (26), 10566-10579 (2013).
- Pipich, V., Fu, Z. KWS-3: Very small angle diffractor with focusing mirror. Journal of large-scale research. 1, 31 (2015).
- Barker, J. G., Kline, S., et al. . 2019 NCNR Annual Report, Special Publication (NIST SP). , (2019).
- Gilbert, P. H., et al. Preservative induced polysorbate 80 micelle aggregation. Journal of Pharmaceutical Sciences. 10 (6), 2395-2404 (2021).
- Terashima, T., et al. In situ and time-resolved small-angle neutron scattering observation of star polymer formation via arm-linking reaction in ruthenium-catalyzed living radical polymerization. Macromolecules. 43 (19), 8218-8232 (2010).
- Hashimoto, K., Fujii, K., Nishi, K., Shibayama, M. Ion gel network formation in an ionic liquid studied by time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 122 (40), 9419-9424 (2018).
- Conn, C. E., et al. Membrane protein structures in lipid bilayers; small-Angle neutron scattering with contrast-matched bicontinuous cubic phases. Frontiers in Chemistry. 8, 619470 (2021).
- van’t Hag, L., et al. Protein-eye view of the in meso crystallization mechanism. Langmuir. 35 (25), 8344-8356 (2019).
- Mahieu, E., et al. Observing protein degradation by the PAN-20S proteasome by time-resolved neutron scattering. Biophysical Journal. 119 (2), 375-388 (2020).
- Ibrahim, Z., et al. Time-resolved neutron scattering provides new insight into protein substrate processing by a AAA+ unfoldase. Scientific Reports. 7 (1), 40948 (2017).
- Hollamby, M. J., et al. Growth of mesoporous silica nanoparticles monitored by time-resolved small-angle neutron scattering. Langmuir. 28 (9), 4425-4433 (2012).
- Blin, J. L., Impéror-Clerc, M. Mechanism of self-assembly in the synthesis of silica mesoporous materials: in situ studies by X-ray and neutron scattering. Chemical Society Reviews. 42 (9), 4071-4082 (2013).
- Impéror-Clerc, M., Grillo, I., Khodakov, A. Y., Durand, D., Zholobenko, V. L. New insights into the initial steps of the formation of SBA-15 materials: an in situ small angle neutron scattering investigation. Chemical Communications. 8, 834-836 (2007).
- Narayanan, T., Rüter, A., Olsson, U. SAXS/WAXS investigation of amyloid-β(16-22) peptide nanotubes. Frontiers in Bioengineering and Biotechnology. 9, 654349 (2021).
- Angelov, B., et al. DNA/Fusogenic lipid nanocarrier assembly: millisecond structural dynamics. The Journal of Physical Chemistry Letters. 4 (11), 1959-1964 (2013).
- Amann, M., et al. Kinetic pathways for polyelectrolyte coacervate micelle formation revealed by time-resolved synchrotron SAXS. Macromolecules. 52 (21), 8227 (2019).
- Varga, Z., Wacha, A., Bóta, A. Osmotic shrinkage of sterically stabilized liposomes as revealed by time-resolved small-angle X-ray scattering. Journal of Applied Crystallography. 47 (1), 35-40 (2014).
- Panine, P., Finet, S., Weiss, T. M., Narayanan, T. Probing fast kinetics in complex fluids by combined rapid mixing and small-angle X-ray scattering. Advances in Colloid and Interface Science. 127 (1), 9-18 (2006).
- Grillo, I. Applications of stopped-flow in SAXS and SANS. Current Opinion in Colloid & Interface Science. 14 (6), 402-408 (2009).
- Gomez-Hens, A., Perez-Bendito, D. The stopped-flow technique in analytical chemistry. Analytica Chimica Acta. 242, 147-177 (1991).
- Patel, J. T., Belsham, H. R., Rathbone, A. J., Friel, C. T. Use of stopped-flow fluorescence and labeled nucleotides to analyze the ATP turnover cycle of kinesins. Journal of Visualized Experiments: JoVE. (92), e52142 (2014).
- Biro, F. N., Zhai, J., Doucette, C. W., Hingorani, M. M. Application of stopped-flow kinetics methods to investigate the mechanism of action of a DNA repair protein. Journal of Visualized Experiments: JoVE. (37), e1874 (2010).
- Raney, K. D., Sowers, L. C., Millar, D. P., Benkovic, S. J. A fluorescence-based assay for monitoring helicase activity. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6644-6648 (1994).
- Roder, H., Maki, K., Cheng, H. Early events in protein folding explored by rapid mixing methods. Chemical reviews. 106 (5), 1836-1861 (2006).
- Milon, A., et al. Osmotic swelling of unilamellar vesicles by the stopped-flow light scattering method. Influence of vesicle size, solute, temperature, cholesterol and three α,ω-dihydroxycarotenoids. Biochimica et Biophysica Acta (BBA) – Biomembranes. 859 (1), 1-9 (1986).
- Gast, K., Nöppert, A., Müller-Frohne, M., Zirwer, D., Damaschun, G. Stopped-flow dynamic light scattering as a method to monitor compaction during protein folding. European Biophysics Journal. 25 (3), 211-219 (1997).
- Antoun, A., Pavlov, M. Y., Tenson, T., Ehrenberg, M. M. Ribosome formation from subunits studied by stopped-flow and Rayleigh light scattering. Biological Procedures Online. 6, 35-54 (2004).
- Zhu, Z., Armes, S. P., Liu, S. pH-Induced micellization kinetics of ABC triblock copolymers measured by stopped-flow light scattering. Macromolecules. 38 (23), 9803-9812 (2005).
- Ye, J., et al. Comparative study of temperature-induced association of cyclic and linear poly(N-isopropylacrylamide) chains in dilute solutions by laser light scattering and stopped-flow temperature jump. Macromolecules. 41 (12), 4416-4422 (2008).
- Liu, X., et al. Early stage kinetics of polyelectrolyte complex coacervation monitored through stopped-flow light scattering. Soft Matter. 12 (44), 9030-9038 (2016).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garg, S., Porcar, L., Woodka, A. C., Butler, P. D., Perez-Salas, U. Noninvasive neutron scattering measurements reveal slower cholesterol transport in model lipid membranes. Biophysical Journal. 101 (2), 370-377 (2011).
- Marquardt, D., et al. 1H NMR shows slow phospholipid flip-flop in gel and fluid bilayers. Langmuir. 33 (15), 3731-3741 (2017).
- Egelhaaf, S. U., Olsson, U., Schurtenberger, P. Time-resolved SANS for surfactant phase transitions. Physica B: Condensed Matter. 276-278, 326-329 (2000).
- Tabor, R. F., Eastoe, J., Grillo, I. Time-resolved small-angle neutron scattering as a lamellar phase evolves into a microemulsion. Soft Matter. 5 (10), 2125-2129 (2009).
- Gradzielski, M., Bergmeier, M., Hoffmann, H., Müller, M., Grillo, I. Vesicle gel formed by a self-organization process. The Journal of Physical Chemistry B. 104 (49), 11594-11597 (2000).
- Lee, Y. -. T., Li, D. S., Pozzo, L. D. Kinetic analysis of ultrasound-induced oil exchange in oil-in-water emulsions through contrast variation time-resolved small-sngle neutron scattering. Langmuir. 35 (47), 15204-15213 (2019).
- Lee, Y. -. T., Pozzo, L. D. Contrast-variation time-resolved small-angle neutron scattering analysis of oil-exchange kinetics between oil-in-water emulsions stabilized by anionic surfactants. Langmuir. 35 (47), 15192-15203 (2019).
- Roger, K., Olsson, U., Schweins, R., Cabane, B. Emulsion ripening through molecular exchange at droplet contacts. Angewandte Chemie International Edition. 54 (5), 1452-1455 (2015).
- Nakano, M., Fukuda, M., Kudo, T., Endo, H., Handa, T. Determination of Interbilayer and Transbilayer Lipid Transfers by Time-Resolved Small-Angle Neutron Scattering. Physical Review Letters. 98 (23), 238101 (2007).
- Nakano, M., et al. Flip-flop of phospholipids in vesicles: kinetic analysis with time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 113 (19), 6745-6748 (2009).
- Nguyen, M. H. L., et al. Methanol accelerates DMPC flip-flop and transfer: A SANS study on lipid dynamics. Biophysical Journal. 116 (5), 755-759 (2019).
- Nguyen, M. H. L., et al. Peptide-induced Lipid flip-flop in asymmetric liposomes measured by small angle neutron scattering. Langmuir. 35 (36), 11735-11744 (2019).
- Nguyen, M. H. L., et al. Time-resolved SANS reveals pore-forming peptides cause rapid lipid reorganization. New Journal of Chemistry. 45 (1), 447-456 (2021).
- Xia, Y., et al. Effects of nanoparticle morphology and acyl chain length on spontaneous lipid transfer rates. Langmuir. 31 (47), 12920-12928 (2015).
- Xia, Y., et al. Morphology-induced defects enhance lipid transfer rates. Langmuir. 32 (38), 9757-9764 (2016).
- Maric, S., et al. Time-resolved small-angle neutron scattering as a probe for the dynamics of lipid exchange between human lipoproteins and naturally derived membranes. Scientific Reports. 9 (1), 7591 (2019).
- Nielsen, J. E., Bjørnestad, V. A., Pipich, V., Jenssen, H., Lund, R. Beyond structural models for the mode of action: How natural antimicrobial peptides affect lipid transport. Journal of Colloid and Interface Science. 582, 793-802 (2021).
- Willner, L., Poppe, A., Allgaier, J., Mokenbusch, M., Richter, D. TIme-resolved SANS for the determintioan of unimer exchange kinetics in block copolymer micelles. Europhysics Letters. 55 (5), 667 (2001).
- Lund, R., Willner, L., Stellbrink, J., Lindner, P., Richter, D. Logarithmic chain-exchange kinetics of diblock copolymer micelles. Physical Review Letters. 96 (6), 068302 (2006).
- Lund, R., Willner, L., Richter, D., Dormidontova, E. E. Equilibrium chain exchange kinetics of diblock copolymer micelles: Tuning and logarithmic relaxation. Macromolecules. 39 (13), 4566-4575 (2006).
- Lund, R., Willner, L., Richter, D., Abe, A., Lee, K. S., Leibler, L., Kobayashi, S. Kinetics of block copolymer micelles studied by small-angle scattering methods. in Controlled Polymerization and Polymeric Structures. Advances in Polymer Science. , 51 (2013).
- Choi, S. -. H., Lodge, T. P., Bates, F. S. Mechanism of molecular exchange in diblock copolymer micelles: hypersensitivity to core chain length. Physical Review Letters. 104 (4), 047802 (2010).
- Choi, S. -. H., Bates, F. S., Lodge, T. P. Molecular exchange in ordered diblock copolymer micelles. Macromolecules. 44 (9), 3594-3604 (2011).
- Lu, J., Bates, F. S., Lodge, T. P. Chain exchange in binary copolymer micelles at equilibrium: confirmation of the independent chain hypothesis. ACS Macro Letters. 2 (5), 451-455 (2013).
- Lu, J., Bates, F. S., Lodge, T. P. Remarkable effect of molecular architecture on chain exchange in triblock copolymer micelles. Macromolecules. 48 (8), 2667-2676 (2015).
- Kelley, E. G., et al. Size evolution of highly amphiphilic macromolecular solution assemblies via a distinct bimodal pathway. Nature Communications. 5 (1), 3599 (2014).
- Murphy, R. P., Kelley, E. G., Rogers, S. A., Sullivan, M. O., Epps, T. H. Unlocking chain exchange in highly amphiphilic block polymer micellar systems: influence of agitation. ACS Macro Letters. 3 (11), 1106-1111 (2014).
- Schantz, A. B., et al. PEE-PEO block copolymer exchange rate between mixed micelles is detergent and temperature activated. Macromolecules. 50 (6), 2484-2494 (2017).
- Lantz, K. A., et al. Cavitation enables switchable and rapid block polymer exchange under high-χN conditions. Macromolecules. 51 (17), 6967-6975 (2018).
- Murphy, R. P., et al. Capillary RheoSANS: measuring the rheology and nanostructure of complex fluids at high shear rates. Soft Matter. 16 (27), 6285-6293 (2020).
- Stopped Flow Sans. usnistgov Available from: https://github.com/usnistgov/stopped-flow-sans (2021)
- Kline, S. Reduction and analysis of SANS and USANS data using IGOR Pro. Journal of Applied Crystallography. 39 (6), 895-900 (2006).
- Doktorova, M., et al. Preparation of asymmetric phospholipid vesicles for use as cell membrane models. Nature Protocols. 13 (9), 2086-2101 (2018).
- Huang, Z., London, E. Effect of cyclodextrin and membrane lipid structure upon cyclodextrin-lipid interaction. Langmuir. 29 (47), 14631-14638 (2013).
- Sugiura, T., Ikeda, K., Nakano, M. Kinetic analysis of the methyl-β-cyclodextrin-mediated intervesicular transfer of pyrene-labeled phospholipids. Langmuir. 32 (51), 13697-13705 (2016).
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Dicko, C., et al. NUrF-Optimization of in situ UV-vis and fluorescence and autonomous characterization techniques with small-angle neutron scattering instrumentation. Review of Scientific Instruments. 91 (7), 075111 (2020).

