チャンバーおよびプレートベースの呼吸計を使用して細胞および組織の生体エネルギーを評価するための高解像度呼吸法
Summary
高分解能呼吸計を用いた酸化的リン酸化の評価は、ミトコンドリアおよび細胞エネルギー代謝の機能解析の不可欠な部分となっている。ここでは、チャンバーおよびマイクロプレートベースの高分解能呼吸計を使用して細胞エネルギー代謝を分析するためのプロトコルを提示し、各デバイスの主な利点について説明します。
Abstract
高分解能呼吸法(HRR)により、酸化的リン酸化をリアルタイムでモニタリングし、個々の細胞エネルギー状態の分析や、多様な基質非結合剤阻害剤滴定(SUIT)プロトコルを使用した呼吸複合体の評価を行うことができます。ここでは、2つの高解像度呼吸測定装置の使用例を示し、培養細胞、骨格筋線維および心筋線維、ならびに脳および肝臓などの軟部組織の分析に適用可能なプロトコルの基本的なコレクションを提示する。培養細胞および組織のためのプロトコルは、チャンバーベースの呼吸計およびマイクロプレートベースの呼吸数計のための培養細胞のために提供され、両方とも標準的な呼吸プロトコルを包含する。比較の目的で、多発性呼吸器系欠損を引き起こすミトコンドリア翻訳を欠損させたCRISPRが操作したHEK293細胞を両方の装置と共に使用して、呼吸における細胞欠陥を実証する。両方の呼吸計は、研究中の研究課題とモデルに依存するそれぞれの技術的メリットと適合性を備えた細胞呼吸の包括的な測定を可能にします。
Introduction
ミトコンドリアは、エネルギーの重要な供給を満たし、ヌクレオチド、脂質およびアミノ酸の同化作用、鉄硫黄クラスター生合成などの必須の細胞生体エネルギーおよび代謝プロセスに寄与する区画化された細胞小器官であり、制御された細胞死などのシグナル伝達に関与している1,2,3.酸化的リン酸化によるミトコンドリア生体エネルギー学は、細胞内のほぼすべての細胞プロセスに寄与し、その結果、一次または二次起源のミトコンドリア機能不全は、広範囲の疾患状態と関連している4,5。ミトコンドリア機能障害は、構造やミトコンドリア密度の変化だけでなく、呼吸器系の質や調節も伴います6。この定性的要素は、基質制御、結合特性、翻訳後修飾、クリステダイナミクス、および呼吸スーパーコンプレックス7、8を包含する。したがって、細胞のエネルギー代謝を評価するための実験的および診断的アプローチのためのミトコンドリア生体エネルギー学の正確な分析は、健康および疾患において重要である。
ミトコンドリア酸化リン酸化(OXPHOS)は、アデノシン三リン酸(ATP)を介して細胞エネルギーを生成するための呼吸器系または電子伝達系(ETS)内の一連の反応です9。複合体IおよびIIを通る電子流から複合体IVへのエネルギーを利用する多酵素ステップは、内側ミトコンドリア膜を横切って電気化学的プロトン勾配を生成し、続いて複合体V(F1FOATP合成酵素)を介してアデノシン二リン酸(ADP)からATPへのリン酸化に利用される(図1A)。
まず、トリカルボン酸環(TCA)、解糖系、ピルビン酸酸化の間に2つの電子伝達体が生成される:ニコチンアミドアデニンジヌクレオチド(NADH)およびジヒドロフラビンアデニンジヌクレオチド(FADH2)。NADHは錯体I(NADHデヒドロゲナーゼ)で酸化され、その間に2つの電子がコエンザイムQに伝達され(キノンはキノールに還元され)、プロトンは膜間空間(IMS)にポンプで送られます。第二に、複合体II(コハク酸デヒドロゲナーゼ)はFADH2を酸化し、プロトンをポンピングすることなく電子をコエンザイムQに供給する。第三に、複合体III(シトクロムc酸化還元酵素)では、コエンザイムQからの電子がシトクロムcに移され、プロトンがIMSにポンピングされる。第四に、シトクロムcは電子を複合体IV(シトクロムcオキシダーゼ)に伝達し、最終的な複合体は陽子をポンプし、酸素が電子受容体として機能してプロトンを同化し、最終的に水を形成する。ミトコンドリアが消費するのはこの酸素であり、オキシグラフで測定することができます。最後に、複合体I、複合体III、および複合体IVから生成されたプロトンを使用して複合体Vを回転させ、それによってATP9を生成する。
重要なことに、電子移動は直線的な様式で起こるだけでなく、電子輸送鎖とも表記される。代わりに、電子は複数の呼吸経路を介してコエンザイムQプールに伝達され、収束電子の流れを促進することができる。NADH基質およびコハク酸塩は、例えば、複合体Iおよび複合体IIを介してそれぞれ侵入することができる。脂肪酸酸化からの電子は、電子伝達フラビンタンパク質複合体を介して供与することができる。実際、OXPHOSの包括的な分析には、適切な燃料基材を用いた総合的なアプローチが必要です(図1A)。
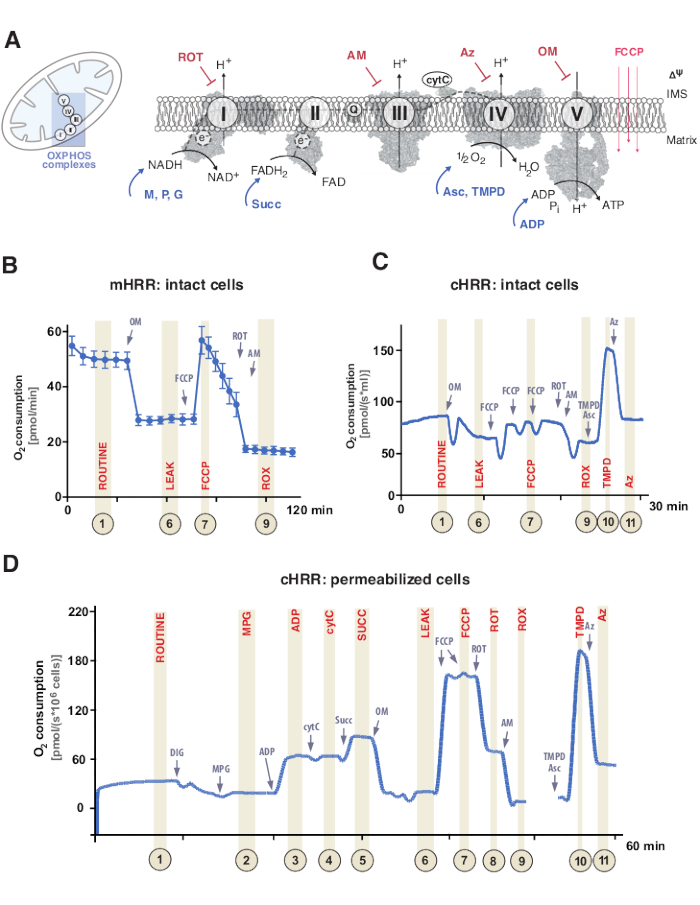
図1:ミトコンドリア酸化リン酸化ならびに特異的基質および阻害剤プロトコル。 (A)ミトコンドリアおよび電子伝達系(CI−CIV)およびミトコンドリアF1F0ATP合成酵素(CV)のスキーム。すべての構造体はPDBからのものです。図は、この研究で記載された基質および阻害剤のみを描写している)。(B)mHRR装置における標準プロトコールを用いた無傷のHEK293細胞における酸素フラックスのサンプル微量。(C)cHRR装置における標準プロトコールを用いた無傷のHEK293細胞における酸素フラックスのサンプル微量。(d)それぞれのSUITプロトコールを用いて健康なドナーからの透過処理されたヒト線維芽細胞における微量の酸素流束のサンプル。略語:1 =無傷の細胞の日常的な呼吸;2 = 状態 2;3 = 状態 3(I);4 = cytCを持つ状態3(I)。5 = 状態 3 (I+II);6 = リーク(OM);7 = ETS 容量;8 = S(ROT);9 = ROX;10 = TMPD;ROT=ロテノン、AM=アンチマイシン、ATP=アデノシン三リン酸、Az=アジド、OM=オリゴマイシン、FCCP=カルボニルシアン化物p-トリフルオロメトキシフェニル-ヒドラゾン;Asc = アスコルビン酸塩、TMPD = N,N,N’,N’-テトラメチル-p-フェニレンジアミン、スク酸 = コハク酸塩、M = リンゴ酸塩、P = ピルビン酸塩、ADP = アデノシン二リン酸、NAD = ニコチンアミドアデニンジヌクレオチド、IMS = 膜間空間、FAD = フラビンアデニンジヌクレオチド。この図の拡大版を表示するには、ここをクリックしてください。
HRRを用いたミトコンドリアOXPHOS能力の分析は、原発性ミトコンドリア欠損10,11だけでなく、癌や老化12などの生物学の他のすべての領域にも及ぶ診断値の器械的生化学的方法となっている12。HRRは、ミトコンドリアOXPHOS能力の分析による細胞呼吸の決定を可能にし、これは、個体または結合されたミトコンドリア呼吸器複合体欠損を直接反映し、間接的に細胞機能障害および変化したエネルギー代謝に関連する9。方法論的には、呼吸測定は、細胞、組織、または単離されたミトコンドリア11、13、14、15、16の凍結材料のみを部分的に適切なものを用いて行う。凍結組織は、維持された超複合体安定性を有する無傷のETSを有することが示される15。したがって、従来のTCA中間体とは対照的に、それぞれの基質はETSに直接供給される。しかし、ETSとATP合成との間の結合は、凍結損傷(氷結晶形成)によって膜の完全性が損なわれるにつれて失われる。
呼吸実験は、通常、非透過処理または透過処理された細胞または組織のいずれかにおける吸熱について、37°Cの生理学的温度で行われる。前者は細胞質ゾル代謝の文脈を考慮するが、後者は特定の基質(および阻害剤)の添加を通じて個々のOXPHOS複合体およびATPaseのエネルギー的寄与を提供する。基質および阻害剤の配列および変異は、OXPHOS機能に関する様々な科学的問題に対処するための多様なSUITプロトコル17 およびアッセイ18 の開発につながった(12でレビュー)。細胞呼吸の基本プロトコールは、4つの異なる状態を評価する:i) ルーチン呼吸−基質または阻害剤を消費するが内因性基質の添加なしにそれぞれの呼吸媒体中での呼吸。この状態は、一般的なOXPHOSまたは二次誘発呼吸欠陥、例えば代謝産物プロファイルの変化によって引き起こされるものを明らかにすることができる。次に、ATPase阻害剤オリゴマイシンの添加は、プロトンに対するミトコンドリア内膜の透過性を明らかにし、ii) 漏出呼吸として定義する。その後のアンカプラカルボニルシアン化物p-トリフルオロメトキシフェニル-ヒドラゾン(FCCP)などのプロトノフォアの滴定は、iii) 非結合呼吸 として定義される膜開放型プロトン回路モードにおいてETS容量が最大となる状態を決定することを可能にする。重要なことに、非結合状態は、ミトコンドリア膜への過度の機械的損傷を介した実験的介入によっても起こり得る。逆に、非結合状態とは、生理学的に制御された内因的な機構による呼吸脱結合をいう。最後に、複合体III阻害剤アンチマイシンおよび複合体I阻害剤ロテノンの添加によるETSの完全な阻害は、非ミトコンドリア酸素消費プロセスからの 残留酸素消費 (ROX)を決定する(図1A−C)。
ミトコンドリア生体エネルギー学は、5つの異なる呼吸状態19,20からなる。状態1呼吸は、内因的に利用可能なものを除いて、追加の基質またはADPを含まない。ADPの添加後、依然として、基質がないが、状態2呼吸が達成される。基質が添加されると、電子移動およびATP合成が可能になり、状態3呼吸に達する。この状態では、OXPHOS容量は、ADP、無機リン酸、酸素、NADHおよびコハク酸結合基質の飽和濃度で定義することができる。状態4呼吸またはLEAK呼吸は、十分な基質を有しながらADPまたは化学的に阻害されたATP合成酵素を含まない状態として定義することができる。最後に、閉室設定ですべての酸素が枯渇(無酸素)されると、状態5の呼吸が観察される。
Oroboros 2k高分解能呼吸計とタツノオトシゴXF細胞外フラックスアナライザーという、実験モデルと研究課題に応じて適用性が異なる密閉チャンバーシステムにおける酸素の経時的な減少の関数として測定された酸素消費量の分析を通じて、OXPHOSの現在のリアルタイム評価を支配する2つの装置を用いて、細胞エネルギー状態14 を評価するためにいくつかの方法が存在する。両方の装置は、チャンバまたはマイクロプレートウェル内の絶対値として、1秒あたりの酸素(O2)のピコモール(pmol)の減少として酸素消費速度を記録する。質量当たりの比酸素消費量は、細胞数(数百万)、組織重量(mg)、またはタンパク質量当たりの特定の緩衝レシピにおけるそれぞれの酸素消費量を正規化することによって得られる。
O2k(オロボロスインスツルメンツ)は、ポラログラフ酸素センサ(チャンバベースの高解像度呼吸計:cHRRと略される)を備えた閉じた2チャンバシステムです。各実験チャンバは、マグネチックスターラーによって均質に保たれる2mLの液体を保持する。ポラログラフ酸素センサは、アンペロメトリックアプローチを使用して酸素を測定します:金カソード、銀/塩化銀陽極、およびKCI溶液の間に電圧(0.8V)が印加される電気化学セルを作成します。アッセイ培地からの酸素は、25μmのフッ素化エチレンプロピレン膜(O2透過性)を通って拡散し、陰極で還元を受け、過酸化水素を生成する。陽極では、銀が過酸化水素によって酸化され、電流を発生させる。この電流(アンペア)は酸素分圧に直線的に関係している。酸素分圧およびアッセイ媒体の酸素溶解係数は、酸素濃度を計算するために使用される。酸素分圧は実験温度に依存し、ポラログラフ測定は温度に敏感であるため、温度の変動はペルチェ加熱ブロックによる正確な(±0.002°C)調節を必要とする。温度は4°Cおよび47°Cの範囲で制御することができる。
タツノオトシゴXF細胞外フラックス分析装置(Agilent)は、3つの蛍光電極が各ウェルの酸素消費量を経時的に測定する24ウェルまたは96ウェルマイクロプレートフォーマットのプレートベースのシステムです(マイクロプレートベースの高解像度呼吸計:mHRRと略されます)。アッセイカートリッジ内の最大 4 つのポートは、アッセイ中の自動注入に使用できます。アッセイには複数のサイクルが含まれ、それぞれに3つのフェーズ(1)混合、2)待機、および3)測定があります。測定段階では、センサープローブをマイクロプレートに下げて、7〜10μLの容量を含む一時的に閉じたチャンバを作成し、放出された光を測定します。この光は、センサープローブの先端にあるポリマー包埋蛍光色素によって放出され、リン光消光に基づいてO2 を感知します。蛍光シグナルの強度はO2 に比例し、センサおよびアッセイ媒体の温度によって影響される。したがって、正確な酸素推定には、サンプルなしでバックグラウンドウェルを備えた相対的なアプローチが必要です。酸素濃度の回復は、センサーが上下に移動して仮チャンバの上の体積を混合する混合フェーズ中に発生します。各サイクルで 1 つの酸素消費率が計算されます。温度は16°Cおよび42°Cの範囲で制御することができる。
HRRは、原発性およびミトコンドリア関連疾患および一般的な細胞代謝における細胞生体エネルギーを評価するためのゴールドスタンダードです。この研究では、細胞および組織におけるOXPHOS機能を評価するために、HRRの基本的なプロトコールが提供される。
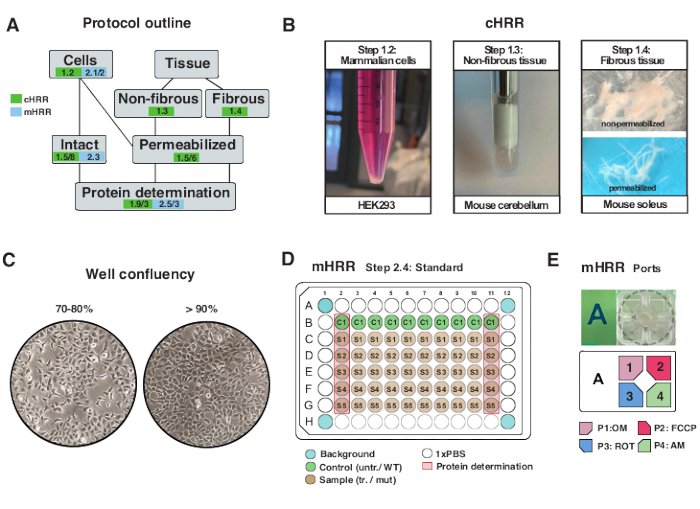
図2:cHRRのための細胞および組織調製のためのワークフロー、ならびにmHRR呼吸法のための細胞調製のためのワークフロー。(B)哺乳動物細胞(ステップ1.2):3 x106細胞に等しいHEK293ペレット(左パネル)。非線維組織(ステップ1.3):2mLテフロン陶器(中央パネル)におけるマウス小脳溶解物の調製。cHRR呼吸法のためのサポニン誘発骨格筋透過(ステップ1.4)右パネル)。(c)mHRR呼吸法のための真核細胞(HEK293)の分析のための標準的なマイクロプレート播種レイアウト(ステップ2.4)およびコンフルエンシーチェック。(D、E)mHRR呼吸法のための注入口装填のスキーム(ステップ2.4)。この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
伝統的に、ミトコンドリア生体エネルギー学は、クラーク型酸素電極を用いて研究されてきた。しかし、解像度とスループットの欠如は、技術の進歩を正当化しました。今日まで、O2k(cHRRと呼ばれる)およびタツノオトシゴXF96フラックスアナライザー(mHRRと呼ばれる)は、細胞バイオエネルギー学の分野で広く採用されている。ここでは、cHRRまたはmHRRのいずれかを使用してミトコンドリア呼吸?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この研究は、フィンランドアカデミー(C.B.J)、Magnus Ehrnroot Foundation(C.B.J)、および統合生命科学大学院(R.A.)の博士フェローシップからの資金提供によって支援されました。
Materials
| 2 mL Potter-Elvehjem Glass/PTFE Tissue Grinder/Homogenizer | Omni International | 07-358029 | |
| 95% O2, 5% CO2 medical gas mixture | Potter for tissue grinding | ||
| ADP | Sigma | A 4386 | |
| Antimycin A | Sigma | A 8674 | Chemical |
| Ascorbate | Merck | PHR1279-1G | Chemical, dissolve in ethanol |
| BSA (fatty accid free) | Sigma | A 6003 | Chemical |
| CaCO3 | Sigma | C 4830 | Chemical |
| Cytochrome c | Sigma | C 7752 | Chemical |
| Digitonin | Sigma | D 5628 | Chemical |
| Dithiothreitol | Sigma | D 0632 | Chemical, dissolve in DMSO |
| D-Sucrose | Roth | 4621.1 | Chemical |
| Dulbecco’s modified Eagle’s medium (High glucose) | Fisher Scientific | 41965-039 | Chemical |
| Dulbecco’s modified Eagle’s medium (No Glucose) | Fisher Scientific | A14430-01 | |
| EGTA | Sigma | E 4378 | |
| Etomoxir | Sigma | E1905 | Chemical |
| Falcon 15 ml Conical Centrifuge Tubes | Fisher Scientific | AM12500 | Chemical |
| Falcon 50 ml Conical Centrifuge Tubes | Fisher Scientific | AM12501 | |
| FCCP | Sigma | C 2920 | |
| Glucose | Sigma | G7021 | Chemical, dissolve in ethanol |
| Glutamate | Sigma | G 1626 | Chemical |
| GlutaMax (100x) (200 nM L-alanyl-L-glutamine dipeptide) | Fisher Scientific | 35050061 | Chemical |
| HEK293 cells | ATTC | CRL-1573 | |
| Hemocytometer | Fisher Scientific | 0267151B | Instrument for cell counting |
| Hepes | Sigma | H 7523 | Chemical |
| Imidazole | Fluka | 56750 | Chemical |
| KCl | Merck | 1.04936 | Chemical |
| L-carnitine | Sigma | C0283 | Chemical |
| Malate | Sigma | M 1000 | Chemical |
| MES hydrate | Sigma | M8250 | Chemical |
| MgCl2 | Sigma | M 9272 | Chemical |
| Na2ATP | Sigma | A 2383 | Chemical |
| Na2Phosphocreatine | Sigma | P 7936 | Chemical |
| Na-pyruvate (100 mM) (100x) | Fisher Scientific | 11360070 | |
| NEAA (Non-essential amino acids) 100x | Fisher Scientific | 11140035 | |
| Normal FBS (10x) | Fisher Scientific | 10500064 | |
| O2k-Core: Oxygraph-2k | Oroboros Instruments | 10000-02 | High-resolution respirometry instrument |
| O2k-Titration Set | Oroboros Instruments | 20820-03 | Hamilton syringes for chemical injections |
| Oligomycin | Sigma | O 4876 | Chemical, dissolve in ethanol |
| Palmitoylcarnitine | Sigma | P 4509 | Chemical |
| Penicillin-Streptomycin | Fisher Scientific | 15140122 | |
| Pierce BCA Protein Assay Kit | Fisher Scientific | 23227 | |
| Pyruvate | Sigma | P 2256 | Chemical |
| RIPA-Buffer | Fisher Scientific | 89900 | Chemical |
| Rotenone | Sigma | R 8875 | Chemical, dissolve in ethanol |
| Saponin | Sigma | S7900 | Chemical |
Seahorse XF DMEM assay medium pack, pH 7.4 |
Agilent, Santa Clara, CA |
103680-100 | |
| Seahorse XFe96 Extracellular Flux Analyzer | Agilent, Santa Clara, CA |
High-throughput respirometry instrument | |
| Seahorse XFe96 FluxPak | Agilent, Santa Clara, CA |
Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
|
| Small scissors | Fisher Scientific | 08-951-20 | |
| Sodium azide | Sigma | S2002 | Chemical |
| Succinate | Sigma | S 2378 | Chemical |
| Taurine | Sigma | T 8691 | Chemical |
| TMPD | Sigma | T 3134 | Chemical |
| Trypan Blue solution | Merck | 72-57-1 | Chemical |
| Trypsin 0.25% EDTA | Fisher Scientific | 25200056 | |
| Two thin-edged forceps | Fisher Scientific | 12-000-122 | |
| Uridine stock (500x) | Sigma | U3750 | Chemical |
References
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: More than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Mehta, M. M., Weinberg, S. E., Chandel, N. S. Mitochondrial control of immunity. Beyond ATP. Nature Reviews Immunology. 17 (10), 608-620 (2017).
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle. New perspectives of mitochondrial physiology. International Journal of Biochemistry and Cell Biology. 41 (10), 1837-1845 (2009).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 1-23 (2016).
- Boushel, R., Gnaiger, E., Schjerling, P., Skovbro, M., Kraunsøe, R., Dela, F. Patients with type 2 diabetes have normal mitochondrial function in skeletal muscle. Diabetologia. 50 (4), 790-796 (2007).
- Cogliati, S., et al. Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency. Cell. 155 (1), 160-171 (2013).
- Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biology. 13, 1-11 (2015).
- Gnaiger, E. Mitochondrial pathways and Respiratory control. An introduction to OXPHOS analysis. Bioenergetics communications. 5th ed. , (2020).
- Jackson, C. B., et al. Mutations in SDHD lead to autosomal recessive encephalomyopathy and isolated mitochondrial complex II deficiency. Journal of Medical Genetics. 51 (3), 170-175 (2014).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- Doerrier, C., Garcia-Souza, L. F., Krumschnabel, G., Wohlfarter, Y., Mészáros, A. T., Gnaiger, E. High-resolution fluorespirometry and oxphos protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Zhang, J., et al. Measuring energy metabolism in cultured cells, including human pluripotent stem cells and differentiated cells. Nature Protocols. 7 (6), 1068-1085 (2012).
- García-Roche, M., Casal, A., Carriquiry, M., Radi, R., Quijano, C., Cassina, A. Respiratory analysis of coupled mitochondria in cryopreserved liver biopsies. Redox Biology. 17, 207-212 (2018).
- Acin-Perez, R., et al. A novel approach to measure mitochondrial respiration in frozen biological samples. The EMBO Journal. 39 (13), 1-18 (2020).
- Cell metabolism assay kits. Seahorse assay kits and media Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-lits-reagents-cell-assay-media (2021)
- Chance, B., Williams, G. R. A method for the localization of sites for oxidative phosphorylation. Nature. 176 (4475), 250-254 (1955).
- Gnaiger, E., et al. Mitochondrial respiratory states and rates. MitoFit Preprint Arch. , (2019).
- Gnaiger, E. O2k-procedures: SOP O2k quality control 1: Polarographic oxygen sensors and accuracy of calibration Section Page. Oroboros. 03 (18), 1-21 (2020).
- Robinson, B. H., Petrova-Benedict, R., Buncic, J. R., Wallace, D. C. Nonviability of cells with oxidative defects in galactose medium: A screening test for affected patient fibroblasts. Biochemical Medicine and Metabolic Biology. 48 (2), 122-126 (1992).
- King, M. P., Attardi, G. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Fasching, M., Gnaiger, E. O2k quality control 2: Instrumental oxygen background correction and accuracy of oxygen flux. Mitochondrial Physiology Network. 14 (06), 1-14 (2016).
- Gnaiger, E., Lassnig, B., Kuznetsov, A., Rieger, G., Margreiter, R. Excess capacity of cytochrome c oxidase. Journal of Experimental Biology. 1139, 1129-1139 (1998).
- Gnaiger, E., et al. Mitochondria in the Cold. Life in the Cold. , 431-442 (2000).
- Fontana-Ayoub, M., Fasching, E., Gnaiger, Selected media and chemicals for respirometry with mitochondrial preparations. Mitochondrial Physiology Network. 02 (17), 1-9 (2014).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods in Enzymology. 542, 163-181 (2014).
- Nászai, A., Terhes, E., Kaszaki, J., Boros, M., Juhász, L. Ca(2+)N it be measured? Detection of extramitochondrial calcium movement with high-resolution fluorespirometry. Scientific Reports. 9 (1), 1-13 (2019).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: From diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), 234 (2019).
- Mercier-Letondal, P., Marton, C., Godet, Y., Galaine, J. Validation of a method evaluating T cell metabolic potential in compliance with ICH Q2 (R1). Journal of Translational Medicine. 19 (1), 1-15 (2021).
- Sauerbeck, A., et al. Analysis of regional brain mitochondrial bioenergetics and susceptibility to mitochondrial inhibition utilizing a microplate based system. Journal of Neuroscience Methods. 198 (1), 36-43 (2011).
- Jackman, M. R., Willis, W. T. Characteristics of mitochondria isolated from type I and type IIb skeletal muscle. American Journal of Physiology – Cell Physiology. 270 (2), 673-678 (1996).
- Ponsot, E., et al. Mitochondrial tissue specificity of substrates utilization in rat cardiac and skeletal muscles. Journal of Cellular Physiology. 203 (3), 479-486 (2005).
- Schönfeld, P., Reiser, G. Why does brain metabolism not favor burning of fatty acids to provide energy-Reflections on disadvantages of the use of free fatty acids as fuel for brain. Journal of Cerebral Blood Flow and Metabolism. 33 (10), 1493-1499 (2013).
- Calderon-Dominguez, M., Mir, J. F., Fucho, R., Weber, M., Serra, D., Herrero, L. Fatty acid metabolism and the basis of brown adipose tissue function. Adipocyte. 5 (2), 98-118 (2016).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the seahorse XF analyzer or a clark-type oxygen electrode. Current Protocols in Toxicology. 2014, 1-16 (2014).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using Seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PLoS ONE. 6 (7), 21746 (2011).
- Jordá, A., Zaragozá, R., Portolés, M., Báguena-Cervellera, R., Renau-Piqueras, J. Long-term high-protein diet induces biochemical and ultrastructural changes in rat liver mitochondria. Archives of Biochemistry and Biophysics. 265 (2), 241-248 (1988).
- Jackson, C. B., Gallati, S., Schaller, A. QPCR-based mitochondrial DNA quantification: Influence of template DNA fragmentation on accuracy. Biochemical and Biophysical Research Communications. 423 (3), 441-447 (2012).
- Hirsch, H. M. Tissue autoxidation inhibitors: II. The presence of inhibitor in intact cells; Assay of liver and hepatoma effect on radio-oxidations. 癌症研究. 16 (11), 1076-1082 (1956).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), 18317 (2011).
- Tanumihardja, E., Slaats, R. H., Van Der Meer, A. D., Passier, R., Olthuis, W., Van Den Berg, A. Measuring both pH and O2 with a single On-Chip sensor in cultures of human pluripotent stem cell-derived cardiomyocytes to track induced changes in cellular metabolism. ACS Sensors. 6 (1), 267-274 (2021).
- Harms, F., Stolker, R. J., Mik, E. Cutaneous respirometry as novel technique to monitor mitochondrial function: A feasibility study in healthy volunteers. PLoS ONE. 11 (7), 159544 (2016).
- Levitsky, Y., et al. Micro-respirometry of whole cells and isolated mitochondria. RSC Advances. 9 (57), 33257-33267 (2019).

