Analyse simplifiée et à haut débit de la contractilité unicellulaire à l’aide d’élastomères à micromotifs
Summary
Ce travail présente un protocole flexible pour l’utilisation de la technologie FLECS (élastomère contractable surfaces élastomères marquées par fluorescence) au format micropuit pour une quantification simplifiée et sans intervention des forces contractiles unicellulaires basées sur des déplacements visualisés de micromotifs de protéines fluorescentes.
Abstract
La génération de force contractile cellulaire est un trait fondamental partagé par pratiquement toutes les cellules. Ces forces contractiles sont cruciales pour un bon développement, fonctionnent à la fois au niveau cellulaire et tissulaire et régulent les systèmes mécaniques du corps. De nombreux processus biologiques dépendent de la force, notamment la motilité, l’adhésion et la division des cellules individuelles, ainsi que la contraction et la relaxation d’organes tels que le cœur, la vessie, les poumons, les intestins et l’utérus. Compte tenu de son importance dans le maintien d’une fonction physiologique appropriée, la contractilité cellulaire peut également entraîner des processus pathologiques lorsqu’elle est exagérée ou perturbée. L’asthme, l’hypertension, le travail prématuré, les cicatrices fibrotiques et la vessie sous-active sont tous des exemples de processus pathologiques mécaniques qui pourraient potentiellement être soulagés par un contrôle approprié de la force contractile cellulaire. Nous présentons ici un protocole complet pour l’utilisation d’une nouvelle technologie de test de contractilité à base de microplaques connue sous le nom de surfaces contractibles élastomères marquées par fluorescence (FLECS), qui fournit une analyse simplifiée et intuitive de la contractilité unicellulaire à une échelle massive. Ici, nous fournissons un protocole par étapes pour obtenir deux courbes dose-réponse en six points décrivant les effets de deux inhibiteurs contractiles sur la contraction des cellules musculaires lisses primaires de la vessie humaine dans une procédure simple utilisant une seule microplaque de test FLECS, afin de démontrer la technique appropriée aux utilisateurs de la méthode. Grâce à la technologie FLECS, tous les chercheurs disposant de laboratoires biologiques de base et de systèmes de microscopie fluorescente ont accès à l’étude de ce phénotype cellulaire fonctionnel fondamental mais difficile à quantifier, abaissant efficacement la barrière d’entrée dans le domaine de la biologie de la force et du criblage phénotypique de la force des cellules contractiles.
Introduction
Les forces mécaniques générées par les cellules sont essentielles au bon fonctionnement de divers organes du corps tels que les intestins, la vessie, le cœur et autres. Ces organes doivent générer des modèles stables de contraction et de relaxation cellulaires pour maintenir l’état homéostatique interne. La contraction anormale des cellules musculaires lisses (SMC) peut entraîner l’apparition de divers troubles, y compris, par exemple, la dysmotilité intestinale, caractérisée par des schémas anormaux de contraction des muscles lisses intestinaux1, ainsi que les conditions urologiques de la vessie hyperactive2 ou sous-active3. Dans les voies respiratoires, les SMC qui présentent des schémas de contraction irréguliers peuvent déclencher une hyperréactivité asthmatique4, ce qui pourrait resserrer les voies respiratoires et diminuer le flux d’oxygène dans les poumons. Une autre condition physique répandue, l’hypertension, est causée par des fluctuations de la contraction des muscles lisses dans les vaisseaux sanguins5. De toute évidence, les mécanismes contractiles dans les cellules et les tissus peuvent conduire à des maladies qui nécessitent des options de traitement. Comme ces conditions découlent indubitablement des comportements contractiles dysfonctionnels des cellules, il devient logique et nécessaire de mesurer la fonction contractile cellulaire elle-même, lors du dépistage de candidats médicaments potentiels.
Reconnaissant la nécessité d’outils pour étudier la force contractile cellulaire, plusieurs méthodes de dosage quantitatif de contraction ont été mises au point par des chercheurs universitaires, notamment la microscopie à force de traction (TFM)6, le TFM7 à micromotifs, les tests sur gel flottant8 et les tests de microposte élastomère9. Ces technologies ont été utilisées en format à plat unique ainsi qu’en format plaque à plusieurs puits dans de nombreuses études et ont même été proposées pour des mesures de force tridimensionnelles10,11,12,13,14. Bien que ces technologies aient permis des recherches pionnières dans le vaste domaine de la biologie de la force cellulaire, elles ont toutes été largement limitées aux laboratoires possédant des capacités et des ressources spécifiques, en particulier: capacité à fabriquer des substrats TFM, capacité à appliquer correctement des algorithmes complexes et non intuitifs pour résoudre des cartes de déplacement TFM, et systèmes de microscopie relativement précis qui peuvent enregistrer des images prises avant et après le retrait d’échantillons de la scène (pour la dissociation cellulaire). Ainsi, pour un chercheur non formé, la barrière à l’entrée pour utiliser ces méthodes peut être assez élevée compte tenu de l’ensemble étendu d’exigences pour appliquer ces technologies. En outre, la résolution d’imagerie requise pour de nombreuses technologies existantes (objectifs 40x ou plus) peut limiter considérablement le débit expérimental, tandis que les technologies de mesure en vrac pourraient masquer les contributions des cellules aberrantes et empêcher la découverte de différences contractiles plus légères. Il convient de noter que, pour autant que les auteurs le sachent, seule l’approche du dosage sur gel flottant à faible débit et semi-quantitatif a suffisamment mûri pour être mise à la disposition des chercheurs (voir la figure 1).
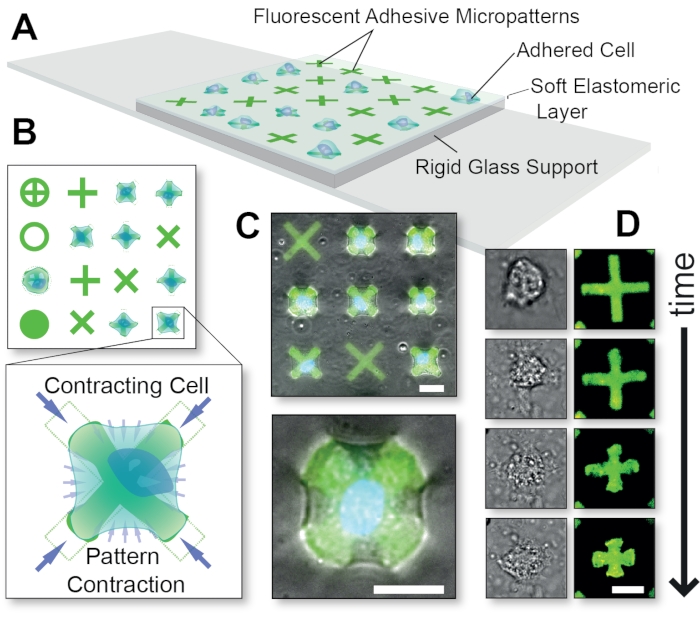
Figure 1: Schéma global de la méthode de la technologie FLECS. (A) Les cellules sont adhérées à des micromotifs de protéines adhésives qui sont incorporés de manière covalente dans une fine couche élastomère soutenue par du verre. (B) Vue de dessus de diverses formes possibles de micromotifs et explosion d’une cellule contractant un micromoptère en forme de « X ». (C) Superposition de micromotifs fluorescents et d’images à contraste de phase d’une cellule contractante. (D) Images temporelles d’une seule cellule contractante. Barres d’échelle = 25 μm. Cette figure a été adaptée avec la permission de Pushkarsky et al15. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Suite aux progrès récents de la microtechnologie, les auteurs ont développé une technologie basée sur des microplaques permettant des mesures quantitatives de la contraction unicellulaire dans des centaines de milliers de cellules appelées FLECS (surfaces contractibles élastomères marquées par fluorescence)15,16,17,18,19,20 , comme alternative à TFM. Dans cette approche, les micromotifs de protéines fluorescentes sont intégrés dans des films mous qui se déforment et rétrécissent lorsque les cellules leur appliquent des forces de traction, de manière intuitive et mesurable. Il est important de noter que les micromotifs protéiques contraignent la position, la forme et la zone de propagation des cellules, ce qui conduit à des conditions de test uniformes. Ceux-ci permettent des mesures simples basées uniquement sur leurs changements dimensionnels, qui sont très résolus spatialement, même dans des images de grossissement 4x. La méthode comprend un module d’analyse d’image basé sur un navigateur et permet une analyse simple de la force des cellules contractiles sans nécessiter de procédures de manipulation délicates ou d’enregistrement de marqueurs fiduciaires, de sorte qu’elle devrait être utilisable par tout chercheur disposant d’une installation de culture cellulaire de base et d’un microscope fluorescent simple à faible grossissement (Figure 2 ). Cette technologie, prête à l’emploi et disponible dans le commerce, a été conçue pour l’utilisateur final et vise à réduire la barrière à l’entrée pour tout scientifique de laboratoire pour étudier la biologie de la force cellulaire.

Figure 2 : Schéma du format de plaque à 24 puits pour le test de contractilité à cellule unique. Ce format a été utilisé dans les expériences décrites ici et décrites dans la partie vidéo de l’article. Barres d’échelle = 25 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Dans ce travail, nous présentons un protocole pour appliquer le format de plaque à 24 puits de la plate-forme technologique FLECS pour quantifier les effets des médicaments modulateurs de force sur la contractilité cellulaire dans les cellules musculaires lisses primaires de la vessie. Ce protocole à usage général peut être adapté et modifié au besoin pour tenir compte de diverses autres échelles de temps, types de cellules et conditions de traitement d’intérêt, et mis à l’échelle pour répondre à d’autres questions en biologie de la force.
Protocol
Representative Results
Discussion
Cette méthode simplifiée pour mesurer quantitativement la contraction dans des centaines de milliers de cellules à la fois dans différentes conditions de traitement et en utilisant uniquement des instruments de microscopie standard offre une alternative accessible au TFM traditionnel pour les chercheurs afin d’étudier la biologie de la force cellulaire. Parce que la technologie présentée fournit un affichage visuel de la contraction cellulaire en analysant les changements dans les micromotifs fluorescents de forme régulière, l’ampleur de la contraction produite par une cellule donnée est intuitivement comprise – plus le micromotif est petit, plus la force contractile exercée par la cellule est grande.
Notamment, en offrant un contrôle sur des facteurs tels que la forme, la zone d’étalement et la molécule d’adhésion comprenant les micromotifs (tous les facteurs connus pour réguler la contractilité cellulaire22,23,24), la technologie présentée élimine systématiquement les variables supplémentaires qui peuvent confondre les interprétations des études de contraction cellulaire.
Dans cette expérience, une rigidité de 10 kPa a été utilisée dans le gel et un micromoptère de 70 μm (longueur diagonale) a été utilisé composé de collagène de type IV. Outre ces paramètres, la molécule adhésive peut être remplacée par divers collagènes, fibronectine, gélatine et autres matrices extracellulaires (ECM). La rigidité du gel peut être réglée jusqu’à 0,1 kPa et jusqu’à la plage MPa. La géométrie du micromotif peut être conçue de novo pour être n’importe quelle forme avec une taille de caractéristique minimale d’environ 5 μm. Ces paramètres sont découplés et peuvent être optimisés indépendamment pour un contexte biologique particulier.
Cette technologie a été largement validée pour être compatible avec les types de cellules hautement adhésives et contractiles d’un phénotype mésenchymateux, y compris divers types de cellules musculaires lisses (vessie humaine primaire, intestinale, trachéale, bronchique, utérine, aortique et artérielle), les cellules souches mésenchymateuses et leur progéniture différenciée, divers fibroblastes (pulmonaires, cutanés et cardiaques), les myofibroblastes et les cellules endothéliales. En outre, les macrophages dérivés des monocytes produiront également une force phagocytaire mesurable importante sur les micromotifs, en particulier si le micromoptule est constitué d’une opsonine connue. Diverses lignées cancéreuses peuvent également être analysées à l’aide de la méthode.
La méthode peut poser certains défis pour l’utilisation avec des cellules qui sont soit relativement petites telles que les cellules T et les neutrophiles, soit des types de cellules avec un phénotype principalement épithélial. La raison principale en est que la méthode repose sur une forte adhérence et une propagation complète des cellules sur le micromotif afin de générer le signal contractile mesurable. Les cellules qui se lient faiblement, se lient les unes aux autres ou ne se propagent pas complètement ne produiront pas de signaux contractiles mesurables. Ces comportements, qui sont relativement rares, peuvent être atténués en ajustant la taille du micromotif pour qu’il soit plus petit, ou en utilisant des molécules adhésives alternatives dans les micromotifs qui favoriseront mieux l’adhésion et la propagation dans ces cellules.
Les utilisateurs de la technologie doivent évaluer soigneusement différentes formulations possibles de milieux de culture cellulaire pour leur type particulier d’intérêt cellulaire, car différents composants, facteurs de croissance, taux sériques et sensibilités au pH peuvent entraîner des comportements variables dans différentes cellules. L’optimisation du protocole doit précéder la mise à l’échelle de tout flux de travail expérimental, et les composants multimédias doivent toujours être frais, stériles et cohérents avec les lots précédents.
En fin de compte, si la résolution d’une seule cellule n’est pas nécessaire pour les objectifs d’un utilisateur, ou si le type de cellule cible a une capacité de propagation minimale, alors le TFM traditionnel peut être tout aussi ou plus approprié pour de telles expériences. L’objectif et l’espoir des auteurs sont que cet outil offre aux biologistes cellulaires une avenue supplémentaire pour étudier la contraction cellulaire, en particulier dans le contexte des dépistages automatisés de médicaments phénotypiques à haut débit.
Spécifiquement aux utilisations futures dans les écrans de médicaments, des plaques à débit plus élevé telles qu’une plaque FLECS de 384 puits peuvent être utilisées. Dans de telles plaques, les objectifs 4x de nombreux microscopes peuvent capturer un seul puits entier dans leur champ de vision, garantissant ainsi que toutes les réponses contractiles cellulaires sont capturées. En utilisant un système d’imagerie à haut débit, une plaque entière de 384 puits peut être imagée en environ 5 minutes, ce qui rend ce système considérablement plus rapide que les autres options et, par conséquent, adapté à la découverte de médicaments phénotypiques à haut débit. En effet, les auteurs effectuent régulièrement des dépistages hebdomadaires de drogues sur environ 50 plaques de 384 puits (totalisant plus de 19 000 puits) en utilisant l’automatisation.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Les travaux de laboratoire ont été menés avec le soutien de la Molecular Shared Screening Resource (MSSR) de l’UCLA, où Forcyte parraine des activités de recherche, et de l’incubateur Magnify du California NanoSystems Institute (CNSI), où Forcyte Biotechnologies, Inc. est une société résidente. Les auteurs accorderont l’accès au module d’analyse FLECS Biodock.ai à tous les chercheurs universitaires sur demande. L.H. et I.P. ont contribué de manière égale à ce travail.
Materials
| Bladder smooth muscle cell culture | Sciencell | #4310 | |
| Blebbistatin | Sigma-Aldrich | B0560 | |
| Cell culture media | Thermofisher | 11765054 | Ham's F12 medium supplemented with 10% FBS and 1% p/s |
| Cell strainer | Fisher Scientific | 7201432 | |
| Conical Tube | Fisher Scientific | 05-539-13 | |
| Culture flask | Fisher Scientific | FB012941 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| DMSO (Dimethyl sulfoxide) | Fisher Scientific | D1284 | |
| Eppendorf tubes | Fisher Scientific | 05-402-31 | |
| Fluorescent microscope | Molecular Devices | ImageXpress Confocal | |
| Forcyte-manufactured 24-well plate | Forcyte Biotechnologies | 24-HC4R-X1-QB12 | |
| Hoescht 3342 Live Nuclear Stain | Thermofisher | 62249 | |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP39920 |
References
- Ohama, T., Hori, M., Ozaki, H. Mechanism of abnormal intestinal motility in inflammatory bowel disease: How smooth muscle contraction is reduced. Journal of Smooth Muscle Research. 43 (2), 43-54 (2007).
- Peyronnet, B., et al. A comprehensive review of overactive bladder pathophysiology: On the way to tailored treatment. European Urology. 75 (6), 988-1000 (2019).
- Aldamanhori, R., Osman, N. I., Chapple, C. R. Underactive bladder: Pathophysiology and clinical significance. Asian Journal of Urology. 5 (1), 17-21 (2018).
- Sanderson, M. J., Delmotte, P., Bai, Y., Perez-Zogbhi, J. F. Regulation of airway smooth muscle cell contractility by Ca2+ signaling and sensitivity. Proceedings of the American Thoracic Society. 5 (1), 23-31 (2008).
- Brozovich, F. V., et al. Mechanisms of vascular smooth muscle contraction and the basis for pharmacologic treatment of smooth muscle disorders. Pharmacological Reviews. 68 (2), 476-532 (2016).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophysical Journal. 80 (4), 1744-1757 (2001).
- Tseng, Q., et al. A new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab on a Chip. 11 (13), 2231-2240 (2011).
- Bell, E., Ivarsson, B., Merrill, C. Production of a tissue-like structure by contraction of collagen lattices by human fibroblasts of different proliferative potential in vitro. Proceedings of the National Academy of Sciences. 76 (3), 1274-1278 (1979).
- Tan, J. L., et al. Cells lying on a bed of microneedles: an approach to isolate mechanical force. Proceedings of the National Academy of Sciences. 100 (4), 1484-1489 (2003).
- Rokhzan, R., et al. high-throughput measurements of cell contraction and endothelial barrier function. Laboratory Investigation. 99 (1), 138-145 (2019).
- Park, C. Y., et al. High-throughput screening for modulators of cellular contractile force. Integrative Biology. 7 (10), 1318-1324 (2015).
- Kaylan, K. B., Kourouklis, A. P., Underhill, G. H. A high-throughput cell microarray platform for correlative analysis of cell differentiation and traction forces. Journal of Visualized Experiments. (121), e55362 (2017).
- Huang, Y., et al. Traction force microscopy with optimized regularization and automated Bayesian parameter selection for comparing cells. Scientific Reports. 9, 539 (2019).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLOS ONE. 6, 17833 (2011).
- Pushkarsky, I., et al. Elastomeric sensor surfaces for high-throughput single-cell force cytometry. Nature Biomedical Engineering. 2 (2), 124-137 (2018).
- Pushkarsky, I. FLECS technology for high-throughput single-cell force biology and screening. ASSAY and Drug Development Technologies. 16 (1), 7-11 (2017).
- Koziol-White, C. J., et al. Inhibition of PI3K promotes dilation of human small airways in a rho kinase-dependent manner. British Journal of Pharmacology. 173 (18), 2726-2738 (2016).
- Orfanos, S., et al. Obesity increases airway smooth muscle responses to contractile agonists. American Journal of Physiology-Lung Cellular and Molecular Physiology. 315 (5), 673-681 (2018).
- Tseng, P., Pushkarsky, I., Carlo, D. D. Metallization and biopatterning on ultra-flexible substrates via dextran sacrificial layers. PLOS ONE. 9, 106091 (2014).
- Yoo, E. J., et al. Gα12 facilitates shortening in human airway smooth muscle by modulating phosphoinositide 3-kinase-mediated activation in a RhoA-dependent manner. British Journal of Pharmacology. 174 (4), 4383-4395 (2017).
- MacGlashan, D., Vilariño, N. Polymerization of actin does not regulate desensitization in human basophils. Journal of Leukocyte Biology. 85 (4), 627-637 (2009).
- Hocking, D. C., Sottile, J., Langenbach, K. J. Stimulation of integrin-mediated cell contractility by fibronectin polymerization. Journal of Biological Chemistry. 275 (14), 10673-10682 (2000).
- Tolić-Nørrelykke, I. M., Wang, N. Traction in smooth muscle cells varies with cell spreading. Journal of Biomechanics. 38 (7), 1405-1412 (2005).
- Ye, G. J. C., et al. The contractile strength of vascular smooth muscle myocytes is shape dependent. Integrative Biology. 6 (2), 152-163 (2014).

