マイクロパターンエラストマーを使用したシングルセル収縮性の簡素化されたハイスループット分析
Summary
この研究は、蛍光タンパク質マイクロパターンの可視化された変位に基づいて単一細胞収縮力の単純化されたハンズオフ定量化のために、マイクロウェルフォーマットで蛍光標識エラストマー収縮性表面(FLECS)技術を利用するための柔軟なプロトコルを提示する。
Abstract
細胞収縮力生成は、事実上すべての細胞に共通する基本的な形質である。これらの収縮力は、適切な発達に不可欠であり、細胞レベルと組織レベルの両方で機能し、体内の機械的システムを調節する。多数の生物学的プロセスは、運動性、接着、および単一細胞の分裂、ならびに心臓、膀胱、肺、腸、および子宮などの器官の収縮および弛緩を含む、力に依存する。適切な生理学的機能を維持する上での重要性を考えると、細胞収縮性はまた、誇張または破壊されたときに疾患プロセスを促進する可能性がある。喘息、高血圧、早産、線維性瘢痕化、および不活動膀胱はすべて、細胞収縮力の適切な制御によって潜在的に緩和され得る機械的に駆動される疾患プロセスの例である。ここでは、蛍光標識エラストマー収縮性表面(FLECS)として知られる新しいマイクロプレートベースの収縮性アッセイ技術を利用するための包括的なプロトコルを提示し、単一細胞収縮性の簡便で直感的な分析を大規模に行うことができます。本明細書では、我々は、原発性ヒト膀胱平滑筋細胞の収縮に対する2つの収縮阻害剤の効果を記述する2つの6点用量反応曲線を得るための段階的なプロトコールを、単一のFLECSアッセイマイクロプレートを利用する簡単な手順で提供し、この方法の使用者に適切な技術を実証する。FLECS技術を使用すると、基本的な生物学研究所と蛍光顕微鏡システムを持つすべての研究者は、この基本的ではあるが定量化が困難な機能的な細胞表現型の研究にアクセスでき、力生物学の分野への参入障壁を効果的に低下させ、収縮性細胞力の表現型スクリーニング。
Introduction
細胞が生成する機械的な力は、腸、膀胱、心臓など、全身のさまざまな臓器で適切に機能するために不可欠です。これらの器官は、内部恒常性状態を維持するために、細胞収縮および弛緩の安定したパターンを生成しなければならない。異常な平滑筋細胞(SMC)の収縮は、例えば、腸平滑筋収縮の異常なパターンを特徴とする腸運動障害1、ならびに過活動2 または低活動膀胱3の泌尿器科的状態を含む様々な障害の発症をもたらし得る。気道内では、不規則な収縮パターンを示すSMCが喘息過敏症4を引き起こし、気道を締め付け、肺への酸素の気流を減少させる可能性があります。もう一つの広範な身体状態である高血圧症は、血管内の平滑筋収縮の変動によって引き起こされます5。明らかに、細胞および組織内の収縮メカニズムは、治療の選択肢を必要とする疾患につながる可能性がある。これらの状態は間違いなく細胞の機能不全の収縮挙動に由来するため、潜在的な薬物候補をスクリーニングする際には、細胞の収縮機能自体を測定することが論理的かつ必要になります。
細胞収縮力を研究するためのツールの必要性を認識し、牽引力顕微鏡(TFM)6、マイクロパターンTFM7、フローティングゲルアッセイ8、エラストマーマイクロポストアッセイ9を含むいくつかの定量的収縮アッセイ法が学術研究者によって開発されています。これらの技術は、多くの研究でシングルディッシュ形式およびマルチウェルプレート形式で利用されており、3次元力測定にも提案されています10,11,12,13,14。これらの技術は、細胞力生物学の広大な分野で先駆的な研究を可能にしましたが、それらはすべて、TFM基質を製造する能力、TFM変位マップを解決するために複雑で直感的でないアルゴリズムを適切に適用する能力、およびステージからのサンプル除去の前後に撮影された画像を登録できる比較的正確な顕微鏡システム(細胞解離用)など、特定の能力とリソースを持つラボに大きく制限されていました。したがって、訓練を受けていない研究者にとって、これらの技術を適用するための広範な要件を考えると、これらの方法を使用するための参入障壁は非常に高くなる可能性があります。さらに、多くの既存技術(40倍以上の目標)に必要なイメージング分解能は実験スループットを大幅に制限する可能性があり、バルク測定技術は外れ値細胞からの寄与を隠し、より穏やかな収縮差の発見を妨げる可能性があります。注目すべきは、著者らが認識している限り、低スループットで半定量的なフローティングゲルアッセイアプローチのみが十分に成熟し、研究者が利用できるようになったことです(図1参照)。
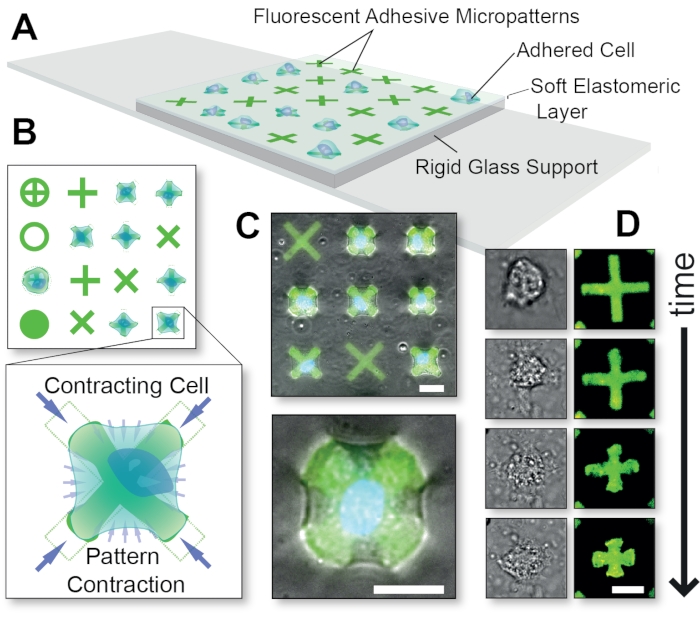
図1:FLECS技術法の全体的な概略図。(A)細胞は、ガラスで支持された薄いエラストマー層に共有結合で埋め込まれた接着タンパク質マイクロパターンに接着される。(B)様々な可能なマイクロパターン形状の上面図と、「X」字型のマイクロパターンを収縮させるセルの爆破。(c)収縮細胞の蛍光マイクロパターンと位相差画像のオーバーレイ。(D)単一の収縮細胞の経時変化画像。スケールバー = 25 μm。この図はプシュカルスキーらの許可を得て翻案された15。この図の拡大版を表示するには、ここをクリックしてください。
マイクロテクノロジーの最近の進歩に続いて、著者らは、FLECS(蛍光標識されたエラストマー収縮性表面)と呼ばれる数十万の細胞における単一細胞収縮の定量的測定を可能にするマイクロプレートベースの技術を開発しました15,16,17,18,19,20。、TFM の代替として。このアプローチでは、蛍光タンパク質のマイクロパターンが柔らかいフィルムに埋め込まれ、細胞が牽引力を加えると変形および収縮します。重要なことに、タンパク質マイクロパターンは細胞の位置、形状、および広がり領域を制約し、均一な試験条件をもたらす。これらは、4倍の倍率画像でも空間的に高度に分解される寸法変化のみに基づいて簡単な測定を可能にします。この方法は、ブラウザベースの画像解析モジュールを含み、繊細な取り扱い手順や受託者マーカーの登録を必要とせずに、収縮性細胞力の簡単な解析を可能にし、基本的な細胞培養施設と低倍率の単純な蛍光顕微鏡を備えた研究者であれば誰でも操作できるはずです(図2).この技術は、すぐに入手でき、市販されており、エンドユーザーを念頭に置いて設計されており、実験室の科学者が細胞力生物学を研究するための参入障壁を減らすことを目的としています。

図2:単一細胞収縮性アッセイ用の24ウェルプレートフォーマットの概略図。 この形式は、ここに記載されている実験で使用され、記事のビデオ部分に描かれています。スケール バー = 25 μm。 この図の拡大版を表示するには、ここをクリックしてください。
この研究では、FLECSテクノロジープラットフォームの24ウェルプレート形式を適用して、原発性膀胱平滑筋細胞の細胞収縮性に対する力調節薬の効果を定量化するためのプロトコルを提示する。この汎用プロトコルは、関心のある他のさまざまなタイムスケール、細胞型、および治療条件を説明するために必要に応じて適応および変更することができ、力生物学における他の質問に答えるためにスケーリングすることができる。
Protocol
Representative Results
Discussion
標準的な顕微鏡検査機器のみを使用して、異なる処理条件下で一度に数十万個の細胞の収縮を定量的に測定するこの簡素化された方法は、研究者が細胞力生物学を研究するための従来のTFMのアクセス可能な代替手段を提供します。提示された技術は、規則的な形状の蛍光マイクロパターンの変化を分析することによって細胞収縮の視覚的表示を提供するので、任意の細胞によって生成される収縮の大きさは直感的に理解される – マイクロパターンが小さいほど、細胞によって加えられる収縮力は大きくなる。
特に、マイクロパターン(細胞収縮性を調節することが知られているすべての因子22,23,24)を含む形状、拡散領域、接着分子などの因子を制御することにより、提示された技術は、細胞収縮研究の解釈を混乱させる可能性のある追加の変数を体系的に排除する。
本実験では、ゲルに10kPaの剛性を用い、IV型コラーゲンからなる70μm(対角線長)のマイクロパターンを用いた。これらのパラメータに加えて、接着分子は、様々なコラーゲン、フィブロネクチン、ゼラチン、および他の細胞外マトリックス(ECM)で置き換えることができる。ゲルの剛性は、0.1kPaまで、そしてMPa範囲まで調整することができます。マイクロパターン形状は、約5μmの最小特徴サイズを有する任意の形状になるようにde novoを設計することができる。これらのパラメータは分離されており、特定の生物学的文脈に対して独立して最適化することができる。
この技術は、様々な平滑筋細胞型(初代ヒト膀胱、腸管、気管、気管支、子宮、大動脈、動脈)、間葉系幹細胞およびその分化子孫、種々の線維芽細胞(肺、真皮、および心臓)、筋線維芽細胞、および内皮細胞を含む間葉表現型の高接着性および収縮性細胞型と適合性があることが広く検証されている。さらに、単球由来マクロファージは、特にマイクロパターンが既知のオプソニンからなる場合、マイクロパターン上に大きな測定可能な貪食力も生じるであろう。種々の癌株もまた、この方法を用いてアッセイすることができる。
この方法は、T細胞や好中球などの比較的小さい細胞、または主に上皮表現型を有する細胞型での使用にいくつかの課題を提起する可能性がある。この主な理由は、測定可能な収縮シグナルを生成するために、この方法がマイクロパターン上の強い接着および細胞の完全な広がりに依存しているからである。弱く結合する、互いに結合する、または完全に広がらない細胞は、測定可能な収縮シグナルを産生しない。これらの挙動は比較的まれですが、マイクロパターンのサイズを小さく調整するか、マイクロパターン内で接着と拡散をよりよく促進する代替接着分子を使用することによって軽減できます。
この技術のユーザーは、異なる成分、成長因子、血清レベル、およびpH感受性が異なる細胞において変動する挙動を駆動する可能性があるため、関心のある特定の細胞タイプに対して異なる可能な細胞培養培地製剤を慎重に評価しなければならない。プロトコルの最適化は、実験ワークフローのスケーリングに先立って行うべきであり、メディアコンポーネントは常に新鮮で無菌で、以前のバッチと一貫していなければならない。
最終的に、シングルセル分解能がユーザーの目標に必要でない場合、またはターゲットセルタイプが最小の拡散容量を有する場合、従来のTFMはそのような実験に同等またはより適している可能性がある。著者らの目的と希望は、このツールが、特に自動化されたハイスループット表現型薬物スクリーニングの文脈において、細胞生物学者が細胞収縮を研究するためのさらなる道を提供することである。
薬物スクリーニングにおける将来の使用に特有の、384ウェルFLECSプレートなどのより高いスループットプレートが使用されてもよい。このようなプレートでは、多くの顕微鏡の4倍の対物レンズが視野内の単一のウェル全体をキャプチャし、すべての細胞収縮応答を確実にキャプチャできます。ハイスループットイメージングシステムを使用することで、384ウェルプレート全体を約5分でイメージングできるため、他のオプションよりも劇的に高速であるため、ハイスループット表現型創薬に適しています。実際、著者らは、自動化を使用して、約50の384ウェルプレート(合計19,000ウェル以上)で毎週薬物スクリーニングを定期的に実行しています。
Disclosures
The authors have nothing to disclose.
Acknowledgements
実験室での研究は、Forcyteが研究活動を後援しているUCLA Molecular Shared Screening Resource(MSSR)と、Forcyte Biotechnologies, Inc.が常駐企業であるCalifornia NanoSystems Institute(CNSI)のMagnify Incubatorの支援を受けて実施されました。著者らは、要求に応じて、すべての学術研究者に Biodock.ai のFLECS分析モジュールへのアクセスを許可します。L.H.とI.P.はこの仕事に等しく貢献しました。
Materials
| Bladder smooth muscle cell culture | Sciencell | #4310 | |
| Blebbistatin | Sigma-Aldrich | B0560 | |
| Cell culture media | Thermofisher | 11765054 | Ham's F12 medium supplemented with 10% FBS and 1% p/s |
| Cell strainer | Fisher Scientific | 7201432 | |
| Conical Tube | Fisher Scientific | 05-539-13 | |
| Culture flask | Fisher Scientific | FB012941 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| DMSO (Dimethyl sulfoxide) | Fisher Scientific | D1284 | |
| Eppendorf tubes | Fisher Scientific | 05-402-31 | |
| Fluorescent microscope | Molecular Devices | ImageXpress Confocal | |
| Forcyte-manufactured 24-well plate | Forcyte Biotechnologies | 24-HC4R-X1-QB12 | |
| Hoescht 3342 Live Nuclear Stain | Thermofisher | 62249 | |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP39920 |
References
- Ohama, T., Hori, M., Ozaki, H. Mechanism of abnormal intestinal motility in inflammatory bowel disease: How smooth muscle contraction is reduced. Journal of Smooth Muscle Research. 43 (2), 43-54 (2007).
- Peyronnet, B., et al. A comprehensive review of overactive bladder pathophysiology: On the way to tailored treatment. European Urology. 75 (6), 988-1000 (2019).
- Aldamanhori, R., Osman, N. I., Chapple, C. R. Underactive bladder: Pathophysiology and clinical significance. Asian Journal of Urology. 5 (1), 17-21 (2018).
- Sanderson, M. J., Delmotte, P., Bai, Y., Perez-Zogbhi, J. F. Regulation of airway smooth muscle cell contractility by Ca2+ signaling and sensitivity. Proceedings of the American Thoracic Society. 5 (1), 23-31 (2008).
- Brozovich, F. V., et al. Mechanisms of vascular smooth muscle contraction and the basis for pharmacologic treatment of smooth muscle disorders. Pharmacological Reviews. 68 (2), 476-532 (2016).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophysical Journal. 80 (4), 1744-1757 (2001).
- Tseng, Q., et al. A new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab on a Chip. 11 (13), 2231-2240 (2011).
- Bell, E., Ivarsson, B., Merrill, C. Production of a tissue-like structure by contraction of collagen lattices by human fibroblasts of different proliferative potential in vitro. Proceedings of the National Academy of Sciences. 76 (3), 1274-1278 (1979).
- Tan, J. L., et al. Cells lying on a bed of microneedles: an approach to isolate mechanical force. Proceedings of the National Academy of Sciences. 100 (4), 1484-1489 (2003).
- Rokhzan, R., et al. high-throughput measurements of cell contraction and endothelial barrier function. Laboratory Investigation. 99 (1), 138-145 (2019).
- Park, C. Y., et al. High-throughput screening for modulators of cellular contractile force. Integrative Biology. 7 (10), 1318-1324 (2015).
- Kaylan, K. B., Kourouklis, A. P., Underhill, G. H. A high-throughput cell microarray platform for correlative analysis of cell differentiation and traction forces. Journal of Visualized Experiments. (121), e55362 (2017).
- Huang, Y., et al. Traction force microscopy with optimized regularization and automated Bayesian parameter selection for comparing cells. Scientific Reports. 9, 539 (2019).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLOS ONE. 6, 17833 (2011).
- Pushkarsky, I., et al. Elastomeric sensor surfaces for high-throughput single-cell force cytometry. Nature Biomedical Engineering. 2 (2), 124-137 (2018).
- Pushkarsky, I. FLECS technology for high-throughput single-cell force biology and screening. ASSAY and Drug Development Technologies. 16 (1), 7-11 (2017).
- Koziol-White, C. J., et al. Inhibition of PI3K promotes dilation of human small airways in a rho kinase-dependent manner. British Journal of Pharmacology. 173 (18), 2726-2738 (2016).
- Orfanos, S., et al. Obesity increases airway smooth muscle responses to contractile agonists. American Journal of Physiology-Lung Cellular and Molecular Physiology. 315 (5), 673-681 (2018).
- Tseng, P., Pushkarsky, I., Carlo, D. D. Metallization and biopatterning on ultra-flexible substrates via dextran sacrificial layers. PLOS ONE. 9, 106091 (2014).
- Yoo, E. J., et al. Gα12 facilitates shortening in human airway smooth muscle by modulating phosphoinositide 3-kinase-mediated activation in a RhoA-dependent manner. British Journal of Pharmacology. 174 (4), 4383-4395 (2017).
- MacGlashan, D., Vilariño, N. Polymerization of actin does not regulate desensitization in human basophils. Journal of Leukocyte Biology. 85 (4), 627-637 (2009).
- Hocking, D. C., Sottile, J., Langenbach, K. J. Stimulation of integrin-mediated cell contractility by fibronectin polymerization. Journal of Biological Chemistry. 275 (14), 10673-10682 (2000).
- Tolić-Nørrelykke, I. M., Wang, N. Traction in smooth muscle cells varies with cell spreading. Journal of Biomechanics. 38 (7), 1405-1412 (2005).
- Ye, G. J. C., et al. The contractile strength of vascular smooth muscle myocytes is shape dependent. Integrative Biology. 6 (2), 152-163 (2014).

