תנועתיות של מולקולות בודדות ואשכולות של קינסין-5 Cin8 דו-כיווני מטוהרים מתאי S. cerevisiae
Summary
קינסין-5 Cin8 המיטוטי הדו-כיווני מצטבר באשכולות המתפצלים ומתמזגים במהלך תנועתיותם. הצטברות באשכולות משנה גם את המהירות והכיווניות של Cin8. כאן מתואר פרוטוקול לבדיקות תנועתיות עם Cin8-GFP מטוהר וניתוח תכונות תנועתיות של מולקולות בודדות ואשכולות של Cin8.
Abstract
מנועי הקינזין-5 הדו-קוטביים המיטוטיים מבצעים פונקציות חיוניות בדינמיקת הציר. מנועים אלה מציגים מבנה הומו-טטרמרי עם שני זוגות של תחומים מוטוריים קטליטיים, הממוקמים בקצוות מנוגדים של המתחם הפעיל. ארכיטקטורה ייחודית זו מאפשרת למנועי kinesin-5 להצליב ולהחליק זה מזה מיקרוטובולים של צירים אנטי-פאראליים (MTs), ובכך לספק את הכוח המכוון כלפי חוץ המפריד בין מוטות הציר. בעבר, מנועי kinesin-5 האמינו להיות באופן בלעדי פלוס-סוף מכוון. עם זאת, מחקרים אחרונים גילו כי מספר מנועי קינזין-5 פטרייתיים מכוונים מינוס-קצה ברמת המולקולה הבודדת ויכולים לשנות כיוון בתנאי ניסוי שונים. Saccharomyces cerevisiae kinesin-5 Cin8 הוא דוגמה לחלבון מוטורי דו-כיווני כזה: בתנאי חוזק יוני גבוהים מולקולות בודדות של Cin8 נעות בכיוון המינוס-קצה של ה-MTs. כמו כן, הודגם כי Cin8 יוצר אשכולות תנועתיים, בעיקר בקצה המינוס של ה-MTs, ואשכולות כאלה מאפשרים ל-Cin8 לשנות כיוון ולעבור תנועתיות מכוונת איטית, בתוספת קצה. מאמר זה מספק פרוטוקול מפורט לכל שלבי העבודה עם kinesin-5 Cin8 המתויג על-ידי GFP, החל מביטוי יתר של חלבונים בתאי S. cerevisiae וטיהורו ועד לבדיקת תנועתיות של מולקולה אחת במבחנה . שיטה חדשה שפותחה כאן מסייעת להבדיל בין מולקולות בודדות לאשכולות של Cin8, בהתבסס על עוצמת הפלואורסצנציה שלהם. שיטה זו מאפשרת ניתוח נפרד של תנועתיות של מולקולות בודדות ואשכולות של Cin8, ובכך מספקת את אפיון התלות של תנועתיות Cin8 בגודל האשכול שלו.
Introduction
מספר רב של אירועי תנועתיות בתוך תאים אאוקריוטים מתווכים על ידי תפקודם של חלבונים מוטוריים מולקולריים. מנועים אלה נעים לאורך חוטי השלד הציטוסקטליים, חוטי האקטין והמיקרוטובולים (MTs), וממירים את האנרגיה הכימית של הידרוליזה של ATP לכוחות קינטיים ומכניים הנדרשים להנעת תנועתיות ביולוגית בתוך התאים. S. cerevisiae Cin8 מבוסס MT הוא חלבון מוטורי דו-קוטבי, הומו-טרמרי קינזין-5, אשר מצליב ומחליק MTs צירים זה מזה1. Cin8 מבצע פונקציות חיוניות במהלך מיטוזה, בהרכבת ציר 2,3,4 והתארכות ציר במהלךאנפאזה 5,6,7. בעבר הוכח כי Cin8 הוא מנוע דו-כיווני, המחליף כיווניות בתנאי ניסוי שונים. לדוגמה, בתנאי חוזק יוני גבוה, מנועי Cin8 בודדים נעים לעבר הקצה התחתון של ה- MTs, בעוד שבאשכולות, במבחני גלישה MT מרובי מנועים, ובין MTs אנטי-פאראליים, מנועי Cin8 נעים בעיקר לעבר הקצוות החיוביים של MTs 8,9,10,11,12 . ממצאים אלה היו מאוד לא צפויים בגלל כמה סיבות. ראשית, Cin8 נושא את התחום המוטורי הקטליטי שלו בתחום האמינו-טרמינוס, ובעבר האמינו שמנועים כאלה מכוונים אך ורק ל-plus-end, בעוד ש-Cin8 הוכח כמינוס-קצה המכוון ברמת המולקולה הבודדת. שנית, מנועי קינסין נחשבו לחד-כיווניים, או מינוס-קצה או פלוס-סוף מכוון, בעוד ש-Cin8 הוכח כדו-כיווני, בהתאם לתנאי הניסוי. לבסוף, בגלל כיוון ה-MT בציר המיטוטי, התפקיד הקלאסי של מנועי קינסין-5 בהפרדת מוטות ציר במהלך מכלול הציר ואנאפאזה B יכול להיות מוסבר רק על ידי תנועתיות מכוונת פלוס-קצה שלהם על ה-MTs שהם מצליבים 1,13. בעקבות הדיווחים הראשונים על הדו-כיווניות של Cin8, כמה מנועי קינסין אחרים הודגמו כדו-כיווניים 14,15,16, מה שמצביע על כך שהתנועתיות הדו-כיוונית של מנועי קינסין עשויה להיות נפוצה יותר ממה שסברו קודם לכן.
בעבר דווח כי בתאים, Cin8 נע גם באופן דו-כיווני8, מה שתומך ברעיון שהתנועתיות הדו-כיוונית של חלק ממנועי קינסין-5 חשובה לתפקודים התוך-תאיים שלהם. בנוסף, מכיוון ששלושת מנועי הקינזין-5 שדווחו כדו-כיווניים הם מתאים פטרייתיים, הוצע לאחרונה תפקיד אפשרי לדו-כיווניות של מנועי קינסין-5 בתאים כאלה10. על פי מודל זה, במיטוזה סגורה של תאים פטרייתיים, שבה המעטפת הגרעינית אינה מתפרקת במהלך מיטוזה, מנועי קינסין-5 מספקים את הכוח הראשוני המפריד בין קטבי הציר לפני הרכבת הציר. כדי לבצע משימה זו, לפני הפרדת מוטות הציר, מנועי קינזין-5 מתמקמים ליד מוטות הציר, על ידי תנועתיות מכוונת מינוס-קצה שלהם על MTs גרעיניים בודדים. ברגע שהם נמצאים במיקום זה, מנועי kinesin-5 מקבצים, מחליפים כיווניות, לוכדים ומקשרים MTs צולבים מעמודי ציר שכנים. לאחר מכן, מנועי kinesin-5 מספקים את ההפרדה הראשונית של הקטבים על ידי תנועתיות מכוונת פלוס-קצה על ה-MTs שהם מצליבים. על פי דגם זה, הן תנועתיות מכוונת מינוס-קצה על MTs בודדים והן תנועתיות מכוונת פלוס-קצה על MTs מקושרים צולבים במהלך החלקה אנטי-פראלית נדרשים למנועי קינסין-5 פטרייתיים כדי לבצע את תפקידם בהרכבת ציר 1,13.
המטרה הכוללת של השיטה המתוארת היא להשיג קינסין-5 Cin8 פטרייתי בעל טוהר גבוה, ולבצע מבחני תנועתיות של מולקולה בודדת (איור 1) תוך ניתוח נפרד של התנועתיות של מולקולות בודדות ואשכולות של Cin8. ההפרדה בין מולקולות בודדות לאשכולות חשובה מכיוון שאחד הגורמים שהוכחו כמשפיעים על הכיווניות של Cin8 הוא הצטברותו באשכולות על MTs10,12. מבחני תנועתיות חלופיים, כגון מבחני החלקה על פני השטח של MT ומבחני הזזת MT אינם מספקים מידע לגבי פעילותם של חלבונים חד-מנועיים17,18. שיטות הבדיקה והניתוח החזקות של תנועתיות מולקולה בודדת המתוארות כאן יושמו בהצלחה כדי לאפיין היבטים שונים של מנועי קינסין-5, Cin8 ו- Kip1 10,11,12,14,19,20.
כאן מוצג פרוטוקול מפורט לביטוי יתר וטיהור של Cin8, פילמור של MTs ובדיקת תנועתיות של מולקולה אחת. יתר על כן, מתוארים גם הניתוחים להבחנה בין מולקולות בודדות לאשכולות של Cin8, ולקביעת מהירויות מנוע בודדות ואשכולות על ידי ניתוח תזוזה ממוצעת (MD) וניתוח תזוזה ריבועית ממוצעת (MSD). פרוטוקול זה נועד לסייע לחוקרים לדמיין את כל שלבי ההליכים ולסייע בפתרון בעיות מסוג זה של בדיקות.
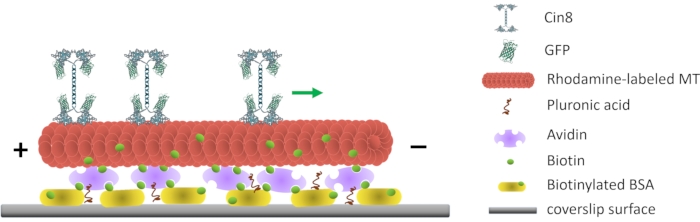
איור 1: ייצוג סכמטי של מבחן תנועתיות המולקולה הבודדת. MTs פלואורסצנטיים ביוטינילטיביים מחוברים לפני השטח של הזכוכית, מצופה באבידין המקיים אינטראקציה עם הביוטינילציה-BSA המחוברת לפני השטח. החץ הירוק מייצג את כיוון התנועה של מולקולות Cin8 בודדות בתנאי חוזק יוני גבוהים. +/- מייצגים את הקוטביות של MT. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
בעבודה זו מוצג פרוטוקול לבדיקת תנועתיות של מולקולה בודדת עם קינזין-5 Cin8 דו-כיווני וניתוח תנועתיות. ה-Cin818 באורך מלא, כולל אות הלוקליזציה הגרעינית המקומי (NLS) במסוף C טוהר מהמארח המקומי S. cerevisiae. מכיוון שה-Cin8 הוא חלבון מוטורי גרעיני, שחיקה של תאי S. cerevisiae תחת חנקן נוזלי נמצא…
Disclosures
The authors have nothing to disclose.
Acknowledgements
מחקר זה נתמך בחלקו על ידי מענק הקרן הישראלית למדע (ISF-386/18) ומענק הקרן הלאומית למדע (BSF-2019008), שהוענק ל- L.G.
Materials
| Adenine | FORMEDIUM | DOC0230 | |
| ATP | Sigma | A7699 | |
| Biotinylated-BSA | Sigma | A8549 | |
| Casein | Sigma | C7078 | |
| Catalase (C40) | Sigma | C40 | |
| Creatine-Kinase | Sigma | C3755 | |
| Dithiothreitol (DTT) | Sigma | D0632 | |
| EDTA | Sigma | E5134 | |
| EGTA | Sigma | E4378 | |
| Fluorescence filter set for GFP | Chroma | 49002: ET-EGFP (FITC/Cy2) | |
| Fluorescence filter set for Rhodamine | Chroma | 49004: ET-CY3/TRITC | |
| Fluorescence inverted microscope | Zeiss | Axiovert 200M | |
| Galactose | Tivan Biotech | GAL02 | |
| Glucose | Sigma | G8270 | |
| Glucose Oxidase | Sigma | G7141 | |
| Glycerol | Sigma | G5516 | |
| GlycylGlycine | Merck | G0674 | |
| GMPCPP | Jana Bioscience | Nu-405L | |
| GTB | Cytoskeleton | BST01-010 | |
| GTP | Sigma | G8877 | |
| Histidine | Duchefa Biochemie | H0710.0100 | |
| ImageJ-FIJI software | https://imagej.net/plugins/trackmate/ | version 2.1.0/1.53c; Java 1.8.0_172 [64-bit] for Windows 10 | |
| Imidazole | Sigma | I0125 | |
| InstantBlue Coomassie Protein Stain | Abcam | ab119211 | |
| Lens | Zeiss | 100x/1.4 oil DIC objective | |
| Lysine | FORMEDIUM | DOC0161 | |
| Magnesium Chloride | Sigma | M8266 | |
| Methionine | Duchefa Biochemie | M0715.0100 | |
| Neo | Andor Technologies | sCMOS camera | |
| NeutraAvidin | Life | A2666 | |
| Ni-NTA Agarose | Invitrogen | R901-15 | |
| Phospho-Creatine | Sigma | P1937 | |
| Pipes | Sigma | P1851 | |
| Pluronic acid F-127 (poloxamer) | Sigma | P2443 | |
| Potassium Chloride | Sigma | P9541 | |
| Raffinose | Tivan Biotech | RAF01 | |
| Size Exclusion chromatography instument | GE Healthcare | AKTA Pure | |
| Spectrophotometer | ThermoFisher Scientific | NanoDrop | |
| Superose-6 10/300 GL | GE Healthcare | 17-5172-01 | |
| Tris | Roshe | 10708976001 | |
| Triton X-100 | Sigma | T8787 | |
| Tryptophan | Duchefa Biochemie | T0720.0100 | |
| Tubulin protein | Cytoskeleton | T240 | |
| Tubulin, biotinylated | Cytoskeleton | T333P | |
| Tubulin, TRITC Rhodamine | Cytoskeleton | TL530M | |
| Uracil | Sigma | U0750-100G | |
| Yeast nitrogen base | FORMEDIUM | CYN0401S | |
| α-GFP antibody | Santa Cruz Biotechnology | SC8036 | |
| β-mercaptoethanol | Sigma | M3148 |
References
- Singh, S. K., Pandey, H., Al-Bassam, J., Gheber, L. Bidirectional motility of kinesin-5 motor proteins: structural determinants, cumulative functions and physiological roles. Cellular and Molecular Life Sciences. 75 (10), 1757-1771 (2018).
- Hoyt, M. A., He, L., Totis, L., Saunders, W. S. Loss of function of Saccharomyces cerevisiae kinesin-related CIN8 and KIP1 is suppressed by KAR3 motor domain mutations. 遗传学. 135 (1), 35-44 (1993).
- Saunders, W. S., Hoyt, M. A. Kinesin-related proteins required for structural integrity of the mitotic spindle. Cell. 70 (3), 451-458 (1992).
- Hoyt, M. A., He, L., Loo, K. K., Saunders, W. S. Two Saccharomyces cerevisiae kinesin-related gene products required for mitotic spindle assembly. Journal of Cell Biology. 118 (1), 109-120 (1992).
- Gerson-Gurwitz, A., et al. Mid-anaphase arrest in S. cerevisiae cells eliminated for the function of Cin8 and dynein. Cellular and Molecular Life Sciences. 66 (2), 301-313 (2009).
- Fridman, V., Gerson-Gurwitz, A., Movshovich, N., Kupiec, M., Gheber, L. Midzone organization restricts interpolar microtubule plus-end dynamics during spindle elongation. EMBO Reports. 10 (4), 387-393 (2009).
- Movshovich, N., et al. Slk19-dependent mid-anaphase pause in kinesin-5-mutated cells. Journal of Cell Science. 121 (15), 2529-2539 (2008).
- Gerson-Gurwitz, A., et al. Directionality of individual kinesin-5 Cin8 motors is modulated by loop 8, ionic strength and microtubule geometry. Embo Journal. 30 (24), 4942-4954 (2011).
- Roostalu, J., et al. Directional switching of the kinesin Cin8 through motor coupling. Science. 332 (6025), 94-99 (2011).
- Shapira, O., Goldstein, A., Al-Bassam, J., Gheber, L. A potential physiological role for bi-directional motility and motor clustering of mitotic kinesin-5 Cin8 in yeast mitosis. Journal of Cell Science. 130 (4), 725-734 (2017).
- Goldstein-Levitin, A., Pandey, H., Allhuzaeel, K., Kass, I., Gheber, L. Intracellular functions and motile properties of bi-directional kinesin-5 Cin8 are regulated by neck linker docking. eLife. 10, 71036 (2021).
- Pandey, H., et al. Drag-induced directionality switching of kinesin-5 Cin8 revealed by cluster-motility analysis. Science Advances. 7 (6), 1687 (2021).
- Pandey, H., Popov, M., Goldstein-Levitin, A., Gheber, L. Mechanisms by which kinesin-5 motors perform their multiple intracellular functions. International Journal of Molecular Sciences. 22 (12), 6420 (2021).
- Fridman, V., et al. Kinesin-5 Kip1 is a bi-directional motor that stabilizes microtubules and tracks their plus-ends in vivo. Journal of Cell Science. 126, 4147-4159 (2013).
- Edamatsu, M. Bidirectional motility of the fission yeast kinesin-5, Cut7. Biochemical and Biophysical Research Communications. 446 (1), 231-234 (2014).
- Popchock, A. R., et al. The mitotic kinesin-14 KlpA contains a context-dependent directionality switch. Nature Communications. 8, 13999 (2017).
- Bodrug, T., et al. The kinesin-5 tail domain directly modulates the mechanochemical cycle of the motor domain for anti-parallel microtubule sliding. eLife. 9 (9), 51131 (2020).
- Gheber, L., Kuo, S. C., Hoyt, M. A. Motile properties of the kinesin-related Cin8p spindle motor extracted from Saccharomyces cerevisiae cells. Journal of Biological Chemistry. 274 (14), 9564-9572 (1999).
- Pandey, H., et al. Flexible microtubule anchoring modulates the bi-directional motility of the kinesin-5 Cin8. Cellular and Molecular Life Sciences. 78 (16), 6051-6068 (2021).
- Shapira, O., Gheber, L. Motile properties of the bi-directional kinesin-5 Cin8 are affected by phosphorylation in its motor domain. Scientific Reports. 6, 25597 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Britto, M., et al. Schizosaccharomyces pombe kinesin-5 switches direction using a steric blocking mechanism. Proceedings of the National Academy of Sciences of the United States of America. 113 (47), 7483-7489 (2016).
- Kapitein, L. C., et al. Microtubule cross-linking triggers the directional motility of kinesin-5. Journal of Cell Biology. 182 (3), 421-428 (2008).
- Furuta, K., Edamatsu, M., Maeda, Y., Toyoshima, Y. Y. Diffusion and directed movement in vitro motile properties of fission yeast kinesin-14 Pkl1. Journal of Biological Chemistry. 283 (52), 36465-36473 (2008).
- Katrukha, E. A., et al. Probing cytoskeletal modulation of passive and active intracellular dynamics using nanobody-functionalized quantum dots. Nature Communications. 8, 14772 (2017).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Jakobs, M. A. H., Dimitracopoulos, A., Franze, K. KymoBulter, a deep learning software for automated kymograph analysis. eLife. 8, 42288 (2019).

