Confronto diretto tra lo scattering Raman stimolato iperspettrale e la microscopia a dispersione raman coerente anti-Stokes per l'imaging chimico
Summary
Questo documento confronta direttamente la risoluzione, la sensibilità e i contrasti di imaging dello scattering Raman stimolato (SRS) e dello scattering Raman anti-Stokes coerente (CARS) integrati nella stessa piattaforma del microscopio. I risultati mostrano che CARS ha una migliore risoluzione spaziale, SRS offre migliori contrasti e risoluzione spettrale ed entrambi i metodi hanno una sensibilità simile.
Abstract
Lo scattering Raman stimolato (SRS) e la microscopia a dispersione Raman (CARS) coerente anti-Stokes sono le tecnologie di imaging a dispersione Raman coerente più utilizzate. L’imaging iperspettrale SRS e CARS offre informazioni spettrali Raman su ogni pixel, che consente una migliore separazione di diverse composizioni chimiche. Sebbene entrambe le tecniche richiedano due laser di eccitazione, i loro schemi di rilevamento del segnale e le proprietà spettrali sono molto diversi. L’obiettivo di questo protocollo è quello di eseguire sia l’imaging iperspettrale SRS che CARS su un’unica piattaforma e confrontare le due tecniche di microscopia per l’imaging di diversi campioni biologici. Il metodo di messa a fuoco spettrale viene impiegato per acquisire informazioni spettrali utilizzando laser a femtosecondi. Utilizzando campioni chimici standard, vengono confrontate la sensibilità, la risoluzione spaziale e la risoluzione spettrale di SRS e CARS nelle stesse condizioni di eccitazione (ad esempio, potenza al campione, tempo di permanenza dei pixel, obiettivo, energia dell’impulso). I contrasti di imaging di CARS e SRS per campioni biologici sono giustapposti e confrontati. Il confronto diretto delle prestazioni di CARS e SRS consentirebbe una selezione ottimale della modalità per l’imaging chimico.
Introduction
Il fenomeno dello scattering Raman fu osservato per la prima volta nel 1928 da C. V. Raman1. Quando un fotone incidente interagisce con un campione, può verificarsi spontaneamente un evento di scattering anelastico, in cui il cambiamento di energia del fotone corrisponde a una transizione vibrazionale delle specie chimiche analizzate. Questo processo non richiede l’uso di un tag chimico, rendendolo uno strumento versatile e privo di etichette per l’analisi chimica riducendo al minimo le perturbazioni del campione. Nonostante i suoi vantaggi, lo scattering Raman spontaneo soffre di una bassa sezione trasversale di scattering (tipicamente 1011 inferiore alla sezione trasversale di assorbimento a infrarossi [IR]), che richiede lunghi tempi di acquisizione per l’analisi2. Pertanto, la ricerca di aumentare la sensibilità del processo di scattering Raman è essenziale per spingere le tecnologie Raman per l’imaging in tempo reale.
Un modo efficace per migliorare notevolmente la sensibilità dello scattering Raman è attraverso processi di scattering Raman coerenti (CRS), per i quali due impulsi laser sono tipicamente utilizzati per eccitare le transizioni vibrazionali molecolari 3,4. Quando la differenza di energia fotonica tra i due laser corrisponde alle modalità vibrazionali delle molecole campione, verranno generati forti segnali Raman. I due processi CRS più comunemente usati per l’imaging sono lo scattering raman anti-Stokes coerente (CARS) e lo scattering Raman stimolato (SRS)5. Negli ultimi due decenni, gli sviluppi tecnologici hanno avanzato le tecniche di microscopia CARS e SRS per diventare potenti strumenti per la quantificazione senza etichette e la delucidazione dei cambiamenti chimici nei campioni biologici.
L’imaging chimico mediante microscopia CARS può essere datato al 1982, quando la scansione laser è stata applicata per la prima volta per acquisire immagini CARS, dimostrata da Duncan et al6. La modernizzazione della microscopia CARS è stata notevolmente accelerata dopo le ampie applicazioni della microscopia a fluorescenza multifotone a scansione laser7. I primi lavori del gruppo Xie che utilizzano laser ad alto tasso di ripetizione hanno trasformato CARS in una piattaforma di imaging chimico ad alta velocità, priva di etichette, per la caratterizzazione di molecole in campioni biologici 8,9,10. Uno dei principali problemi per l’imaging CARS è la presenza di uno sfondo non consonante, che riduce il contrasto dell’immagine e distorce lo spettro Raman. Sono stati fatti molti sforzi per ridurre lo sfondo non consonante 11,12,13,14,15 o per estrarre segnali Raman risonanti dagli spettri CARS 16,17. Un altro progresso che ha notevolmente migliorato il campo è l’imaging CARS iperspettrale, che consente la mappatura spettrale di ogni pixel dell’immagine con una migliore selettività chimica 18,19,20,21.
Lo scattering Raman stimolato (SRS) è una tecnologia di imaging più giovane di CARS, sebbene sia stata scoperta prima del22. Nel 2007, la microscopia SRS è stata segnalata utilizzando una sorgente laser a basso tasso di ripetizione23. Ben presto, diversi gruppi hanno dimostrato l’imaging SRS ad alta velocità utilizzando laser ad alto tasso di ripetizione 24,25,26. Uno dei principali vantaggi della microscopia SRS rispetto a CARS è l’assenza dello sfondo non consonante27, sebbene altri sfondi come la modulazione multifase (XPM), l’assorbimento transitorio (TA), l’assorbimento a due fotoni (TPA) e l’effetto fototermico (PT), possano verificarsi con SRS28. Inoltre, il segnale SRS e la concentrazione del campione hanno relazioni lineari, a differenza di CARS, che ha una dipendenza quadratica segnale-concentrazione29. Ciò semplifica la quantificazione chimica e l’unmixing spettrale. L’SRS multicolore e iperspettrale si è evoluto in diverse forme 30,31,32,33,34,35,36, con la messa a fuoco spettrale che è uno degli approcci più popolari per l’imaging chimico 37,38.
Sia CARS che SRS richiedono la messa a fuoco della pompa e dei raggi laser Stokes sul campione per abbinare la transizione vibrazionale delle molecole per l’eccitazione del segnale. Anche i microscopi CARS e SRS hanno molto in comune. Tuttavia, la fisica alla base di questi due processi e le rilevazioni di segnali coinvolte in queste tecnologie di microscopia hanno disparità 3,39. CARS è un processo parametrico che non ha un accoppiamento netto di energia fotone-molecola3. SRS, tuttavia, è un processo non parametrico e contribuisce al trasferimento di energia tra fotoni e sistemi molecolari27. In CARS, viene generato un nuovo segnale alla frequenza anti-Stokes, mentre SRS si manifesta come il trasferimento di energia tra la pompa e i raggi laser Stokes.
Il segnale CARS soddisfa Eq (1)28.
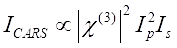 (1)
(1)
Nel frattempo, il segnale SRS può essere scritto come Eq (2)28.
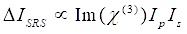 (2)
(2)
Qui, Ip, Is, ICARS e ΔISRS sono rispettivamente le intensità del fascio della pompa, del fascio di Stokes, del segnale CARS e dei segnali SRS. χ(3) è la suscettibilità ottica non lineare del terzo ordine del campione ed è un valore complesso composto da parti reali e immaginarie.
Queste equazioni esprimono i profili spettrali e la dipendenza dalla concentrazione del segnale di CARS e SRS. Le differenze nella fisica si traducono in schemi di rilevamento disparati per queste due tecnologie di microscopia. Il rilevamento del segnale in CARS di solito comporta la separazione spettrale di fotoni di nuova generazione e il rilevamento utilizzando un tubo fotomoltiplicatore (PMT) o un dispositivo ad accoppiamento di carica (CCD); per SRS, lo scambio di energia tra la pompa e i fasci di Stokes viene solitamente misurato mediante modulazione di intensità ad alta velocità utilizzando un modulatore ottico e demodulazione utilizzando un fotodiodo (PD) abbinato a un amplificatore lock-in.
Sebbene molti sviluppi tecnologici e applicazioni siano stati pubblicati negli ultimi anni sia in ambito CARS che SRS, non sono stati eseguiti confronti sistematici delle due tecniche CRS sulla stessa piattaforma, in particolare per la microscopia iperspettrale CARS e SRS. Confronti diretti in sensibilità, risoluzione spaziale, risoluzione spettrale e capacità di separazione chimica consentirebbero ai biologi di selezionare la migliore modalità per la quantificazione chimica. In questo protocollo, vengono forniti passaggi dettagliati per costruire una piattaforma di imaging multimodale con entrambe le modalità CARS iperspettrale e SRS basate su un sistema laser a femtosecondi e messa a fuoco spettrale. Le due tecniche sono state confrontate in avanti per la risoluzione spettrale, la sensibilità di rilevamento, la risoluzione spaziale e i contrasti di imaging delle cellule.
Protocol
Representative Results
Discussion
Il protocollo qui presentato descrive la costruzione di un microscopio CRS multimodale e il confronto diretto tra CARS e SRS imaging. Per la costruzione del microscopio, i passaggi critici sono la sovrapposizione del fascio spaziale e temporale e l’ottimizzazione delle dimensioni del fascio. Si consiglia di utilizzare un campione standard come DMSO prima dell’imaging biologico per ottimizzare l’SNR e calibrare gli spostamenti Raman. Il confronto diretto tra le immagini CARS e SRS rivela che CARS ha una migliore risoluzio…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questa ricerca è stata supportata dal fondo di avvio del Dipartimento di Chimica della Purdue University.
Materials
| 2D galvo scanner set | Thorlabs | GVS002 | |
| Acousto-optic modulator | Isomet | M1205-P80L-0.5 | |
| AOM driver | Isomet | 532B-2 | |
| Data acquisition card | National Instruments | PCle 6363 | Custom ordered filter (980 sp) |
| Delay stage | Zaber | X-LSM050A | |
| Deuterium oxide | Millipore Sigma | 151882-100G | |
| Dichroic mirror for beam combination | Thorlabs | DMLP1000 | |
| Dichroic mirror for signal separation | Semrock | FF776-Di01-25×36 | |
| DMSO | MiliporeSigma | 200-664-3 | |
| MIA PaCa 2 Cells | ATCC | CRL-1420 | |
| Femtosecond laser system | Spectral Physics | InSightX3+ | |
| Filter for CARS | Chroma | AT655/30m | |
| Filter for SRS | Chroma | ET980sp | |
| Function generator | Rigol | DG1022Z | |
| Glass rods | Lattice Electro Optics | SF-57 | |
| Half-wave plate | Newport | 10RP02-51; 10RP02-46 | |
| LabVIEW 2020 | National Instruments | This is the image acquisition software | |
| Lock-in amplifier | Zurich Instrument | HF2LI | |
| Microscope housing | Olympus | BX51W1 | |
| Objective lens | Olympus | UPLSAPO60XW | |
| Origin Pro 2019b | OriginLab Corporation | This is the spectral fitting software | |
| Oscilloscope | Tektronix | TBS2204B | |
| Photodiode | Hamamatsu | S3994-01 | |
| PMT detector | Hamamatsu | H7422P-40 | |
| PMT voltage amplifier | Advanced Research Instrument Corp. | PMT4V3 | |
| Polarizing beamsplitter cube | Thorlabs | PBS255 | |
| Terminal block | National Instruments | BNC-2110 |
References
- Raman, C. V. A change of wave-length in light scattering. Nature. 121 (3051), 619 (1928).
- Li, S., Li, Y., Yi, R., Liu, L., Qu, J. Coherent anti-Stokes Raman scattering microscopy and its applications. Frontiers in Physics. 8, 515 (2020).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annual Review of Analytical Chemistry. 1 (1), 883-909 (2008).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62, 507-530 (2011).
- Suhalim, J. L., Boik, J. C., Tromberg, B. J., Potma, E. O. The need for speed. Journal of Biophotonics. 5 (5-6), 387-395 (2012).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Optics Letters. 7 (8), 350-352 (1982).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Cheng, J. -. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: instrumentation, theory, and applications. The Journal of Physical Chemistry B. 108 (3), 827-840 (2004).
- Evans, C. L., et al. Chemical imaging of tissue in vivo with video-rate coherent anti-Stokes Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16807 (2005).
- Cheng, J. -. X., Volkmer, A., Book, L. D., Xie, X. S. An epi-detected coherent anti-Stokes Raman scattering (E-CARS) microscope with high spectral resolution and high sensitivity. The Journal of Physical Chemistry B. 105 (7), 1277-1280 (2001).
- Volkmer, A., Book, L. D., Xie, X. S. Time-resolved coherent anti-Stokes Raman scattering microscopy: Imaging based on Raman free induction decay. Applied Physics Letters. 80 (9), 1505-1507 (2002).
- Marks, D. L., Boppart, S. A. Nonlinear interferometric vibrational imaging. Physical Review Letters. 92 (12), 123905 (2004).
- Ganikhanov, F., Evans, C. L., Saar, B. G., Xie, X. S. High-sensitivity vibrational imaging with frequency modulation coherent anti-Stokes Raman scattering (FM CARS) microscopy. Optics Letters. 31 (12), 1872-1874 (2006).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241-243 (2006).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363-1365 (2009).
- Masia, F., Karuna, A., Borri, P., Langbein, W. Hyperspectral image analysis for CARS, SRS, and Raman data. Journal of Raman Spectroscopy. 46 (8), 727-734 (2015).
- Knutsen, K. P., Johnson, J. C., Miller, A. E., Petersen, P. B., Saykally, R. J. High spectral resolution multiplex CARS spectroscopy using chirped pulses. Chemical Physics Letters. 387 (4-6), 436-441 (2004).
- Okuno, M., Kano, H., Leproux, P., Couderc, V., Hamaguchi, H. -. o. Ultrabroadband multiplex CARS microspectroscopy and imaging using a subnanosecond supercontinuum light source in the deep near infrared. Optics Letters. 33 (9), 923-925 (2008).
- Masia, F., Glen, A., Stephens, P., Borri, P., Langbein, W. Quantitative chemical imaging and unsupervised analysis using hyperspectral coherent anti-Stokes Raman scattering microscopy. Analytical Chemistry. 85 (22), 10820-10828 (2013).
- Pegoraro, A. F., Slepkov, A. D., Ridsdale, A., Moffatt, D. J., Stolow, A. Hyperspectral multimodal CARS microscopy in the fingerprint region. Journal of Biophotonics. 7 (1-2), 49-58 (2014).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Ploetz, E., Laimgruber, S., Berner, S., Zinth, W., Gilch, P. Femtosecond stimulated Raman microscopy. Applied Physics B. 87 (3), 389-393 (2007).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Nandakumar, P., Kovalev, A., Volkmer, A. Vibrational imaging based on stimulated Raman scattering microscopy. New Journal of Physics. 11 (3), 033026 (2009).
- Slipchenko, M. N., Le, T. T., Chen, H., Cheng, J. -. X. High-speed vibrational imaging and spectral analysis of lipid bodies by compound Raman microscopy. The Journal of Physical Chemistry B. 113 (21), 7681-7686 (2009).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62 (1), 507-530 (2011).
- Zhang, C., Zhang, D., Cheng, J. -. X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17 (1), 415-445 (2015).
- Prince, R. C., Frontiera, R. R., Potma, E. O. Stimulated Raman scattering: from bulk to nano. Chemical Reviews. 117 (7), 5070-5094 (2017).
- Lu, F. -. K., et al. Multicolor stimulated Raman scattering microscopy. Molecular Physics. 110 (15-16), 1927-1932 (2012).
- Ozeki, Y., et al. High-speed molecular spectral imaging of tissue with stimulated Raman scattering. Nature Photonics. 6 (12), 845-851 (2012).
- Wang, P., et al. Label-free quantitative imaging of cholesterol in intact tissues by hyperspectral stimulated raman scattering microscopy. Angewandte Chemie International Edition. 125 (49), 13280-13284 (2013).
- Freudiger, C. W., et al. Stimulated Raman scattering microscopy with a robust fibre laser source. Nature Photonics. 8 (2), 153-159 (2014).
- Liao, C. -. S., et al. Microsecond scale vibrational spectroscopic imaging by multiplex stimulated Raman scattering microscopy. Light: Science & Applications. 4 (3), 265 (2015).
- Liao, C. -. S., et al. Spectrometer-free vibrational imaging by retrieving stimulated Raman signal from highly scattered photons. Science Advances. 1 (9), 1500738 (2015).
- He, R., et al. Dual-phase stimulated Raman scattering microscopy for real-time two-color imaging. Optica. 4 (1), 44-47 (2017).
- Andresen, E. R., Berto, P., Rigneault, H. Stimulated Raman scattering microscopy by spectral focusing and fiber-generated soliton as Stokes pulse. Optics Letters. 36 (13), 2387-2389 (2011).
- Fu, D., Holtom, G., Freudiger, C., Zhang, X., Xie, X. S. Hyperspectral imaging with stimulated Raman scattering by chirped femtosecond lasers. The Journal of Physical Chemistry B. 117 (16), 4634-4640 (2013).
- Zhang, C., Aldana-Mendoza, J. A. Coherent Raman scattering microscopy for chemical imaging of biological systems. Journal of Physics: Photonics. , (2021).
- Martens, W. N., Frost, R. L., Kristof, J., Theo Kloprogge, J. Raman spectroscopy of dimethyl sulphoxide and deuterated dimethyl sulphoxide at 298 and 77 k. Journal of Raman Spectroscopy. 33 (2), 84-91 (2002).
- Gill, G. W., Gill, G. W. . Cytopreparation: Principles & Practice. , 309-323 (2013).
- Fu, D., et al. Imaging the intracellular distribution of tyrosine kinase inhibitors in living cells with quantitative hyperspectral stimulated Raman scattering. Nature Chemistry. 6 (7), 614-622 (2014).
- Wei, L., Yu, Y., Shen, Y., Wang, M. C., Min, W. Vibrational imaging of newly synthesized proteins in live cells by stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 110 (28), 11226-11231 (2013).
- Lu, F. -. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- Slipchenko, M. N., et al. Vibrational imaging of tablets by epi-detected stimulated Raman scattering microscopy. Analyst. 135 (10), 2613-2619 (2010).
- Slipchenko, M. N., Zhou, B., Pinal, R., Teresa Carvajal, M., Cheng, J. -. X. RAMAN-chemical imaging of solid dosage forms based on stimulated Raman scattering. American Pharmaceutical Review. 15 (3), 66 (2012).
- Sarri, B., et al. Discriminating polymorph distributions in pharmaceutical tablets using stimulated Raman scattering microscopy. Journal of Raman Spectroscopy. 50 (12), 1896-1904 (2019).
- Fussell, A. L., Kleinebudde, P., Herek, J., Strachan, C. J., Offerhaus, H. L. Coherent anti-Stokes Raman scattering (CARS) microscopy visualizes pharmaceutical tablets during dissolution. JoVE (Journal of Visualized Experiments). (89), e51847 (2014).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging). Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lim, R. S., et al. Multimodal CARS microscopy determination of the impact of diet on macrophage infiltration and lipid accumulation on plaque formation in ApoE-deficient mice [S]. Journal of Lipid Research. 51 (7), 1729-1737 (2010).
- Ji, M., et al. label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- Tabish, T. A., Narayan, R. J., Edirisinghe, M. Rapid and label-free detection of COVID-19 using coherent anti-Stokes Raman scattering microscopy. Mrs Communications. 10 (4), 566-572 (2020).
- Camp, C. H., et al. High-speed coherent Raman fingerprint imaging of biological tissues. Nature Photonics. 8 (8), 627-634 (2014).
- Wei, L., et al. Live-cell bioorthogonal chemical imaging: stimulated Raman scattering microscopy of vibrational probes. Accounts of Chemical Research. 49 (8), 1494-1502 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Nie, S., Emory, S. R. Probing single molecules and single nanoparticles by surface-enhanced Raman scattering. Science. 275 (5303), 1102-1106 (1997).
- Steuwe, C., Kaminski, C. F., Baumberg, J. J., Mahajan, S. Surface enhanced coherent anti-Stokes Raman scattering on nanostructured gold surfaces. Nano Letters. 11 (12), 5339-5343 (2011).
- Fast, A., Kenison, J. P., Syme, C. D., Potma, E. O. Surface-enhanced coherent anti-Stokes Raman imaging of lipids. Applied Optics. 55 (22), 5994-6000 (2016).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Yampolsky, S., et al. Seeing a single molecule vibrate through time-resolved coherent anti-Stokes Raman scattering. Nature Photonics. 8 (8), 650-656 (2014).

