Comparação direta da dispersão de Raman estimulada hiperespectral e microscopia de dispersão de Raman coerente para imagem química
Summary
Este artigo compara diretamente os contrastes de resolução, sensibilidade e imagem da dispersão estimulada de Raman (SRS) e da dispersão coerente anti-Stokes Raman (CARS) integrada à mesma plataforma de microscópio. Os resultados mostram que o CARS tem uma melhor resolução espacial, o SRS dá melhores contrastes e resolução espectral, e ambos os métodos têm sensibilidade semelhante.
Abstract
A dispersão estimulada de Raman (SRS) e a microscopia de dispersão anti-Stokes Raman (CARS) são as tecnologias de imagem de dispersão raman mais amplamente utilizadas. As imagens hiperespectrais SRS e CARS oferecem informações espectrais de Raman a cada pixel, o que permite uma melhor separação de diferentes composições químicas. Embora ambas as técnicas exijam dois lasers de excitação, seus esquemas de detecção de sinal e propriedades espectrais são bem diferentes. O objetivo deste protocolo é realizar imagens de SRS hiperespectrais e CARS em uma única plataforma e comparar as duas técnicas de microscopia para imagens de diferentes amostras biológicas. O método de foco espectral é empregado para adquirir informações espectrais usando lasers femtosegundos. Utilizando amostras químicas padrão, a sensibilidade, resolução espacial e resolução espectral de SRS e CARS nas mesmas condições de excitação (ou seja, energia na amostra, tempo de moradia dos pixels, lente objetiva, energia de pulso) são comparadas. Os contrastes de imagem de CARROS e SRS para amostras biológicas são justtaposed e comparados. A comparação direta dos desempenhos de CARROS e SRS permitiria a seleção ideal da modalidade para imagem química.
Introduction
O fenômeno de dispersão de Raman foi observado pela primeira vez em 1928 por C. V. Raman1. Quando um fóton incidente está interagindo com uma amostra, um evento de dispersão inelástica pode ocorrer espontaneamente, no qual a mudança de energia do fóton corresponde a uma transição vibracional das espécies químicas analisadas. Este processo não requer o uso de uma etiqueta química, tornando-a uma ferramenta versátil e livre de rótulos para análise química, minimizando a perturbação da amostra. Apesar de suas vantagens, a dispersão espontânea de Raman sofre de uma seção transversal de baixa dispersão (tipicamente 1011 menor que a seção transversal de absorção infravermelha [IR]), o que requer longos tempos de aquisição para análise2. Assim, a busca pelo aumento da sensibilidade do processo de dispersão de Raman é essencial para impulsionar as tecnologias Raman para imagens em tempo real.
Uma maneira eficaz de aumentar muito a sensibilidade da dispersão de Raman é através de processos coerentes de dispersão de Raman (CRS), para os quais dois pulsos de laser são tipicamente usados para excitar transições vibracionais moleculares 3,4. Quando a diferença de energia de fótons entre os dois lasers corresponde aos modos vibracionais das moléculas de amostra, fortes sinais raman serão gerados. Os dois processos de CRS mais usados para imagem são a dispersão coerente anti-Stokes Raman (CARS) e a dispersão de Raman estimulada (SRS)5. Nas últimas duas décadas, os desenvolvimentos tecnológicos avançaram nas técnicas de microscopia de CARROS e SRS para se tornarem ferramentas poderosas para quantificação sem rótulos e elucidação de alterações químicas em amostras biológicas.
A imagem química por microscopia CARS pode ser datada de 1982 quando a varredura a laser foi aplicada pela primeira vez para adquirir imagens CARS, demonstradas por Duncan et al6. A modernização da microscopia CARS foi bastante acelerada após as amplas aplicações da microscopia de fluorescência multifotona laser 7. Os primeiros trabalhos do grupo Xie usando lasers de alta taxa de repetição tornaram-se uma plataforma de imagem química de alta velocidade, sem rótulos, para a caracterização de moléculas em amostras biológicas 8,9,10. Um dos principais problemas para a imagem cars é a presença de um fundo não ressonante, que reduz o contraste da imagem e distorce o espectro Raman. Muitos esforços foram feitos para reduzir o fundo não ressonante 11,12,13,14,15 ou para extrair sinais raman ressonantes do espectro CARS 16,17. Outro avanço que tem avançado muito o campo é a imagem de CARS hiperespectral, que permite o mapeamento espectral em cada pixel de imagem com melhor seletividade química 18,19,20,21.
A dispersão de Raman Estimulada (SRS) é uma tecnologia de imagem mais jovem do que cars, embora tenha sido descoberta anteriormenteaos 22 anos. Em 2007, a microscopia SRS foi relatada usando uma baixa taxa de repetição da fonte laser23. Logo, vários grupos demonstraram imagens de SRS de alta velocidade usando lasers de alta taxa de repetição 24,25,26. Uma das principais vantagens da microscopia SRS sobre carros é a ausência do fundo não ressonante27, embora outros fundos como modulação transversal (XPM), absorção transitória (TA), absorção de dois fótons (TPA) e efeito fototermal (PT), possam ocorrer com o SRS28. Além disso, o sinal SRS e a concentração amostral têm relações lineares, ao contrário dos CARS, que tem uma dependência quadrática de concentração de sinal29. Isso simplifica a quantificação química e o descompramento espectral. A SRS multicolorida e hiperespectral evoluiu de diferentes formas 30,31,32,33,34,35,36, com foco espectral sendo uma das abordagens mais populares para a imagem química 37,38.
Tanto os CARROS quanto o SRS requerem o foco da bomba e os raios laser de Stokes na amostra para combinar com a transição vibracional das moléculas para excitação de sinal. Os microscópios CARS e SRS também compartilham muito em comum. No entanto, a física subjacente a esses dois processos, e as detecções de sinais envolvidas nessas tecnologias de microscopia têm disparidades 3,39. CARS é um processo paramétrico que não tem acoplamento de energia net fóton-molécula3. O SRS, no entanto, é um processo não paramétrico, e contribui para a transferência de energia entre fótons e sistemas moleculares27. Em CARS, um novo sinal na frequência anti-Stokes é gerado, enquanto o SRS se manifesta como a transferência de energia entre a bomba e os raios laser stokes.
O sinal CARS satisfaz eq (1)28.
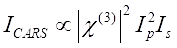 (1)
(1)
Enquanto isso, o sinal SRS pode ser escrito como Eq (2)28.
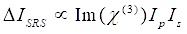 (2)
(2)
Aqui, eup, is, ICARS, e ΔISRS são as intensidades do feixe de bomba, feixe de Stokes, sinal CARS e sinais SRS, respectivamente. Χ(3) é a suscetibilidade óptica não linear de terceira ordem da amostra, e é um valor complexo composto de partes reais e imaginárias.
Essas equações expressam os perfis espectrais e a dependência de concentração de sinais de CARROS e SRS. Diferenças na física resultam em esquemas de detecção diferentes para essas duas tecnologias de microscopia. A detecção de sinal em CARROS geralmente envolve a separação espectral de fótons recém-gerados e a detecção usando um tubo fotomultiplier (PMT) ou dispositivo acoplado por carga (CCD); para SRS, a troca de energia entre a bomba e os feixes de Stokes é geralmente medida pela modulação de alta velocidade de intensidade usando um modulador óptico e desmodulação usando um fotodiodo (PD) emparelhado com um amplificador de travamento.
Embora muitos desenvolvimentos tecnológicos e aplicações tenham sido publicados nos últimos anos nos campos de CARROS e SRS, não foram realizadas comparações sistemáticas das duas técnicas de CRS na mesma plataforma, especialmente para carros hiperespectrais e microscopia SRS. Comparações diretas em sensibilidade, resolução espacial, resolução espectral e capacidades de separação química permitiriam aos biólogos selecionar a melhor modalidade de quantificação química. Neste protocolo, são fornecidas etapas detalhadas para a construção de uma plataforma de imagem multimodal com as modalidades CARROS hiperespectrais e SRS baseadas em um sistema laser femtosegundo e foco espectral. As duas técnicas foram comparadas na direção para resolução espectral, sensibilidade à detecção, resolução espacial e contrastes de imagem das células.
Protocol
Representative Results
Discussion
O protocolo aqui apresentado descreve a construção de um microscópio CRS multimodal e a comparação direta entre carros e imagens SRS. Para a construção do microscópio, as etapas críticas são a sobreposição do feixe espacial e temporal e a otimização do tamanho do feixe. Recomenda-se o uso de uma amostra padrão como o DMSO antes da imagem biológica para otimizar o SNR e calibrar as mudanças de Raman. A comparação direta entre as imagens cars e srs revela que o CARS tem uma melhor resolução espacial, e…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Esta pesquisa foi apoiada pelo fundo de startup do Departamento de Química da Universidade purdue.
Materials
| 2D galvo scanner set | Thorlabs | GVS002 | |
| Acousto-optic modulator | Isomet | M1205-P80L-0.5 | |
| AOM driver | Isomet | 532B-2 | |
| Data acquisition card | National Instruments | PCle 6363 | Custom ordered filter (980 sp) |
| Delay stage | Zaber | X-LSM050A | |
| Deuterium oxide | Millipore Sigma | 151882-100G | |
| Dichroic mirror for beam combination | Thorlabs | DMLP1000 | |
| Dichroic mirror for signal separation | Semrock | FF776-Di01-25×36 | |
| DMSO | MiliporeSigma | 200-664-3 | |
| MIA PaCa 2 Cells | ATCC | CRL-1420 | |
| Femtosecond laser system | Spectral Physics | InSightX3+ | |
| Filter for CARS | Chroma | AT655/30m | |
| Filter for SRS | Chroma | ET980sp | |
| Function generator | Rigol | DG1022Z | |
| Glass rods | Lattice Electro Optics | SF-57 | |
| Half-wave plate | Newport | 10RP02-51; 10RP02-46 | |
| LabVIEW 2020 | National Instruments | This is the image acquisition software | |
| Lock-in amplifier | Zurich Instrument | HF2LI | |
| Microscope housing | Olympus | BX51W1 | |
| Objective lens | Olympus | UPLSAPO60XW | |
| Origin Pro 2019b | OriginLab Corporation | This is the spectral fitting software | |
| Oscilloscope | Tektronix | TBS2204B | |
| Photodiode | Hamamatsu | S3994-01 | |
| PMT detector | Hamamatsu | H7422P-40 | |
| PMT voltage amplifier | Advanced Research Instrument Corp. | PMT4V3 | |
| Polarizing beamsplitter cube | Thorlabs | PBS255 | |
| Terminal block | National Instruments | BNC-2110 |
References
- Raman, C. V. A change of wave-length in light scattering. Nature. 121 (3051), 619 (1928).
- Li, S., Li, Y., Yi, R., Liu, L., Qu, J. Coherent anti-Stokes Raman scattering microscopy and its applications. Frontiers in Physics. 8, 515 (2020).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annual Review of Analytical Chemistry. 1 (1), 883-909 (2008).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62, 507-530 (2011).
- Suhalim, J. L., Boik, J. C., Tromberg, B. J., Potma, E. O. The need for speed. Journal of Biophotonics. 5 (5-6), 387-395 (2012).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Optics Letters. 7 (8), 350-352 (1982).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Cheng, J. -. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: instrumentation, theory, and applications. The Journal of Physical Chemistry B. 108 (3), 827-840 (2004).
- Evans, C. L., et al. Chemical imaging of tissue in vivo with video-rate coherent anti-Stokes Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16807 (2005).
- Cheng, J. -. X., Volkmer, A., Book, L. D., Xie, X. S. An epi-detected coherent anti-Stokes Raman scattering (E-CARS) microscope with high spectral resolution and high sensitivity. The Journal of Physical Chemistry B. 105 (7), 1277-1280 (2001).
- Volkmer, A., Book, L. D., Xie, X. S. Time-resolved coherent anti-Stokes Raman scattering microscopy: Imaging based on Raman free induction decay. Applied Physics Letters. 80 (9), 1505-1507 (2002).
- Marks, D. L., Boppart, S. A. Nonlinear interferometric vibrational imaging. Physical Review Letters. 92 (12), 123905 (2004).
- Ganikhanov, F., Evans, C. L., Saar, B. G., Xie, X. S. High-sensitivity vibrational imaging with frequency modulation coherent anti-Stokes Raman scattering (FM CARS) microscopy. Optics Letters. 31 (12), 1872-1874 (2006).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241-243 (2006).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363-1365 (2009).
- Masia, F., Karuna, A., Borri, P., Langbein, W. Hyperspectral image analysis for CARS, SRS, and Raman data. Journal of Raman Spectroscopy. 46 (8), 727-734 (2015).
- Knutsen, K. P., Johnson, J. C., Miller, A. E., Petersen, P. B., Saykally, R. J. High spectral resolution multiplex CARS spectroscopy using chirped pulses. Chemical Physics Letters. 387 (4-6), 436-441 (2004).
- Okuno, M., Kano, H., Leproux, P., Couderc, V., Hamaguchi, H. -. o. Ultrabroadband multiplex CARS microspectroscopy and imaging using a subnanosecond supercontinuum light source in the deep near infrared. Optics Letters. 33 (9), 923-925 (2008).
- Masia, F., Glen, A., Stephens, P., Borri, P., Langbein, W. Quantitative chemical imaging and unsupervised analysis using hyperspectral coherent anti-Stokes Raman scattering microscopy. Analytical Chemistry. 85 (22), 10820-10828 (2013).
- Pegoraro, A. F., Slepkov, A. D., Ridsdale, A., Moffatt, D. J., Stolow, A. Hyperspectral multimodal CARS microscopy in the fingerprint region. Journal of Biophotonics. 7 (1-2), 49-58 (2014).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Ploetz, E., Laimgruber, S., Berner, S., Zinth, W., Gilch, P. Femtosecond stimulated Raman microscopy. Applied Physics B. 87 (3), 389-393 (2007).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Nandakumar, P., Kovalev, A., Volkmer, A. Vibrational imaging based on stimulated Raman scattering microscopy. New Journal of Physics. 11 (3), 033026 (2009).
- Slipchenko, M. N., Le, T. T., Chen, H., Cheng, J. -. X. High-speed vibrational imaging and spectral analysis of lipid bodies by compound Raman microscopy. The Journal of Physical Chemistry B. 113 (21), 7681-7686 (2009).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62 (1), 507-530 (2011).
- Zhang, C., Zhang, D., Cheng, J. -. X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17 (1), 415-445 (2015).
- Prince, R. C., Frontiera, R. R., Potma, E. O. Stimulated Raman scattering: from bulk to nano. Chemical Reviews. 117 (7), 5070-5094 (2017).
- Lu, F. -. K., et al. Multicolor stimulated Raman scattering microscopy. Molecular Physics. 110 (15-16), 1927-1932 (2012).
- Ozeki, Y., et al. High-speed molecular spectral imaging of tissue with stimulated Raman scattering. Nature Photonics. 6 (12), 845-851 (2012).
- Wang, P., et al. Label-free quantitative imaging of cholesterol in intact tissues by hyperspectral stimulated raman scattering microscopy. Angewandte Chemie International Edition. 125 (49), 13280-13284 (2013).
- Freudiger, C. W., et al. Stimulated Raman scattering microscopy with a robust fibre laser source. Nature Photonics. 8 (2), 153-159 (2014).
- Liao, C. -. S., et al. Microsecond scale vibrational spectroscopic imaging by multiplex stimulated Raman scattering microscopy. Light: Science & Applications. 4 (3), 265 (2015).
- Liao, C. -. S., et al. Spectrometer-free vibrational imaging by retrieving stimulated Raman signal from highly scattered photons. Science Advances. 1 (9), 1500738 (2015).
- He, R., et al. Dual-phase stimulated Raman scattering microscopy for real-time two-color imaging. Optica. 4 (1), 44-47 (2017).
- Andresen, E. R., Berto, P., Rigneault, H. Stimulated Raman scattering microscopy by spectral focusing and fiber-generated soliton as Stokes pulse. Optics Letters. 36 (13), 2387-2389 (2011).
- Fu, D., Holtom, G., Freudiger, C., Zhang, X., Xie, X. S. Hyperspectral imaging with stimulated Raman scattering by chirped femtosecond lasers. The Journal of Physical Chemistry B. 117 (16), 4634-4640 (2013).
- Zhang, C., Aldana-Mendoza, J. A. Coherent Raman scattering microscopy for chemical imaging of biological systems. Journal of Physics: Photonics. , (2021).
- Martens, W. N., Frost, R. L., Kristof, J., Theo Kloprogge, J. Raman spectroscopy of dimethyl sulphoxide and deuterated dimethyl sulphoxide at 298 and 77 k. Journal of Raman Spectroscopy. 33 (2), 84-91 (2002).
- Gill, G. W., Gill, G. W. . Cytopreparation: Principles & Practice. , 309-323 (2013).
- Fu, D., et al. Imaging the intracellular distribution of tyrosine kinase inhibitors in living cells with quantitative hyperspectral stimulated Raman scattering. Nature Chemistry. 6 (7), 614-622 (2014).
- Wei, L., Yu, Y., Shen, Y., Wang, M. C., Min, W. Vibrational imaging of newly synthesized proteins in live cells by stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 110 (28), 11226-11231 (2013).
- Lu, F. -. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- Slipchenko, M. N., et al. Vibrational imaging of tablets by epi-detected stimulated Raman scattering microscopy. Analyst. 135 (10), 2613-2619 (2010).
- Slipchenko, M. N., Zhou, B., Pinal, R., Teresa Carvajal, M., Cheng, J. -. X. RAMAN-chemical imaging of solid dosage forms based on stimulated Raman scattering. American Pharmaceutical Review. 15 (3), 66 (2012).
- Sarri, B., et al. Discriminating polymorph distributions in pharmaceutical tablets using stimulated Raman scattering microscopy. Journal of Raman Spectroscopy. 50 (12), 1896-1904 (2019).
- Fussell, A. L., Kleinebudde, P., Herek, J., Strachan, C. J., Offerhaus, H. L. Coherent anti-Stokes Raman scattering (CARS) microscopy visualizes pharmaceutical tablets during dissolution. JoVE (Journal of Visualized Experiments). (89), e51847 (2014).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging). Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lim, R. S., et al. Multimodal CARS microscopy determination of the impact of diet on macrophage infiltration and lipid accumulation on plaque formation in ApoE-deficient mice [S]. Journal of Lipid Research. 51 (7), 1729-1737 (2010).
- Ji, M., et al. label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- Tabish, T. A., Narayan, R. J., Edirisinghe, M. Rapid and label-free detection of COVID-19 using coherent anti-Stokes Raman scattering microscopy. Mrs Communications. 10 (4), 566-572 (2020).
- Camp, C. H., et al. High-speed coherent Raman fingerprint imaging of biological tissues. Nature Photonics. 8 (8), 627-634 (2014).
- Wei, L., et al. Live-cell bioorthogonal chemical imaging: stimulated Raman scattering microscopy of vibrational probes. Accounts of Chemical Research. 49 (8), 1494-1502 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Nie, S., Emory, S. R. Probing single molecules and single nanoparticles by surface-enhanced Raman scattering. Science. 275 (5303), 1102-1106 (1997).
- Steuwe, C., Kaminski, C. F., Baumberg, J. J., Mahajan, S. Surface enhanced coherent anti-Stokes Raman scattering on nanostructured gold surfaces. Nano Letters. 11 (12), 5339-5343 (2011).
- Fast, A., Kenison, J. P., Syme, C. D., Potma, E. O. Surface-enhanced coherent anti-Stokes Raman imaging of lipids. Applied Optics. 55 (22), 5994-6000 (2016).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Yampolsky, S., et al. Seeing a single molecule vibrate through time-resolved coherent anti-Stokes Raman scattering. Nature Photonics. 8 (8), 650-656 (2014).

