Fotokontrollü Biyolojik Olarak Aktif Bileşiklerin İn Vitro ve İn Vito Değerlendirilmesi - Kanser Fotofarmakolojisi için Potansiyel İlaç Adayları
Summary
Bu protokol, bu tür bileşiklerin klinik öncesi taramasında kullanılabilecek fotoanahtarlanabilir antikanser peptitlerinin değerlendirilmesi için benimsenen bir dizi deney sunmaktadır. Bu, 2D ve 3D hücre kültürlerinde sitotoksisite değerlendirmesini, ex vivo (model doku) fotoizomerizasyon etkinliğinin değerlendirilmesini ve in vivo etkinliği içerir.
Abstract
Fotokontrollü, biyolojik olarak aktif bileşikler, “akıllı” ilaç adaylarının ortaya çıkan bir sınıfıdır. Sistemik kemoterapide, iyi huylu, iyonize edilemeyen bir ışığı hastanın vücudundaki belirli bir yere yönlendirerek hassas uzaysal zamansal aktivasyonları nedeniyle ek güvenlik sağlarlar. Bu yazıda, fotokontrollü, biyolojik olarak aktif bileşiklerin fotoaktivasyonunun in vitro potensi ve ex vivo etkinliğinin yanı sıra ilaç geliştirmenin erken aşamalarında in vivo etkinliği değerlendirmek için bir dizi yöntem sunulmaktadır. Metodoloji, antikanser sitotoksik peptitlere, yani bilinen bir antibiyotik olan gramicidin S’nin günlükleten içeren analoglarına uygulanır. Deneyler, bir kanser hücre hattının (Lewis akciğer karsinomu, LLC) 2D (yapışkan hücreler) ve 3D (sferoidler) hücre kültürleri, canlı doku vekilleri (domuz eti kıyması) ve immünkompetan farelerde bir allogreft kanser modeli (subkutan LLC) kullanılarak gerçekleştirilir. En etkili bileşiklerin seçimi ve gerçekçi fototerapötik pencerelerin tahmini, otomatik floresan mikroskobu ile gerçekleştirilir. Farklı aydınlatma rejimlerinde fotoaktivasyon verimliliği, bir model dokuda farklı derinliklerde belirlenir ve optimal ışık dozu, son terapötik in vivo deneyde uygulanır.
Introduction
Fotokontrollü biyolojik olarak aktif bileşikler, son yıllarda insan hastalıkları için güvenli kemoterapilerin umut verici bir bileşeni olarak ortaya çıkmıştır ve malign solid tümörleri spesifik olarak ortadan kaldırmaktadır1. Bu bileşikler geri dönüşümlü fotoizomerize edilebilir fragmanlar (moleküler fotoanahtarlar) içerir ve farklı dalga boylarındaki ışıkla ışınlama üzerine inaktif ve aktif fotoizomerler arasında geçiş yapabilir.
Fotokontrol edilemeyen analoglarıyla karşılaştırıldığında, fotokontrollü ilaçlar daha güvenli olabilir, çünkü hastanın vücuduna sistemik olarak daha az aktif ve esasen toksik olmayan formlarda sokulabilirler ve daha sonra tümörler, ülserler ve yaralar gibi sadece gerektiğinde ışıkla aktive edilirler. Bu tür moleküler ilaç prototiplerinin çok sayıda heyecan verici gösterimi son akademik makalelerde bulunabilse de 2,3,4,5,6,7, klinik fotofarmakoloji alanı – onaylanmış ilaç / tıbbi cihaz / hastalık kombinasyonlarının bir uygulaması – mevcut değildir. Fotofarmakoloji henüz ilaç keşif aşamasındadır ve sistematik preklinik çalışmalar bilinmemektedir.
Çok yakın zamanda, bazı fotokontrollü antikanser peptitleri, yani peptid antibiyotik gramicidin S8’in analogları için in vivo güvenlik avantajını gösterdik. Bu fotokontrollü türevler, kırmızı ışık tarafından üretilen “halka açık” ve UV tarafından üretilen “halka kapalı” fotoformlar arasında geri dönüşümlü fotoindüklenmiş dönüşümlere maruz kalan bir günlük (DAE) fotoanahtarı içerir (türevlerden biri için Şekil 1’de gösterilmiştir, LMB002 bileşiği).
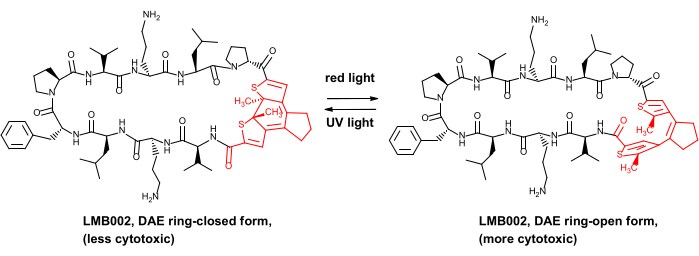
Resim 1: Fotokontrollü sitotoksik peptid LMB002 ve fotoizomerizasyonu. Günlükleten parçası kırmızı renkle gösterilmiştir. Kısaltma: DAE = diarylethene. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
İsabetleri bulmak ve isabet-kurşun optimizasyonu gerçekleştirmek genellikle uygun bileşik kütüphanelerin in vitro ve in vivo taramasını gerektirir 9,10. Burada, fotokontrollü bileşiklerin sitotoksisitesinin sistematik yüksek verimli taraması için uygun bir metodoloji gösteriyoruz. Ayrıca fotoizomerizasyon etkinliğini belirler, model dokulardaki ışık dozunu tahmin eder ve en iyi performans gösteren adayların in vivo etkinliğini değerlendiririz. Yaklaşım, biyoetik ve hayvan bakımı hususları ile uyumludur.
Bu çalışmada, test edilen bileşiklerin kontrolsüz fotoizomerizasyonunu önlemek için geleneksel preklinik yöntemler modifiye edilmiştir. Bu modifiye yöntemleri burada uygulamanın genel amacı, basit ve hızlı olan ve in vitro aktiviteleri güvenilir bir şekilde karşılaştırmak ve kurşun tanımlama ve daha fazla geliştirme için fotoanahtarlanabilir bileşiklerin in vivo etkinlik testini rasyonelleştirmek için istatistiksel olarak anlamlı veriler sağlayan genel bir strateji geliştirmektir.
Strateji birbirini izleyen üç adımdan oluşur. İlk adım, iki boyutlu (2B, tek katmanlı) ve üç boyutlu (3B, küresel) hücre kültürleri ve konfokal yüksek verimli otomatik floresan mikroskobu kullanılarak seçilen fotokontrollü biyolojik olarak aktif bileşiklerin aktif ve inaktif fotoformları için seri seyreltmelerde IC 50’nin (görünür%50 hücre canlılığı) belirlenmesini içerir. Fototerapötik pencereler, iki fotoform arasındaki IC50 farkı açısından karşılaştırılır ve en iyi performans gösteren adaylar seçilir. Otomatik mikroskopi ve diğer sitotoksisite tarama platformları (tahliller) ile toksisite değerlendirmesinde spesifik bir avantaj yoktur11; Daha karmaşık hücre bazlı tümör modelleri12 bu aşamada kolayca uygulanabilir.
1. adımda seçilen bileşikler için ikinci adım, ışınlanmış numune ekstraktlarının UV ile tespit edilen yüksek performanslı sıvı kromatografisi (HPLC) kullanılarak bir doku vekilindeki daha az aktif fotoformların fotoanahtarlama verimliliğini ölçerek, ışınlanmış doku yüzeyinden derinliğin bir fonksiyonu olarak dokular içindeki fotoanahtarlama verimliliklerini gerçekçi bir şekilde tahmin etmektir. In vivo , fotoanahtarlama verimliliği incelenebilir, ancak basit bir doku vekili – kıyılmış domuz eti kullanmayı öneriyoruz. Bu yaklaşımın geçerliliğini test ettik. Fotodeğiştirilebilir bileşiklerimizin in vivo dönüşümünü bir fare kanseri modelinde ölçtük ve farelerle yapılan önceki deneylerde ölçülen bir derinlikte yaklaşık olarak aynı fotokonversiyon gözlemledik8. Uygun herhangi bir alternatif yapay doku13, 3D biyobaskılı doku / organ14, biyopsi materyalleri veya başka bir muaf hayvan materyali kullanılabilir. Ancak, bu kurulum ekonomik, hızlı ve etik olduğu için iyi bir uzlaşmadır.
Üçüncü adım, bir murin kanseri modelinde in vivo antikanser etkinliğinin belirlenmesidir. Bu deney için in vitro deneylerde üstün özellikler gösteren ve model dokularda en az 1-1,5 cm derinlikte verimli bir şekilde fotoanahtarlama yapan bileşikler seçilmiştir.
Bu protokol, fotoformlarının (veya fotodurağan durumlarının, PSS) makul bir süre (birkaç gün veya daha uzun) stabil olması koşuluyla, farklı tipte fotoanahtarlara sahip bileşiklere uygulanabilir. Örnek olarak, daha önce açıklanan DAE türetilmiş LMB00215 kullanılır. LMB002 fotoformları termal olarak kararlıdır ve önemli bir bozulma olmadan en az bir yıl boyunca -20 ° C’de saklanabilir. Lewis akciğer karsinomu (LLC) hücreleri bunun için in vitro ve in vivo gösterim için seçilir, ancak hücre tipine herhangi bir kısıtlama getirilmez. LLC hücreleri yapışkandır, 3D’de kolayca kültürlenebilir ve tümöroidler üretmek için kullanılır (referans16’da açıklandığı gibi). İn vivo LLC hücreleri metastatik süreçleri modellemek için kullanılır ve deri altı enjeksiyonundan sonra immünokompetan farelerde kolayca katı tümörler üretebilir. Bu in vivo metodoloji evrensel olarak diğer kanser modellerine uygulanabilir17,18. Bu stratejinin ayrıntılı uygulaması aşağıda açıklanmıştır.
Protocol
Representative Results
Discussion
Fotokontrollü bileşikler ilaç geliştirmede benzeri görülmemiştir; ancak preklinik ve klinik değerlendirmeleri için herhangi bir yöntem oluşturulmamıştır. En yakın monoterapi analoğu olan fotodinamik tedavi (PDT), kansere karşı birçok ülke tarafından benimsenen klinik kullanıma yönelik tedavi modalitesidir ve diğer endikasyonlar için de geliştirilmektedir19,20. Fotofarmakolojiye benzer şekilde, PDT ayrıca biyoaktif maddeyi (singlet oksijen) aktive etmek için ışığın kullanımına dayanır. Bu nedenle PDT’de preklinik ve klinik çalışmalarda kullanılan bazı deneysel yöntemler fotofarmakoloji için de benimsenebilir. Örneğin, ışık kaynakları, ışık dağıtım yaklaşımları ve tıbbi cihazlar PDT için iyi geliştirilmiş ve onaylanmıştır; fotokontrollü ilaçların değerlendirilmesinde doğrudan kullanılabilirler. Bununla birlikte, PDT ve fotofarmakolojinin birbirinden birçok farkı vardır4, bu da ikincisi için spesifik yöntemler oluşturma ihtiyacını haklı çıkarır.
İlk olarak, PDT’deki (oksijen) aktive edilmemiş madde her zaman canlı dokularda toksik olmayan konsantrasyonlarda bulunur. Buna karşılık, aktive edilmemiş fotokontrollü biyolojik olarak aktif bileşikler artık aktiviteye ve istenmeyen toksisiteye sahip olabilir. Bu nedenle, ideal fotofarmakoloji ilaçları, uygulanan formlarında biyolojik aktiviteyi en aza indirmiş olmalı ve ışık kaynaklı formlarında oldukça aktif olmalı, “fototerapötik pencere”21 mümkün olduğunca büyük olmalıdır. İsabeti bulmak ve isabetten kurşuna optimizasyonu gerçekleştirmek, uygun bileşiklerin tanımlanmasını ve ilaç geliştirmenin erken aşamalarında olan nispeten büyük kütüphanelerin taranmasını gerektirir. Burada, verimli fotoanahtarlama bileşiklerini tanımlamak için otomatik bir yüksek verimli konfokal floresan mikroskopi önerdik.
Seçilen sitotoksisite değerlendirme yöntemi, en kritik gereksinimin kolayca uygulanmasını sağlar – PSS’nin korunması veya görünür ışığa duyarlı fotoizomerin stabilitesi. Bunun nedeni, uygulandığında ışığa maruz kalmanın en aza indirilmesidir. Bu nedenle alternatif yöntemler seçiliyorsa otomatik yöntemler tercih edilmelidir. Bu yaklaşım güvenilir ve bilgilendiricidir. Bu aşamada 3D hücre kültürlerinin (sferoidler) kullanılması, hücrenin tedaviye verdiği yanıtın daha gerçekçi doku benzeri bir mikro ortamda bütünsel bir şekilde anlaşılmasını sağlar. Ek olarak, bileşiklerin etki mekanizması hakkında değerli bilgiler, doğrudan yöntem olarak mikroskopi kullanılarak elde edilebilir. Uygun boyama protokolüne sahip konfokal floresan mikroskopi, hücrelerin ve sferoidlerin morfolojisinin görsel olarak değerlendirilmesine izin verir; Hücre ölümü ve hücre içindeki değişikliklerle ilgili önemli detaylar da tespit edilebilir.
İkincisi, ışık uygulaması dikkatli bir ışık dozu seçimi gerektirir. PDT’de, hafif doz aşımı dokulara son derece zararlıdır22. Fotofarmakolojik tedavi aşırı ışık ışınlaması altında avantajlı olabilir. Aktif maddenin üst sınırı, aktif olmayan maddenin uygulanan dozu ve farmakokinetiği ile tanımlanır. Bununla birlikte, ışık dozu fotofarmakolojide hala bir sorundur. Işınlama gücü yoğunluğunun ve maruz kalma süresinin tedavinin gerekliliğinden daha az olmamasına dikkat edilmelidir. Prensip olarak, aktif maddenin üretimi in vivo olarak izlenebilir. Bununla birlikte, biyoetik nedenlerden dolayı, aktif olmayan bileşik15 ile karıştırılmış bir model doku (taze kıyılmış et) ile bir deney önerdik. Bu deney basittir ve farklı ışık kaynaklarını kullanmak için değiştirilebilir. Ayrıca ışık dozajının fotofiziksel tahmini ve termal etkilerin ölçümü için uyarlanabilir. Burada yine, model dokuları kullanarak, ışığa maruz kalmanın, örneğin, in vivo koşullarda daha doğru fotoanahtarlama verimliliği belirlemesiyle karşılaştırıldığında, her zaman göz önünde bulundurulması ilginç olabilecek bir alternatifle karşılaştırıldığında, ışığa maruz kalmayı en aza indirmek mümkündür.
Son olarak, in vitro toksisite taramalarında üstün özellikler gösteren ve model dokuda en az 1-1,5 cm derinliğinde verimli bir şekilde fotoanahtarlama yapan bileşikler, maliyetli, zahmetli ve uzun in vivo çalışmalar için seçilebilir. Bu protokolde, allogreft kanseri modelini oluşturmak için in vitro değerlendirmede olduğu gibi aynı hücre hattını (LLC) kullandık. Tümör büyüme dinamikleri, mortalite ve metastaz sayısı antikanser etkinliğini değerlendirmek için en uygun parametrelerdir. Geleneksel kemoterapi ile karşılaştırıldığında, fotofarmakolojik tedavide ek bir faktör uygulanır – ışık. Bu nedenle, iki kontrol hayvan grubuna ihtiyaç vardır: biri sadece aracı alan ve diğeri aracı ve ışınlamayı alan. Bu kurulum, ışığın ölçülen parametreler üzerindeki etkisinin değerlendirilmesini sağlar. Deneyimizde, iki deney grubunun hayvanları aktive edilmemiş bileşiği aldı ve bir gruptaki farelerin tümörleri ışınlandı. Işınlama rejimi kontrol ve tedavi grupları için aynıydı. Bu aşamada kıyaslama kemoterapisi ile karşılaştırmaya gerek yoktur, çünkü deneyin temel amacı ışık ve bileşik uygulamasının birleşik etkisini göstermektir. Bu etkiyi sergileyen en iyi performans gösteren bileşikler daha sonra in vivo toksisiteleri hakkında daha fazla çalışma için seçilebilir ve gelişimleri hakkında önemli go-no-go kararları vermek için kriterlerle karşılaştırılabilir. Teknik olarak, tanımladığımız in vivo deney, örneğin ilaç lideri olarak zaten seçilmiş bir bileşiğin farmakokinetik veya farmakodinamik çalışmalarına kolayca uyarlanabilir.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Yazarlar, PELICO (#690973) ve ALISE (#101007256) projeleri aracılığıyla H2020-MSCA-RISE programı tarafından AB finansmanını kabul etmektedir. Bu çalışma DFG-GRK 2039 (SA, TS ve ASU), Helmholtz Derneği’nin NACIP programı (SA ve ASU) ve BMBF’nin VIP + (OB ve ASU) tarafından desteklenmiştir. Karlsruhe Teknoloji Enstitüsü’nden Dr. Serhii Koniev’e, LMB002 bileşiğini sentezleyen, saflaştıran ve çalışma için bileşiği nazikçe sağlayan Dr. Serhii Koniev’e teşekkür ederiz. Yazarlar ayrıca, videoyu Ukrayna’da filme alan ve derleyen Chupryna Maksym’e ve bu yayını mümkün kılan deneysel çalışmayı, yazmayı ve filme almayı mümkün kılan Ukrayna’nın tüm cesur savunucularına minnettardır.
Materials
| Agilent 1100 Series capillary LC system | ALSI-Chrom (Agilent distributor) | – | |
| ATCC CRL-1642, LL/2 (LLC1) Lewis lung carcinoma cell line | ECACC | 90020104 | |
| C57BL/6NCrl mice, female, inbred | Charles River | Strain code: 027 | |
| CelCulture, CO2 incubator | Esco Micro | CCL-170B | |
| Corning Matrigel Basement membrane matrix | Merck | CLS354234 | |
| Corning, 384- well spheroid microplates | Merck | CLS3830 | |
| Fetal bovine serum | Merck | F7524 | |
| Gibco, DPBS | Thermo Fisher Scientific | 21600044 | |
| Gramicidin S | Lumobiotics | Custom synthesis | |
| HyClone, DMEM/high glucose | Cytiva | SH30003.04 | |
| IN Cell Analyzer 6500HS, imaging system | Cytiva | 29240358 | |
| Invitrogen, Calcein AM | Thermo Fisher Scientific | C1430 | |
| Isoflurane anesthesia machine | ASA | S/N ASA 1305 | |
| L-glutamine, 200 mM solution | Merck | G7513 | |
| LIKA-surgeon, diode surgery laser | Fotonika plus | – | |
| LMB002 | Lumobiotics | Custom synthesis | |
| Penicillin–Streptomycin, solution stabilized | Merck | P4333 | |
| PhenoPlate, 96-well plates | PerkinElmer | 6055302 | |
| Photometer PCE-LED 20 | PCE Instruments | PCE-LED 20 | |
| Thermo Scientific, Hoechst 33342 | Thermo Fisher Scientific | 62249 | |
| Thermo Scientific, Propidium iodide | Thermo Fisher Scientific | J66764-MC | |
| Trypan blue, 0.4% solution | Merck | T8154 | |
| Trypsin–EDTA, 10 x solution | Merck | T4174 | |
| UltraCruz Cell culture flasks with vented caps, 75 cm2 | Santa Cruz Biotechnology | sc-200263 | |
| UltraCruz, bottle top filters, PES, 0.22 μm | Santa Cruz Biotechnology | sc-360882 | |
| Vydac 218TP, C18 HPLC column (4.6 mm × 250 mm, 5 µm) | Altmann Analytik (Avantor distributor) | GR5103827 |
References
- Fuchter, M. J. On the promise of photopharmacology using photoswitches: a medicinal chemist’s perspective. Journal of Medicinal Chemistry. 63 (20), 11436-11447 (2020).
- Volarić, J., Szymanski, W., Simeth, N. A., Feringa, B. L. Molecular photoswitches in aqueous environments. Chemical Society Reviews. 50, 12377-12449 (2021).
- Paoletti, P., Ellis-Davies, G. C. R., Mourot, A. Optical control of neuronal ion channels and receptors. Nature Reviews Neuroscience. 20, 514-532 (2019).
- Hüll, K., Morstein, J., Trauner, D. In Vivo Photopharmacology. Chemical Reviews. 118 (21), 10710-10747 (2018).
- Ma, X., et al. In vivo photopharmacology with a caged mu opioid receptor agonist drives rapid changes in behavior. Nature Methods. 20, 682-685 (2023).
- Sarabando, S. N., Palmeira, A., Sousa, M. E., Faustino, M. A. F., Monteiro, C. J. P. Photomodulation Approaches to Overcome Antimicrobial Resistance. Pharmaceuticals. 16 (5), 682 (2023).
- Kolarski, D., Szymanski, W., Feringa, B. L., Hirota, T., Hatori, M., Panda, S. Chronophotopharmacology: Methodology for high spatiotemporal control over the circadian rhythm with light. Neuromethods. 186, (2022).
- Babii, O., et al. Peptide drugs for photopharmacology: how much of a safety advantage can be gained by photocontrol. Future Drug Discovery. 2 (1), FDD28 (2020).
- Davis, A. M., Keeling, D. J., Steele, J., Tomkinson, N. P., Tinker, A. C. Components of successful lead generation. Current Topics in Medicinal Chemistry. 5 (4), 421-439 (2005).
- Balani, S. K., Miwa, G. T., Gan, L., Wu, J., Lee, F. W. Strategy of utilizing in vitro and in vivo adme tools for lead optimization and drug candidate selection. Current Topics in Medicinal Chemistry. 5 (11), 1033-1038 (2005).
- Kleijn, A., et al. A Systematic comparison identifies an ATP-based viability assay as most suitable read-out for drug screening in glioma stem-like cells. Stem Cells International. 2016, (2016).
- Rodrigues, J., Heinrich, M. A., Teixeira, L. M., Prakash, J. 3D in vitro model revolution: unveiling tumor-stroma interactions. Trends in Cancer. 7 (3), 249-264 (2021).
- Sittinger, M., et al. Tissue engineering and autologous transplant formation: practical approaches with resorbable biomaterials and new cell culture techniques. Biomaterials. 17 (3), 237-242 (1996).
- Matai, I., Kaur, G., Seyedsalehi, A., McClinton, A., Laurencin, C. T. Progress in 3D bioprinting technology for tissue/organ regenerative engineering. Biomaterials. 226, 119536 (2020).
- Babii, O., et al. Direct photocontrol of peptidomimetics: an alternative to oxygen-dependent photodynamic cancer therapy. Angewandte Chemie International Edition. 55 (18), 5493-5496 (2016).
- De Ridder, K., et al. Novel 3D lung tumor spheroids for oncoimmunological assays. Advanced NanoBiomed Research. 2 (4), 2100124 (2022).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer Discovery. 7 (5), 462-477 (2017).
- Van Straten, D., Mashayekhi, V., De Bruijn, H. S., Oliveira, S., Robinson, D. J. Oncologic photodynamic therapy: basic principles, current clinical status and future directions. Cancers. 9 (2), 19 (2017).
- Li, X., Kwon, N., Guo, T., Liu, Z., Yoon, J. Innovative strategies for hypoxic-tumor photodynamic therapy. Angewandte Chemie International Edition. 57 (36), 11522-11531 (2018).
- Hull, K., Morstein, J., Trauner, D. In vivo photopharmacology. Chemical Reviews. 118 (21), 10710-10747 (2018).
- Babii, O., et al. Structure-activity relationships of photoswitchable diarylethene-based β-hairpin peptides as membranolytic antimicrobial and anticancer agents. Journal of Medicinal Chemistry. 61 (23), 10793-10813 (2018).
- Heckl, C., Aumiller, M., Rühm, A., Sroka, R., Stepp, H. Fluorescence and treatment light monitoring for interstitial photodynamic therapy. Photochemistry and Photobiology. 96 (2), 388-396 (2020).

