In ovo Expressie van MicroRNA in ventrale Chick Middenhersenen
Summary
Ectopische expressie is een techniek om de microRNA's rol in de ontwikkeling van de hersenen toe te lichten. Echter, gericht op specifieke gebieden met behulp van in-ovo elektroporatie is een uitdaging. Hier tonen we een efficiënte manier om selectief electroporate ventrale en dorsale middenhersenen regio.
Abstract
Niet-coderende RNA's extra spelers regulatie van genexpressie. Gerichte in ovo elektroporatie van specifieke gebieden biedt een uniek instrument voor ruimtelijke en temporele controle van een buitenbaarmoederlijke microRNA expressie. Echter, ventrale hersenstructuren zoals ventrale middenhersenen zijn nogal moeilijk te bereiken voor eventuele manipulaties. Hier tonen we een efficiënte manier om miRNA electroporate in ventrale middenhersenen met behulp van dunne platina-elektroden. Deze werkwijze biedt een betrouwbare manier om specifieke gebieden van de middenhersenen en een nuttig instrument voor in vivo studies transfecteren.
Introduction
De erkenning van kleine niet-coderende RNA's als extra spelers voor genexpressie gestart met een nieuwe complexiteit om genomische programmering / genregulatie. Verschillende soorten niet-coderende RNA's zijn functioneel belang neurale cellen, waaronder kleine niet-coderende RNA's 1-4. MicroRNAs (miR of miRNA) bijvoorbeeld tonen verschillende en veranderende expressie profielen in ontwikkelende hersenen 5. Gerichte in ovo elektroporatie van kippenembryo's biedt een unieke gelegenheid voor de ruimtelijke en temporele controle van genexpressie en silencing tijdens de ontwikkeling.
Deze video toont de verschillende stappen van het uitvoeren van ectopische expressie van miRs in specifieke gebieden van het kuiken middenhersenen behulp van in-ovo elektroporatie 6-10. Om een langdurig effect van deze kleine niet-coderende RNA in cellen waarborgen, de DNA sequentie van miRs werden gekloneerd in mono-of bi-cistronische vectoren. Voor de in ovo elektroporatie, miR met vector wordt geïnjecteerd in de middenhersenen neurale buis door het blootstellen van het embryo na een kleine venster in de eierschaal. Op specifieke gebieden van de middenhersenen kleine plus (anode) en min (kathode) transfecteren platina-elektroden worden geplaatst op specifieke posities. Voor ventrale middenhersenen transfectie, wordt de anode geplaatst onder de linker ventrale middenhersenen en de kathode boven de rechterhelft van de middenhersenen alvorens een stroom. De opening in de eierschaal is afgesloten met tape en embryo's geïncubeerd zolang als nodig is voor analyse. Deze methode werd oorspronkelijk beschreven door Muramatsu et al.. 6 en verbeterd Momose et al.. 8 specifieke gebied transfectie.
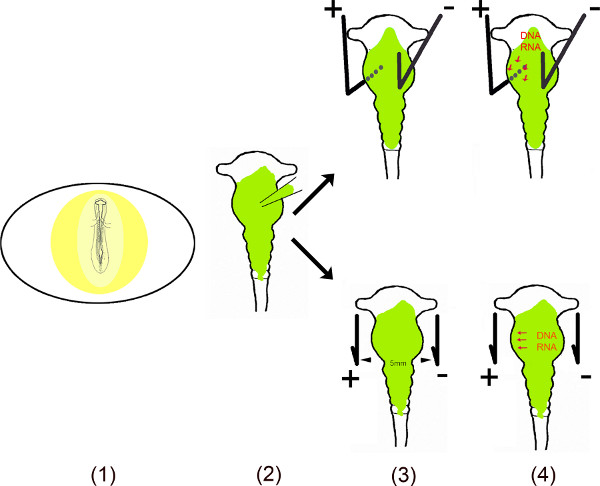
Schematisch overzicht.
- Het embryo in het ei wordt blootgesteld door het snijden van een klein venster in the eierschaal.
- De opgeloste vector (en) wordt geïnjecteerd in de middenhersenen behulp van een micro capillair.
- Twee elektroden – parallel of onder en boven het embryo geplaatst – genereren van een pulserend elektrisch veld.
- Het elektrische veld zorgt tijdelijk poriën in het celmembraan, welke men de cel door het negatief geladen DNA (of RNA) vergemakkelijken aangetrokken door de anode 11,12.
Protocol
Representative Results
Discussion
Deze video toont een effectieve methode om plasmide transfecteren in de neuro-epitheliale cellen van specifieke gebieden van het kuiken middenhersenen. Rechthoekige elektrische pulsen van een laag voltage kan DNA in cellen van het kuiken neurale buis te introduceren in ovo 6,16. Echter, de nauwkeurigheid van DNA targeting vaak bemoeilijkt door grote elektrische veld, die stijgt door de relatief grote elektroden (Φ = 0,5 mm). We hebben geprobeerd om dat probleem aan te pakken met behulp van elektrode…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Wij erkennen K. Mikic, die naar de eerste fase van deze film en M. Nicolescu voor de miR beeld bijgedragen. C. Huber werd ondersteund door een beurs van de IZKF van de Universtitätsklinikum Tübingen, A. Alwin Prem Anand door de Fortune programma van de Universtitätsklinikum Tübingen.
Materials
| Name | Company | Model | |
| Borosillicate glass capillaries | Hartenstein | Model: 0.9 mm | |
| Microcapillary puller | WPI, Berlin | Model: Pul1-E | |
| Electroporator | Intracel | Model: TSSIC | |
| Stereomicroscope – fluorescence | LEICA | Model: MZFLIII | |
| Stereomicroscope | Zeiss | Model: Stemi | |
| Camera and software | Zeiss | Model: Axiocam MRc/ Axiovision Re. 4.8 |
Referenzen
- Kutter, C., Svoboda, P. miRNA, siRNA, piRNA: Knowns of the unknown. RNA Biol. 5, 181-188 (2008).
- Szell, M., Bata-Csorgo, Z., Kemeny, L. The enigmatic world of mRNA-like ncRNAs: their role in human evolution and in human diseases. Semin. Cancer Biol. 18, 141-148 (2008).
- Li, X., Jin, P. Roles of small regulatory RNAs in determining neuronal identity. Nature reviews. Neuroscience. 11, 329-338 (2010).
- Riedmann, L. T., Schwentner, R. miRNA, siRNA, piRNA and argonautes: news in small matters. RNA Biol. 7, 133-139 (2010).
- Coolen, M., Bally-Cuif, L. MicroRNAs in brain development and physiology. Curr. Opin. Neurobiol. 19, 461-470 (2009).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochem. Biophys. Res. Commun. 230, 376-380 (1997).
- Itasaki, N., Bel-Vialar, S., Krumlauf, R. Shocking’ developments in chick embryology: electroporation and in ovo gene expression. Nat. Cell Biol. 1, 203-207 (1999).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Dev. Growth Differ. 41, 335-344 (1999).
- Nakamura, H., Watanabe, Y. Misexpression of genes in brain vesicles by in ovo electroporation. Dev. Growth Differ. 42, 199-201 (2000).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nat. Protoc. 3, 419-426 (2008).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Gene Hofschneider, P. H. transfer into mouse lyoma cells by electroporation in high electric fields. The EMBO journal. 1, 841-845 (1982).
- Potter, H., Weir, L., Leder, P. Enhancer-dependent expression of human kappa immunoglobulin genes introduced into mouse pre-B lymphocytes by electroporation. Proceedings of the National Academy of Sciences of the United States of America. 81, 7161-7165 (1984).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Dev. Dyn. 229, 433-439 (2004).
- Canto-Soler, M. V., Adler, R. Optic cup and lens development requires Pax6 expression in the early optic vesicle during a narrow time window. Developmental biology. , 294-2119 (2006).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev Dyn. 195, 231-272 (1992).
- Muramatsu, T., Nakamura, A., Park, H. M. In vivo electroporation: a powerful and convenient means of nonviral gene transfer to tissues of living animals (Review). Int J Mol Med. 1, 55-62 (1998).
- Agoston, Z., Li, N., Haslinger, A., Wizenmann, A., Schulte, D. Genetic and physical interaction of Meis2, Pax3 and Pax7 during dorsal midbrain development. BMC Dev Biol. 12, 10 (2012).
- De Pietri Tonelli, D., et al. Single-cell detection of microRNAs in developing vertebrate embryos after acute administration of a dual-fluorescence reporter/sensor plasmid. Biotechniques. 41, 727-732 (2006).

