In Expression Ovo di MicroRNA in Ventrale Chick Mesencefalo
Summary
Espressione ectopica è una tecnica per chiarire il ruolo microRNA nello sviluppo del cervello. Tuttavia, il targeting aree specifiche utilizzando in elettroporazione ovo è impegnativo. Qui vi mostriamo un modo efficiente alle regioni mesencefalo ventrale e dorsale in modo selettivo l'elettroporazione.
Abstract
RNA non codificanti sono altri giocatori nella regolazione dell'espressione genica. Mirata in elettroporazione ovo di settori specifici fornisce uno strumento unico per il controllo spaziale e temporale di espressione microRNA ectopica. Tuttavia, le strutture cerebrali ventrali come mesencefalo ventrale sono piuttosto difficili da raggiungere per eventuali manipolazioni. Qui, dimostriamo un modo efficiente per l'elettroporazione di miRNA nel mesencefalo ventrale con elettrodi di platino sottili. Questo metodo offre un modo affidabile per trasfettare aree specifiche del mesencefalo e uno strumento utile per studi in vivo.
Introduction
Il riconoscimento di piccoli RNA non codificanti come lettori aggiuntivi per l'espressione genica ha lanciato una nuova complessità genomica regolamento programmazione / gene. Diverse specie di RNA non codificanti hanno importanza funzionale in cellule neurali, comprese le piccole non codificanti RNA 1-4. I microRNA (miR o miRNA), per esempio, mostrano profili di espressione distinti e mutevoli nel cervello in via di sviluppo 5. Mirata in elettroporazione ovo di embrioni di pollo offre un'opportunità unica per il controllo spaziale e temporale di espressione genica e silenziamento durante lo sviluppo.
Questo video mostra le varie fasi di esecuzione di espressione ectopica di miR in specifiche aree del mesencefalo pulcino utilizzo in ovo elettroporazione 6-10. Per garantire un effetto di lunga durata di questi piccoli RNA non codificanti nelle cellule, la sequenza di DNA di miR sono stati clonati in vettori mono o bi-cistronic. Perché in elettroporazione ovo, miR contenente vettore viene iniettato nel tubo neurale mesencefalo esponendo l'embrione dopo aver effettuato una piccola finestra nel guscio dell'uovo. Trasfezione aree specifiche del mesencefalo più piccola (anodo) e negativo (catodo) elettrodi di platino sono collocati in posizioni specifiche. Per ventrale trasfezione mesencefalo, l'anodo si trova sotto il mesencefalo ventrale sinistro e il catodo sopra la metà destra del mesencefalo prima di applicare una corrente. L'apertura nel guscio è chiusa con nastro e embrioni vengono incubati per tutto il tempo richiesto per ogni analisi. Questo metodo è stato originariamente descritto da Muramatsu et al. 6 e migliorata Momose et al. 8 per zona specifica trasfezione.
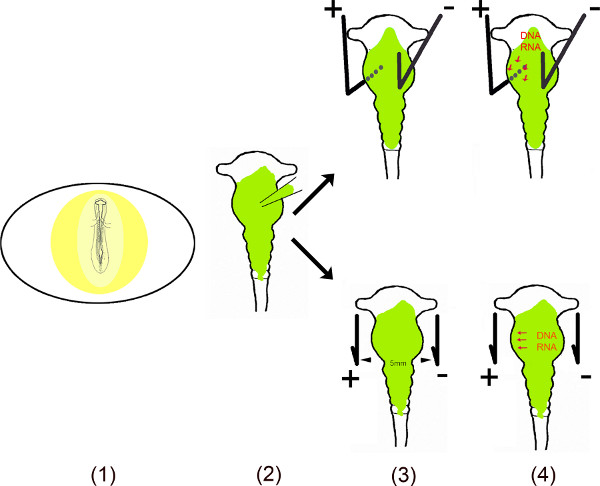
Panoramica schematica.
- L'embrione nell'uovo è esposto tagliando una piccola finestra in the guscio d'uovo.
- Il vettore (s) disciolto viene iniettato nel mesencefalo usando un micro capillare.
- Due elettrodi – disposti parallelamente o sotto e sopra l'embrione – generano un campo elettrico pulsato.
- Il campo elettrico crea temporalmente pori nella membrana cellulare, che facilitano l'ingresso nella cellula dal DNA caricato negativamente (o RNA) attratti verso l'anodo 11,12.
Protocol
Representative Results
Discussion
Questo video mostra un metodo efficace per trasfettare plasmide nelle cellule neuroepiteliale di aree specifiche del mesencefalo pulcino. Impulsi elettrici rettangolari di bassa tensione possono introdurre DNA in cellule del tubo neurale pulcino in ovo 6,16. Tuttavia, la precisione di targeting DNA è spesso ostacolata dal campo elettrico ampia, che sale attraverso le relativamente grandi elettrodi (Φ = 0,5 mm). Abbiamo cercato di affrontare questo problema utilizzando elettrodi più piccoli di diam…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Riconosciamo K. Mikic, che ha contribuito alla fase iniziale di questo film e M. Nicolescu per l'immagine miR. C. Huber è stato sostenuto da una borsa di studio del IZKF del Universtitätsklinikum Tübingen, A. Alwin Prem Anand dal programma fortuna del Universtitätsklinikum Tubinga.
Materials
| Name | Company | Model | |
| Borosillicate glass capillaries | Hartenstein | Model: 0.9 mm | |
| Microcapillary puller | WPI, Berlin | Model: Pul1-E | |
| Electroporator | Intracel | Model: TSSIC | |
| Stereomicroscope – fluorescence | LEICA | Model: MZFLIII | |
| Stereomicroscope | Zeiss | Model: Stemi | |
| Camera and software | Zeiss | Model: Axiocam MRc/ Axiovision Re. 4.8 |
Referenzen
- Kutter, C., Svoboda, P. miRNA, siRNA, piRNA: Knowns of the unknown. RNA Biol. 5, 181-188 (2008).
- Szell, M., Bata-Csorgo, Z., Kemeny, L. The enigmatic world of mRNA-like ncRNAs: their role in human evolution and in human diseases. Semin. Cancer Biol. 18, 141-148 (2008).
- Li, X., Jin, P. Roles of small regulatory RNAs in determining neuronal identity. Nature reviews. Neuroscience. 11, 329-338 (2010).
- Riedmann, L. T., Schwentner, R. miRNA, siRNA, piRNA and argonautes: news in small matters. RNA Biol. 7, 133-139 (2010).
- Coolen, M., Bally-Cuif, L. MicroRNAs in brain development and physiology. Curr. Opin. Neurobiol. 19, 461-470 (2009).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochem. Biophys. Res. Commun. 230, 376-380 (1997).
- Itasaki, N., Bel-Vialar, S., Krumlauf, R. Shocking’ developments in chick embryology: electroporation and in ovo gene expression. Nat. Cell Biol. 1, 203-207 (1999).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Dev. Growth Differ. 41, 335-344 (1999).
- Nakamura, H., Watanabe, Y. Misexpression of genes in brain vesicles by in ovo electroporation. Dev. Growth Differ. 42, 199-201 (2000).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nat. Protoc. 3, 419-426 (2008).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Gene Hofschneider, P. H. transfer into mouse lyoma cells by electroporation in high electric fields. The EMBO journal. 1, 841-845 (1982).
- Potter, H., Weir, L., Leder, P. Enhancer-dependent expression of human kappa immunoglobulin genes introduced into mouse pre-B lymphocytes by electroporation. Proceedings of the National Academy of Sciences of the United States of America. 81, 7161-7165 (1984).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Dev. Dyn. 229, 433-439 (2004).
- Canto-Soler, M. V., Adler, R. Optic cup and lens development requires Pax6 expression in the early optic vesicle during a narrow time window. Developmental biology. , 294-2119 (2006).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev Dyn. 195, 231-272 (1992).
- Muramatsu, T., Nakamura, A., Park, H. M. In vivo electroporation: a powerful and convenient means of nonviral gene transfer to tissues of living animals (Review). Int J Mol Med. 1, 55-62 (1998).
- Agoston, Z., Li, N., Haslinger, A., Wizenmann, A., Schulte, D. Genetic and physical interaction of Meis2, Pax3 and Pax7 during dorsal midbrain development. BMC Dev Biol. 12, 10 (2012).
- De Pietri Tonelli, D., et al. Single-cell detection of microRNAs in developing vertebrate embryos after acute administration of a dual-fluorescence reporter/sensor plasmid. Biotechniques. 41, 727-732 (2006).

