복부 병아리 중뇌에있는 마이크로 RNA의 오보, 식
Summary
이소성 표현은 두뇌 발달의 마이크로 RNA의 역할을 명료하게 한 기술이다. 그러나, 비켜 일렉트로에 사용하여 특정 영역을 대상으로하는 것은 도전이다. 여기, 우리는 효율적으로 선택적으로 electroporate 복부와 등쪽 중뇌 영역에 표시됩니다.
Abstract
비 코딩 RNA를 유전자 발현을 조절하는데 추가 플레이어. 특정 지역의 OVO 일렉트로의 대상은 자궁외 마이크로 RNA 발현의 공간 및 시간 제어를위한 독특한 도구를 제공합니다. 그러나, 복부 중뇌와 같은 복부 뇌 구조는 모든 조작에 도달 오히려 어렵습니다. 여기, 우리는 얇은 백금 전극을 사용하여 복부 중뇌에 miRNA의를 electroporate하는 효율적인 방법을 보여줍니다. 이 방법은 중뇌 및 생체 연구를위한 유용한 도구의 특정 영역을 감염 될 수있는 신뢰할 수있는 방법을 제공합니다.
Introduction
유전자 발현에 대한 추가 플레이어와 같은 작은 비 코딩 RNA를 인식 게놈 프로그래밍 / 유전자 조절에 새로운 복잡성을 시작했다. 비 코딩 RNA를 다른 종은 작은 비 코딩 RNA를 1-4 포함하는 신경 세포의 기능적인 중요성이있다. 예를 들어, 마이크로 RNA (miRNA의 미르 나)는 두뇌 개발 5 별개의 변화 발현 프로파일을 보여줍니다. 개발하는 동안 유전자 발현과 침묵의 시간 및 공간 제어를위한 유일한 기회는 병아리 태아의 비켜 일렉트로에 제공 대상.
이 동영상은 일렉트로 6-10 OVO에서 사용하는 병아리 중뇌의 특정 영역에 미르의 이소성 표현을 수행하는 여러 단계를 보여줍니다. 세포에있는이 작은 비 코딩 RNA를의 긴 지속 효과를 보장하기 위해, 미르의 DNA 시퀀스는 모노 – 또는 바이 cistronic 벡터에 클로닝 하였다. 비켜 일렉트로의 경우, 미르는 V를 포함엑터는 달걀 껍질에 작은 창을 한 후 배아를 노출하여 중뇌의 신경 튜브에 주입된다. 중뇌 작은 플러스 (양극)과 음극 (캐소드)의 특정 영역을 형질 백금 전극을 특정 위치에 배치됩니다. 복측 중뇌 형질 들어, 애노드는 좌 복부 중뇌 및 전류를인가하기 전에 중뇌의 우측 절반 상기 캐소드 밑에 배치된다. 달걀 껍질에 구멍을 테이프로 닫히고 배아는 한 어떤 분석을 위해 필요에 따라 배양된다. 이 방법은 원래 무라 마츠 등. (6)에 의해 설명 된 특정 지역의 형질 전환을위한 모모 세 등. 8로 향상되었다.
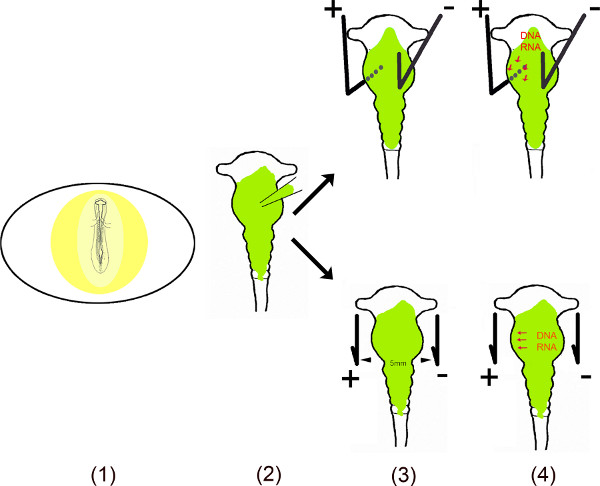
도식 개요.
- 계란의 배아는 일에 작은 창을 절단하여 노출전자 껍질.
- 용해 벡터 (들)는 마이크로 모세관을 사용하여 중뇌 주입된다.
- 두 개의 전극 – 병렬 또는 배아에서와 위에 배치는 – 펄스 전기장을 생성합니다.
- 전기장은 일시적으로 양극 (11, 12)에 매력을 부정 청구 DNA (또는 RNA)에 의해 세포에 진입을 용이하게 세포막에 구멍을 만듭니다.
Protocol
Representative Results
Discussion
이 비디오는 병아리 중뇌의 특정 영역의 neuroepithelial 세포에 플라스미드를 형질 할 수있는 효과적인 방법을 보여줍니다. 낮은 전압의 직사각형 전기 펄스는 6,16을 OVO에 병아리 신경 튜브의 세포에 DNA를 도입 할 수 있습니다. 그러나, DNA의 타겟팅 정확성은 종종 비교적 큰 전극 (Φ = 0.5 mm)을 통해 상승 넓은 전기장에 의해 방해된다. 우리는 모모 세 등. 8의 지침에 따라 ?…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
우리는 미르의 사진이 영화와 M. Nicolescu의 초기 단계에 기여 K. Mikic을 인정합니다. C. 후버는 Universtitätsklinikum 튀빙겐의 행운 프로그램에 의한 Universtitätsklinikum 튀빙겐 IZKF, A. 앨윈 프렘 아난드의 친교에 의해 지원되었다.
Materials
| Name | Company | Model | |
| Borosillicate glass capillaries | Hartenstein | Model: 0.9 mm | |
| Microcapillary puller | WPI, Berlin | Model: Pul1-E | |
| Electroporator | Intracel | Model: TSSIC | |
| Stereomicroscope – fluorescence | LEICA | Model: MZFLIII | |
| Stereomicroscope | Zeiss | Model: Stemi | |
| Camera and software | Zeiss | Model: Axiocam MRc/ Axiovision Re. 4.8 |
Referenzen
- Kutter, C., Svoboda, P. miRNA, siRNA, piRNA: Knowns of the unknown. RNA Biol. 5, 181-188 (2008).
- Szell, M., Bata-Csorgo, Z., Kemeny, L. The enigmatic world of mRNA-like ncRNAs: their role in human evolution and in human diseases. Semin. Cancer Biol. 18, 141-148 (2008).
- Li, X., Jin, P. Roles of small regulatory RNAs in determining neuronal identity. Nature reviews. Neuroscience. 11, 329-338 (2010).
- Riedmann, L. T., Schwentner, R. miRNA, siRNA, piRNA and argonautes: news in small matters. RNA Biol. 7, 133-139 (2010).
- Coolen, M., Bally-Cuif, L. MicroRNAs in brain development and physiology. Curr. Opin. Neurobiol. 19, 461-470 (2009).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochem. Biophys. Res. Commun. 230, 376-380 (1997).
- Itasaki, N., Bel-Vialar, S., Krumlauf, R. Shocking’ developments in chick embryology: electroporation and in ovo gene expression. Nat. Cell Biol. 1, 203-207 (1999).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Dev. Growth Differ. 41, 335-344 (1999).
- Nakamura, H., Watanabe, Y. Misexpression of genes in brain vesicles by in ovo electroporation. Dev. Growth Differ. 42, 199-201 (2000).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nat. Protoc. 3, 419-426 (2008).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Gene Hofschneider, P. H. transfer into mouse lyoma cells by electroporation in high electric fields. The EMBO journal. 1, 841-845 (1982).
- Potter, H., Weir, L., Leder, P. Enhancer-dependent expression of human kappa immunoglobulin genes introduced into mouse pre-B lymphocytes by electroporation. Proceedings of the National Academy of Sciences of the United States of America. 81, 7161-7165 (1984).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Dev. Dyn. 229, 433-439 (2004).
- Canto-Soler, M. V., Adler, R. Optic cup and lens development requires Pax6 expression in the early optic vesicle during a narrow time window. Developmental biology. , 294-2119 (2006).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev Dyn. 195, 231-272 (1992).
- Muramatsu, T., Nakamura, A., Park, H. M. In vivo electroporation: a powerful and convenient means of nonviral gene transfer to tissues of living animals (Review). Int J Mol Med. 1, 55-62 (1998).
- Agoston, Z., Li, N., Haslinger, A., Wizenmann, A., Schulte, D. Genetic and physical interaction of Meis2, Pax3 and Pax7 during dorsal midbrain development. BMC Dev Biol. 12, 10 (2012).
- De Pietri Tonelli, D., et al. Single-cell detection of microRNAs in developing vertebrate embryos after acute administration of a dual-fluorescence reporter/sensor plasmid. Biotechniques. 41, 727-732 (2006).

