Gebruik van percutane ventriculaire hulpmiddelen bij acuut myocardinfarct gecompliceerd door cardiogene shock
Summary
Percutane ventriculaire hulpmiddelen worden steeds vaker gebruikt bij patiënten met een acuut myocardinfarct en cardiogene shock. Hierin bespreken we het werkingsmechanisme en de hemodynamische effecten van dergelijke apparaten. We beoordelen ook algoritmen en best practices voor de implantatie, het beheer en het spenen van deze complexe apparaten.
Abstract
Cardiogene shock wordt gedefinieerd als aanhoudende hypotensie, vergezeld van bewijs van hypo-perfusie van het eindorgaan. Percutane ventriculaire hulpmiddelen (PVAD’s) worden gebruikt voor de behandeling van cardiogene shock in een poging om de hemodynamiek te verbeteren. Impella is momenteel de meest voorkomende PVAD en pompt actief bloed uit de linker ventrikel in de aorta. PVAD’s ontladen de linker ventrikel, verhogen de cardiale output en verbeteren de coronaire perfusie. PVAD’s worden meestal in het hartkatheterisatielaboratorium geplaatst onder fluoroscopische begeleiding via de femorale slagader indien mogelijk. In gevallen van ernstige perifere arteriële ziekte kunnen PVADs worden geïmplanteerd via een alternatieve toegang. In dit artikel vatten we het werkingsmechanisme van PVAD samen en de gegevens die het gebruik ervan ondersteunen bij de behandeling van cardiogene shock.
Introduction
Cardiogene shock (CS) wordt gedefinieerd als aanhoudende hypotensie (systolische bloeddruk 30 minuten, of de behoefte aan vasopressoren of inotropen), hypoperfusie van het eindorgaan (urineproductie 2 mmol / L), pulmonale congestie (pulmonale capillaire wigdruk (PCWP) ≥ 15 mmHg) en verminderde hartprestaties (cardiale index <2,2 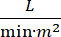 )1, 2 als gevolg van een primaire hartaandoening. Acuut myocardinfarct (AMI) is de meest voorkomende oorzaak van CS3. CS komt voor bij 5-10% van de AMI en is historisch geassocieerd met significantemortaliteit 3,4. Mechanische circulatoire ondersteuning (MCS) apparaten zoals intra-aorta ballonpomp (IABP), percutane ventriculaire hulpmiddelen (PVAD), extracorporale membraan oxygenatie (ECMO) en percutane linker atriale naar aorta apparaten worden vaak gebruikt bij patiënten met CS5. Routinematig gebruik van IABP heeft geen verbetering aangetoond in klinische uitkomsten of overleving in AMI-CS1. Gezien de slechte resultaten geassocieerd met AMI-CS, de moeilijkheden bij het uitvoeren van proeven in AMI-CS en de negatieve resultaten van IABP-gebruik in AMI-CS, kijken clinici steeds meer naar andere vormen van MCS.
)1, 2 als gevolg van een primaire hartaandoening. Acuut myocardinfarct (AMI) is de meest voorkomende oorzaak van CS3. CS komt voor bij 5-10% van de AMI en is historisch geassocieerd met significantemortaliteit 3,4. Mechanische circulatoire ondersteuning (MCS) apparaten zoals intra-aorta ballonpomp (IABP), percutane ventriculaire hulpmiddelen (PVAD), extracorporale membraan oxygenatie (ECMO) en percutane linker atriale naar aorta apparaten worden vaak gebruikt bij patiënten met CS5. Routinematig gebruik van IABP heeft geen verbetering aangetoond in klinische uitkomsten of overleving in AMI-CS1. Gezien de slechte resultaten geassocieerd met AMI-CS, de moeilijkheden bij het uitvoeren van proeven in AMI-CS en de negatieve resultaten van IABP-gebruik in AMI-CS, kijken clinici steeds meer naar andere vormen van MCS.
PVADs worden steeds vaker gebruikt bij patiënten met AMI-CS6. In dit artikel zullen we onze discussie voornamelijk richten op de Impella CP, de meest voorkomende PVAD die momenteel wordt gebruikt6. Dit apparaat maakt gebruik van een axiale stroom Archimedes-schroefpomp die actief en continu bloed van de linker ventrikel (LV) in de opstijgende aorta drijft(figuur 1). Het apparaat wordt meestal in het hartkatheterisatielaboratorium geplaatst onder fluoroscopische begeleiding via de femorale slagader. Als alternatief kan het worden geïmplanteerd via een oksel- of transcavale toegang indien nodig7,8.
Protocol
Representative Results
Discussion
Het minimaliseren van de risico’s en complicaties van PVAD(Tabel 2)
De hemodynamische voordelen van PVAD kunnen aanzienlijk worden geneutraliseerd als complicaties van toegang tot grote boringen optreden, zoals ernstige bloedingen en acute ischemie van ledematen28,29. Het is dus essentieel om het risico en de complicaties van het apparaat te minimaliseren.
Om complicaties op de toegangsplaats te verminderen en het a…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Geen
Materials
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
Referenzen
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d’intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O’Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O’neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).

