Utilización de dispositivos de asistencia ventricular percutánea en el infarto agudo de miocardio complicado por shock cardiogénico
Summary
Los dispositivos de asistencia ventricular percutánea se utilizan cada vez más en pacientes con infarto agudo de miocardio y shock cardiogénico. Aquí, discutimos el mecanismo de acción y los efectos hemodinámicos de tales dispositivos. También revisamos algoritmos y mejores prácticas para la implantación, manejo y destete de estos dispositivos complejos.
Abstract
El shock cardiogénico se define como hipotensión persistente, acompañada de evidencia de hipoperfusión en el órgano final. Los dispositivos de asistencia ventricular percutánea (PVAD) se utilizan para el tratamiento del shock cardiogénico en un esfuerzo por mejorar la hemodinámica. Impella es actualmente el PVAD más común y bombea activamente sangre desde el ventrículo izquierdo hacia la aorta. Los PVAD descargan el ventrículo izquierdo, aumentan el gasto cardíaco y mejoran la perfusión coronaria. Los PVAD generalmente se colocan en el laboratorio de cateterismo cardíaco bajo guía fluoroscópica a través de la arteria femoral cuando es posible. En casos de enfermedad arterial periférica grave, los PVAD se pueden implantar a través de un acceso alternativo. En este artículo, resumimos el mecanismo de acción de PVAD y los datos que respaldan su uso en el tratamiento del shock cardiogénico.
Introduction
El shock cardiogénico (SC) se define como hipotensión persistente (presión arterial sistólica 30 minutos, o la necesidad de vasopresores o inotrópicos), hipoperfusión de órganos terminales (diuresis 2 mmol / L), congestión pulmonar (presión de cuña capilar pulmonar [PCWP) ≥ 15 mmHg) y disminución del rendimiento cardíaco (índice cardíaco <2.2 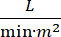 )1, 2 debido a un trastorno cardíaco primario. El infarto agudo de miocardio (IAM) es la causa más común de CS3. El SC ocurre en el 5-10% de los IAM e históricamente se ha asociado con una mortalidad significativa3,4. Los dispositivos de soporte circulatorio mecánico (SQM) como la bomba de balón intraaórtico (IABP), los dispositivos de asistencia ventricular percutánea (PVAD), la oxigenación por membrana extracorpórea (ECMO) y los dispositivos percutáneos de la aurícula izquierda a la aórtica se utilizan con frecuencia en pacientes con CS5. El uso rutinario de IABP no ha demostrado mejoría en los resultados clínicos o la supervivencia en AMI-CS1. Dados los malos resultados asociados con AMI-CS, las dificultades para realizar ensayos en AMI-CS y los resultados negativos del uso de IABP en AMI-CS, los médicos buscan cada vez más otras formas de MCS.
)1, 2 debido a un trastorno cardíaco primario. El infarto agudo de miocardio (IAM) es la causa más común de CS3. El SC ocurre en el 5-10% de los IAM e históricamente se ha asociado con una mortalidad significativa3,4. Los dispositivos de soporte circulatorio mecánico (SQM) como la bomba de balón intraaórtico (IABP), los dispositivos de asistencia ventricular percutánea (PVAD), la oxigenación por membrana extracorpórea (ECMO) y los dispositivos percutáneos de la aurícula izquierda a la aórtica se utilizan con frecuencia en pacientes con CS5. El uso rutinario de IABP no ha demostrado mejoría en los resultados clínicos o la supervivencia en AMI-CS1. Dados los malos resultados asociados con AMI-CS, las dificultades para realizar ensayos en AMI-CS y los resultados negativos del uso de IABP en AMI-CS, los médicos buscan cada vez más otras formas de MCS.
Los PVAD se utilizan cada vez más en pacientes con IAM-CS6. En este artículo, centraremos nuestra discusión principalmente en el Impella CP, que es el PVAD más común utilizado actualmente6. Este dispositivo utiliza una bomba de tornillo Arquímedes de flujo axial que impulsa activa y continuamente la sangre desde el ventrículo izquierdo (VI) hacia la aorta ascendente(Figura 1). El dispositivo se coloca con mayor frecuencia en el laboratorio de cateterismo cardíaco bajo guía fluoroscópica a través de la arteria femoral. Alternativamente, se puede implantar a través de un acceso axilar o transcaval cuando sea necesario7,8.
Protocol
Representative Results
Discussion
Minimización de los riesgos y complicaciones del PVAD (Tabla 2)
Los beneficios hemodinámicos de la PVAD pueden neutralizarse significativamente si se producen complicaciones del acceso de gran diámetro, como sangrado mayor e isquemia aguda de las extremidades28,29. Por lo tanto, es esencial minimizar el riesgo y las complicaciones del dispositivo.
Con el fin de disminuir las complicaciones del sitio de acceso y r…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Ninguno
Materials
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
Referenzen
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d’intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O’Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O’neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).

