경피 심실 보조 장치 활용 급성 심근 경색에 심근 쇼크로 복잡
Summary
경피 심실 보조 장치는 급성 심근 경색 및 심근 쇼크 환자에서 점점 더 활용되고 있습니다. 본원에서, 당사는 그러한 장치의 작용 및 혈역학적 효과의 메커니즘에 대해 논의합니다. 또한 이러한 복잡한 장치의 이식, 관리 및 짜기 알고리즘 및 모범 사례를 검토합니다.
Abstract
심장 유발 충격은 지속적인 저혈압으로 정의되며, 최종 기관 저관류의 증거를 동반합니다. 경피 심실 보조 장치 (PVADs)는 혈역학을 개선하기위한 노력의 일환으로 심근 쇼크의 치료에 사용됩니다. 임펠라는 현재 가장 흔한 PVAD이며 왼쪽 심실에서 대동맥으로 혈액을 적극적으로 펌핑합니다. PVAD는 좌심실을 하역하고, 심장 출력을 증가시키고, 관상 동맥 관류를 개선합니다. PVADs는 일반적으로 가능할 때 대퇴 동맥을 통해 형광유도하에 심장 카테터화 실험실에 배치됩니다. 가혹한 말초 동맥 질병의 경우에, PVAD는 대체 접근을 통해 이식될 수 있습니다. 이 문서에서는 PVAD의 작용 메커니즘과 심장 유발 쇼크 치료에 대한 사용을 지원하는 데이터를 요약합니다.
Introduction
심장 유발 충격 (CS)은 지속적인 저혈압 (수축기 혈압 30 분 동안 정의되며, 또는 혈관 제또는 이노트로프의 필요성), 최종 장기 저관류(소변 출력 2mmol/L), 폐 혼잡(폐 모세관 쐐기 압력(PCWP) ≥ 15mmHg) 및 심장 성능 저하(심장 지수 <2.2) 1, 심장 성능 감소(심장 지수 <2.2) 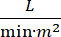 2 1 차적인 심장 무질서 때문에. 급성 심근 경색 (AMI)은 CS3의가장 흔한 원인입니다. CS는 AMI의 5-10%에서 발생하며 역사적으로 상당한 사망률3,4와관련이 있습니다. 대동맥 풍선 펌프(IABP), 경피심실 보조 장치(PVAD), 외피막 산소화(ECMO), 경피좌심방과 같은 기계적 순환 유지(MCS) 장치는 CS5를가진 환자에서 자주 사용된다. IABP의 일상적인 사용은 AMI-CS1에서임상 결과 또는 생존에 있는 아무 개선도 입증되지 않았습니다. AMI-CS와 관련되었던 나쁜 결과, AMI-CS에 있는 예심을 실시하는 어려움 및 AMI-CS에 있는 IABP 사용의 부정적인 결과를 감안할 때, 임상의는 MCS의 그밖 양식을 점점 찾고 있습니다.
2 1 차적인 심장 무질서 때문에. 급성 심근 경색 (AMI)은 CS3의가장 흔한 원인입니다. CS는 AMI의 5-10%에서 발생하며 역사적으로 상당한 사망률3,4와관련이 있습니다. 대동맥 풍선 펌프(IABP), 경피심실 보조 장치(PVAD), 외피막 산소화(ECMO), 경피좌심방과 같은 기계적 순환 유지(MCS) 장치는 CS5를가진 환자에서 자주 사용된다. IABP의 일상적인 사용은 AMI-CS1에서임상 결과 또는 생존에 있는 아무 개선도 입증되지 않았습니다. AMI-CS와 관련되었던 나쁜 결과, AMI-CS에 있는 예심을 실시하는 어려움 및 AMI-CS에 있는 IABP 사용의 부정적인 결과를 감안할 때, 임상의는 MCS의 그밖 양식을 점점 찾고 있습니다.
PVAD는 AMI-CS6환자에서점점 더 활용되고 있다. 이 문서에서는 현재6에서가장 일반적인 PVAD인 임펠라 CP에 주로 토론을 집중할 것입니다. 이 장치는 축 흐름 Archimedes-나사 펌프를 활용하여 왼쪽 심실(LV)에서 오름차순 대동맥(도1)으로혈액을 활발하고 지속적으로 추진합니다. 이 장치는 대퇴 동맥을 통해 형광성 지도하에 심장 카테터화 실험실에 가장 빈번하게 배치됩니다. 대안적으로, 필요할 때 액실 또는 트랜스카발 액세스를 통해 이식될 수 있다7,8.
Protocol
Representative Results
Discussion
PVAD의 위험과 합병증 최소화(표 2)
PVAD의 혈역학적 이점은 주요 출혈 및 급성 사지허혈(28,29)과같은 대형 보어 접근에서 합병증이 발생하면 현저하게 중화될 수 있다. 따라서 장치의 위험과 합병증을 최소화하는 것이 필수적입니다.
접근 부위 합병증을 줄이고 접근 시도 횟수를 줄이기 위해, 초음파 및 불소 지침은 대?…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
없음
Materials
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
Referenzen
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d’intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O’Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O’neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).

