Исследования взаимодействия шаперон-кочаперон с использованием гомогенного бисероплетения
Summary
Этот протокол представляет собой метод исследования белково-белковых взаимодействий с использованием глутатион-связанных донорских шариков с GST-сплавленными TPR-мотив-ко-шаперонами и акцепторными шариками в сочетании с пептидом, полученным из Hsp90. Мы использовали этот метод для скрининга небольших молекул для нарушения взаимодействий Hsp90-FKBP51 или Hsp90-FKBP52 и идентифицировали мощные и селективные ингибиторы взаимодействия Hsp90-FKBP51.
Abstract
Нацеливание на взаимодействие белка теплового шока 90 (Hsp90)-кочаперона дает возможность специфически регулировать Hsp90-зависимые внутриклеточные процессы. Законсервированный пентапептид MEEVD на С-конце Hsp90 отвечает за взаимодействие с мотивом тетратрикопептидного повтора (TPR) ко-шаперонов. FK506-связывающий белок (FKBP) 51 и FKBP52 являются двумя аналогичными TPR-мотивными ко-шаперонами, участвующими в стероидных гормонозависимых заболеваниях с различными функциями. Таким образом, идентификация молекул, специфически блокирующих взаимодействия между Hsp90 и FKBP51 или FKBP52, обеспечивает многообещающий терапевтический потенциал для нескольких заболеваний человека. Здесь мы описываем протокол для усиленного люминесцентного равноконтактного однородного анализа для зондирования взаимодействий между Hsp90 и его партнерскими ко-шаперонами FKBP51 и FKBP52. Во-первых, мы очистили TPR-мотив-содержащие белки FKBP51 и FKBP52 в форме, помеченной глутатион S-трансферазой (GST). Используя глутатион-связанные донорские шарики с GST-сплавленными белками TPR-мотива и акцепторными шариками в сочетании с 10-мерным С-концевым пептидом Hsp90, мы исследовали белково-белковые взаимодействия в однородной среде. Мы использовали этот анализ для скрининга небольших молекул для нарушения взаимодействий Hsp90-FKBP51 или Hsp90-FKBP52 и идентифицировали мощные и селективные ингибиторы взаимодействия Hsp90-FKBP51.
Introduction
Молекулярные шапероны способствуют гомеостазу белка, включая сворачивание белка, транспорт и деградацию. Они регулируют несколько клеточных процессов и связаны с многочисленными заболеваниями, такими как рак и нейродегенеративные заболевания1. Белок теплового шока 90 (Hsp90) является одним из наиболее важных шаперонов, функция которого зависит от конформационных изменений, вызванных гидролизом АТФ и связыванием с клиентскими белками, опосредованными его ко-шаперонами2. Несмотря на очевидный потенциал Hsp90 в качестве терапевтической мишени, тонкая настройка его функции представляет собой большую проблему. Существует несколько ингибиторов Hsp90, нацеленных на N-концевую область связывания АТФ, которые были оценены в клинических испытаниях, но ни один из них не был одобрен для маркетинга3. Из-за отсутствия четко определенного лигандсвязывающегокармана 4,нацеливание на С-концевую область Hsp90 имело ограниченный успех4. В последнее время нарушение взаимодействий Hsp90-кохаперонов малыми молекулами было исследовано в качестве альтернативной стратегии5. Нацеливание на взаимодействия Hsp90-кохаперонов не вызывает общей реакции клеточного стресса и дает возможность специфически регулировать различные внутриклеточные процессы. Законсервированный пентапептид MEEVD на С-конце Hsp90 отвечает за взаимодействие с мотивом тетратрикопептидного повтора (TPR) ко-шаперонов6. Из 736 белков, содержащих мотивы TPR, аннотированных в базе данных белков человека, ~ 20 различных белков взаимодействуют с Hsp90 через этотпептид 7. Молекулы, конкурирующие за пептидное связывание MEEVD, нарушат взаимодействие между Hsp90 и ко-шаперонами, содержащими домен TPR. Сайт связывания пептидов имеет сходную третичную структуру, но общая гомология между различными доменами мотивов TPR относительно низкая7,что дает возможность идентифицировать молекулы, специально способные блокировать взаимодействия между Hsp90 и конкретными TPR-мотивными ко-шаперонами. Среди этих TPR-мотивных ко-шаперонов FK506-связывающий белок (FKBP) 51 и FKBP52 являются регуляторами передачи сигналов рецепторов стероидных гормонов (SHR) и участвуют в нескольких стероидных гормонозависимых заболеваниях, включая рак, связанные со стрессом заболевания, метаболические заболевания и болезнь Альцгеймера8. Хотя FKBP51 и FKBP52 имеют > 80% сходства последовательностей, их функции различаются: FKBP52 является положительным регулятором деятельности SHR, в то время как FKBP51 является отрицательным регулятором в большинстве случаев8. Таким образом, идентификация молекул, специфически блокирующих взаимодействия между Hsp90 и FKBP51 или FKBP52, обеспечивает многообещающий терапевтический потенциал для связанных заболеваний.
Усыпляемый L-умингесцентный Proximity Homogenous Assay (AlphaScreen) был впервые разработан в 1994 году Ullman EF et al.9. В настоящее время он широко используется для обнаружения различных типов биологических взаимодействий, таких какпептид 10,белок11,ДНК12,РНК13и сахар14. В этой технике существует два вида бусин (диаметр 200 нм), один из них является донорской бусиной, а другой – акцепторной бусиной. Биомолекулы иммобилизуются на эти шарики; их биологические взаимодействия приводят к сближению бусин донора и акцептора. При 680 нм фотосенсибилизатор в донорской бусине освещает и преобразует кислород в синглетный кислород. Поскольку синглетный кислород имеет короткое время жизни, он может диффундировать только до 200 нм. Если шарик акцептора находится в непосредственной близости, его производное тиоксена реагирует с синглетным кислородом, генерируя хемилюминесценцию при 370 нм. Эта энергия дополнительно активирует флуорофоры в том же акцепторном шарике, чтобы излучать свет при 520-620 нм15. Если биологические взаимодействия нарушаются, акцепторная бусина и донорская бусина не могут достичь близости, что приводит к распаду синглетного кислорода и низкому образуемого сигнала.
Здесь мы описываем протокол, использующий этот метод для скрининга малых молекул, ингибируя взаимодействия между Hsp90 и TPR ко-шаперонами, особенно FKBP51 и FKBP52. 10 аминокислот длинных пептидов, соответствующих экстремальному С-конце Hsp90, прикреплены к акцепторным шарикам. Очищенные GST-помеченные ко-шапероны TPR взаимодействуют с донорскими шариками, связанными с глутатионом. Когда взаимодействие между пептидами, полученными из Hsp90, и ко-шаперонами TPR-мотива сближает шарики, образуется усиленный сигнал(рисунок 1A). Если экранированные малые молекулы могут ингибировать взаимодействия между Hsp90 и TPR-мотивными ко-шаперонами, этот усиленный сигнал будет уменьшен(рисунок 1B). Их IC50 может быть рассчитан путем количественного измерения. Этот протокол может быть распространен на любые интересующих взаимодействия шаперона – TPR-мотива и имеет большое значение в разработке новых молекул, в частности блокирующих взаимодействие между Hsp90 и FKBP51 или FKBP52.
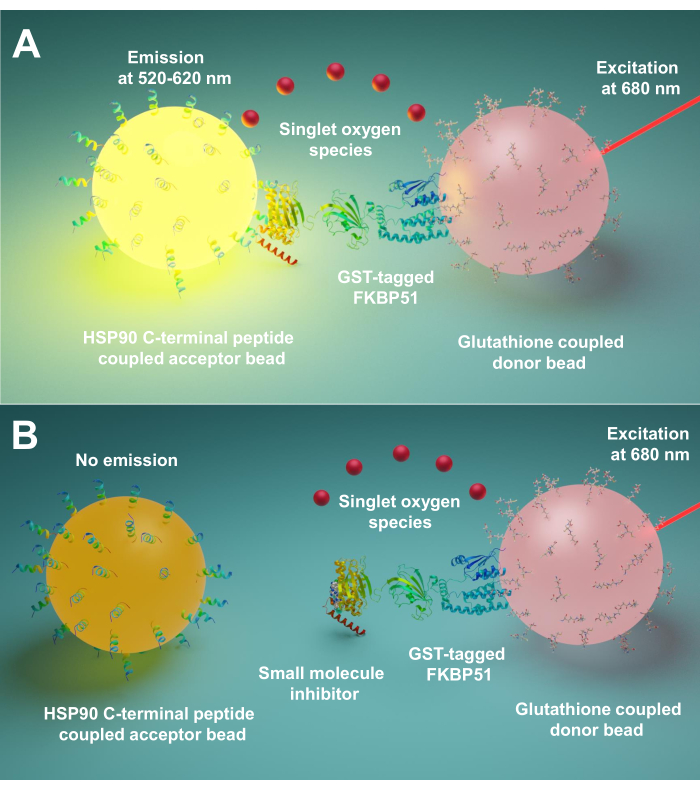
Рисунок 1:Основной принцип этого анализа. (A) Очищенный GST-FKBP51 взаимодействует с глутатион-связанными донорскими шариками. 10 аминокислот длинных пептидов, соответствующих экстремальному С-конце Hsp90, прикреплены к акцепторным шарикам. Взаимодействие между пептидами, полученными из Hsp90, и доменом TPR FKBP51 приближает донорские и акцепторные шарики. При 680 нм фотосенсибилизатор в донорской бусине освещает и преобразует кислород в синглетный кислород. Производное тиоксена на акцепторной бусине реагирует с синглетным кислородом и генерирует хемилюминесценцию при 370 нм. Эта энергия дополнительно активирует флуорофоры в том же акцепторном шарике, чтобы излучать свет при 520-620 нм. (B) Когда малые молекулы ингибируют взаимодействия между Hsp90 и FKBP51, донорские и акцепторные шарики не могут достичь близости. Затем синглетный кислород с коротким сроком службы распадается, и не вырабатывается обнаруживаемый сигнал. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Здесь мы описываем протокол, использующий анализ для скрининга малых молекул, ингибируя взаимодействия между Hsp90 и TPR-мотивными ко-шаперонами, особенно FKBP51 и FKBP52. Его высокий балл Z’ (>0,8) демонстрирует надежность и надежность для формата с высокой пропускной способностью. Результаты могу…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Это исследование было поддержано грантами Шведского исследовательского совета (2018-02843), Фонда мозга (Fo 2019-0140), Фонда гериатрических заболеваний в Каролинском институте, Фонда Гунвора и Йозефа Анерса, Фонда Магнуса Бергваллса, Фонда Гана и Бертиля Стонеса, Фонда медицинских исследований Торе Нильссона, Фонда Маргареты аф Угглас и Фонда старых слуг.
Materials
| 384-well plates | Perkin Elmer | 6008350 | Assay volume 25 ml |
| Amicon 10.000 MWCO centrifugation unit | Millipore | UFC901008 | Concentrate protein |
| Ampicillin | Sigma | A0166 | Antibiotics |
| Bacteria shaker Unimax 1010 | Heidolph | Culture bacteria | |
| cDNA clones for human FKBP51 | Source BioScience | clone id: 5723416 | pCMV-SPORT6 vector |
| cDNA clones for human FKBP52 | Source BioScience | clone id: 7474554 | pCMV-SPORT6 vector |
| Chemically Competent E. coli | Invitrogen | C602003 | One Shot BL21 Star (DE3) |
| Data analysis software | GraphPad Prism | 9.0.0 | Analysis data and make figures |
| Data analysis software | Excel | Analysis data | |
| DMSO | Supelco | 1.02952.1000 | Dilute compounds |
| DPBS | Gibco | 14190-144 | Prepare solution |
| EDTA | Calbiochem | 344504 | Prevent proteolysis during sonication |
| Glutathione | Sigma | G-4251 | Elute GST-tagged proteins |
| Glutathione donor beads | Perkin Elmer | 6765300 | Donor bead |
| GST-trap column | Cytiva (GE Healthcare) | 17528201 | Purify GST-tagged proteins |
| Isopropyl-β-D-thiogalactoside | Thermo Fisher Scientific | R0392 | Induce protein expression |
| LB Broth (Miller) | Sigma | L3522 | Microbial growth medium |
| PCR instrument | BIO-RAD | S1000 Thermal Cycler | Amplification/PCR |
| PD-10 column | Cytiva (GE Healthcare) | 17085101 | Solution exchange |
| pGEX-6P-1 vector | Cytiva (GE Healthcare) | 28954648 | Plasmid |
| pGEX-6P-2 vector | Cytiva (GE Healthcare) | 28954650 | Plasmid |
| Plate reader | Perkin Elmer | EnSpire 2300 Multilabel Reader | Read alpha plate |
| Plate reader software | Perkin Elmer | EnSpire Manager | Plate reader software |
| Plate reader software protocol | Perkin Elmer | Alpha 384-well Low volume | Use this protocol to read plate |
| PMSF | Sigma | P7626 | Prevent proteolysis during sonication |
| protease inhibitor cocktail | Sigma | S8830 | Prevent proteolysis during sonication |
| Sodium azide | Sigma | S2002 | As a preservative |
| Sodium cyanoborohydride (NaBH3CN) | Sigma | 156159 | Activates matrix for coupling |
| Ten amino acid peptide NH2-EDASRMEEVD-COOH corresponding to amino acids 714-724 of human Hsp90 beta isoform | Peptide 2.0 inc | Synthesize Hsp90 C-terminal peptide | |
| Test-Tube Rotator | LABINCO | Make end-over-end agitation | |
| Tris-HCl | Sigma | 10708976001 | Block unreacted sites of acceptor beads |
| Tween-20 | Sigma | P1379 | Prevent beads aggregation |
| Ultra centrifuge Avanti J-20 XP | Beckman Coulter | Centrifuge to get bacteria cell pellets | |
| Ultrasonic cell disruptor | Microson | Sonicate cells to release protein | |
| Unconjugated acceptor beads | Perkin Elmer | 6762003 | Acceptor beads |
| XCell SureLock Mini-Cell and XCell II Blot Module | Invitrogen | EI0002 | SDS-PAGE |
Referenzen
- Muchowski, P. J., Wacker, J. L. Modulation of neurodegeneration by molecular chaperones. Nature Reviews Neuroscience. 6 (1), 11-22 (2005).
- Eckl, J. M., Richter, K. Functions of the Hsp90 chaperone system: lifting client proteins to new heights. International Journal of Biochemistry and Molecular Biology. 4 (4), 157-165 (2013).
- Yuno, A. Clinical evaluation and biomarker profiling of Hsp90 inhibitors. Methods in Molecular Biology. 1709, 426-441 (2018).
- Dutta Gupta, S., Bommaka, M. K., Banerjee, A. Inhibiting protein-protein interactions of Hsp90 as a novel approach for targeting cancer. European Journal of Medicinal Chemistry. 178, 48-63 (2019).
- Pavlov, P. F., Hutter-Paier, B., Havas, D., Windisch, M., Winblad, B. Development of GMP-1 a molecular chaperone network modulator protecting mitochondrial function and its assessment in fly and mice models of Alzheimer’s disease. Journal of Cellular and Molecular Medicine. 22 (7), 3464-3474 (2018).
- Young, J. C., Obermann, W. M., Hartl, F. U. Specific binding of tetratricopeptide repeat proteins to the C-terminal 12-kDa domain of hsp90. Journal of Biological Chemistry. 273 (29), 18007-18010 (1998).
- Scheufler, C., et al. Structure of TPR domain-peptide complexes: critical elements in the assembly of the Hsp70-Hsp90 multichaperone machine. Cell. 101 (2), 199-210 (2000).
- Storer, C. L., Dickey, C. A., Galigniana, M. D., Rein, T., Cox, M. B. FKBP51 and FKBP52 in signaling and disease. Trends in Endocrinology & Metabolism. 22 (12), 481-490 (2011).
- Ullman, E. F., et al. Luminescent oxygen channeling immunoassay: measurement of particle binding kinetics by chemiluminescence. Proceedings of the National Academy of Sciences of the United States of America. 91 (12), 5426-5430 (1994).
- Wigle, T. J., et al. Screening for inhibitors of low-affinity epigenetic peptide-protein interactions: an AlphaScreen-based assay for antagonists of methyl-lysine binding proteins. Journal of Biomolecular Screening. 15 (1), 62-71 (2010).
- Guenat, S., et al. Homogeneous and nonradioactive high-throughput screening platform for the characterization of kinase inhibitors in cell lysates. Journal of Biomolecular Screening. 11 (8), 1015-1026 (2006).
- Sabatucci, A., et al. A new methodological approach for in vitro determination of the role of DNA methylation on transcription factor binding using AlphaScreen(R) analysis: Focus on CREB1 binding at hBDNF promoter IV. Journal of Neuroscience Methods. 341, 108720 (2020).
- Mills, N. L., Shelat, A. A., Guy, R. K. Assay Optimization and Screening of RNA-Protein Interactions by AlphaScreen. Journal of Biomolecular Screening. 12 (7), 946-955 (2007).
- Huang, X., et al. A competitive alphascreen assay for detection of hyaluronan. Glycobiology. 28 (3), 137-147 (2018).
- Principles of alphascreen amplified luinescent proximmity homogenous assay. PerkinElmer Life Sciences Available from: https://www.perkinelmer.com/lab-solutions/resources/docs/APP_AlphaScreen_Principles.pdf (2021)
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).

