Homojen Boncuk Bazlı Test Kullanılarak Chaperone-Cochaperone Etkileşimleri Çalışmaları
Summary
Bu protokol, GST ile kaynaşmış TPR motifli yardımcı refakatçiler ve Hsp90 türevli peptit ile birleştirilmiş alıcı boncuklar ile glutatyon bağlantılı donör boncuklar kullanarak protein-protein etkileşimlerini yoklama tekniği sunar. Bu tekniği, Hsp90-FKBP51 veya Hsp90-FKBP52 etkileşimlerini bozmak için küçük molekülleri taramak için kullandık ve güçlü ve seçici Hsp90-FKBP51 etkileşim inhibitörlerini belirledik.
Abstract
Isı şok proteini 90 (Hsp90)-cochaperone etkileşimlerinin hedeflenerek Hsp90’a bağımlı hücre içi süreçleri özel olarak düzenleme imkanı sağlar. Hsp90’ın C-terminusundaki korunmuş MEEVD pentapeptid, eş refakatçilerin tetratrikopeptid tekrarı (TPR) motifi ile etkileşimden sorumludur. FK506 bağlayıcı protein (FKBP) 51 ve FKBP52, farklı işlevlere sahip steroid hormona bağımlı hastalıklarda yer alan iki benzer TPR motifli yardımcı refakatçidir. Bu nedenle, özellikle Hsp90 ve FKBP51 veya FKBP52 arasındaki etkileşimleri engelleyen moleküllerin tanımlanması, birkaç insan hastalığı için umut verici bir terapötik potansiyel sağlar. Burada, Hsp90 ve ortağı ortak refakatçiler FKBP51 ve FKBP52 arasındaki etkileşimleri araştırmak için güçlendirilmiş bir lüminesans yakınlık homojen test protokolünü açıklıyoruz. İlk olarak, TPR motif içeren proteinler FKBP51 ve FKBP52’yi glutatyon S-transferaz (GST) etiketli formda saflaştırdık. GST ile kaynaşmış TPR motifli proteinler ile glutatyon bağlantılı donör boncukları ve Hsp90’ın 10 mer C-terminal peptidi ile birleştirilmiş alıcı boncukları kullanarak, homojen bir ortamda protein-protein etkileşimlerini araştırdık. Bu testi, Hsp90-FKBP51 veya Hsp90-FKBP52 etkileşimlerini bozmak için küçük molekülleri taramak için kullandık ve güçlü ve seçici Hsp90-FKBP51 etkileşim inhibitörlerini belirledik.
Introduction
Moleküler refakatçiler protein katlanması, taşınması ve bozulması da dahil olmak üzere protein homeostazlarına katkıda bulunur. Birkaç hücresel süreci düzenlerler ve kanser ve nörodejeneratif hastalıklar gibi çok sayıda hastalıkla bağlantılıdırlar1. Isı şoku proteini 90 (Hsp90), işlevi ATP hidrolizi tarafından yönlendirilen konformasyonel değişikliklere ve yardımcı refakatçilerinin aracılık ettiği müşteri proteinleri ile bağlanmasına bağlı olan en önemli refakatçilerden biridir2. Hsp90’ın terapötik hedef olarak bariz bir potansiyeline rağmen, işlevinin ince ayarını büyük bir zorluk temsil eder. Klinik çalışmalarda değerlendirilen N-terminal ATP bağlama bölgesini hedefleyen birkaç Hsp90 inhibitörü vardır, ancak hiçbiri pazarlama için onaylanmamıştır3. İyi tanımlanmış bir ligand bağlayıcı cep olmaması nedeniyle4, Hsp90’ın C terminali bölgesini hedeflemek sınırlı başarıya sahipti4. Son zamanlarda, Hsp90-cochaperone etkileşimlerinin küçük moleküller tarafından bozulması alternatif bir strateji olarak araştırılmıştır5. Hsp90-cochaperone etkileşimlerinin hedeflmesi genel hücre stres tepkisi oluşturmaz ve çeşitli hücre içi süreçleri özel olarak düzenleme olanağı sağlar. Hsp90’ın C-terminus’ında korunan MEEVD pentapeptid, eş refakatçilerin tetratrikopeptid tekrarı (TPR) motifi6ile etkileşimden sorumludur. İnsan protein veritabanında açıklamalı 736 TPR motif içeren proteinden~ 20 farklı protein bu peptit aracılığıyla Hsp90 ile etkileşime girer7. MEEVD peptit bağlama için yarışan moleküller, Hsp90 ve TPR alanı içeren yardımcı refakatçiler arasındaki etkileşimleri bozayar. Peptit bağlama bölgesi benzer üçüncül yapıya sahiptir, ancak farklı TPR motif alanları arasındaki genel homoloji nispeten düşüktür7Özellikle Hsp90 ve belirli TPR motifli yardımcı refakatçiler arasındaki etkileşimleri engelleyebilen molekülleri tanımlamak için bir fırsat sağlar. Bu TPR motifli yardımcı refakatçiler arasında, FK506 bağlayıcı protein (FKBP) 51 ve FKBP52 steroid hormon reseptör (SHR) sinyal düzenleyicileri ve kanser, strese bağlı hastalıklar, metabolik hastalıklar ve Alzheimer hastalığı dahil olmak üzere çeşitli steroid hormon bağımlı hastalıklara dahil8vardır. FKBP51 ve FKBP52% 80 sıra benzerliğini > paylaşsa da, işlevleri farklıdır: FKBP52 SHR aktivitesinin pozitif bir düzenleyicisidir, FKBP51 ise çoğu durumda negatif bir düzenleyicidir8. Bu nedenle, moleküllerin tanımlanması, özellikle Hsp90 ve FKBP51 veya FKBP52 arasındaki etkileşimleri bloke etmek, ilgili hastalıklar için umut verici bir terapötik potansiyel sağlar.
Mplified Luminescent Proximity Homogenous Assay (AlphaScreen) ilk olarak 1994 yılında Ullman EF ve ark.9tarafından geliştirilmiştir. Şimdi peptit 10 , protein11, DNA 12 , RNA13ve şeker14gibi farklı biyolojik etkileşim türlerini tespit etmek için yaygın olarak kullanılmaktadır. Bu teknikte iki çeşit boncuk (çap 200 nm), biri donör boncuk, diğeri kabul eden boncuk vardır. Biyomoleküller bu boncukların üzerine hareketsiz hale getirilir; biyolojik etkileşimleri donör ve alıcı boncukları yakınlığa getirir. 680 nm’de, donör boncuktaki bir ışığa duyarlılıklayıcı oksijeni aydınlatır ve tek oksijene dönüştürür. Tek oksijenin ömrü kısa olduğu için sadece 200 nm’ye kadar yayılabilir. Kabul eden boncuk yakınsa, tiyoksen türevi 370 nm’de tek oksijen üreten chemiluminescence ile reaksiyona gelir. Bu enerji, 520-620 nm15’teışık yaymak için aynı kabul edici boncuktaki floroforları daha da aktive eder. Biyolojik etkileşimler bozulursa, alıcı boncuk ve donör boncuk yakınlığa ulaşamaz, bu da tek oksijen çürümesine ve düşük üretilen sinyale neden olur.
Burada, başta FKBP51 ve FKBP52 olmak üzere Hsp90 ve TPR yardımcı refakatçileri arasındaki etkileşimleri engelleyen küçük molekülleri taramak için bu tekniği kullanan bir protokol açıklıyoruz. Hsp90 aşırı C-terminusuna karşılık gelen 10 amino asit uzunluğunda peptit, kabul eden boncuklara bağlanır. Saflaştırılmış GST etiketli TPR yardımcı refakatçileri glutatyon bağlantılı donör boncuklarla etkileşime girer. Hsp90 türevi peptitler ve TPR motifli yardımcı refakatçiler arasındaki etkileşim boncukları bir araya getirdiğinde, güçlendirilmiş bir sinyal üretilir (Şekil 1A). Taranmış küçük moleküller Hsp90 ve TPR motifli yardımcı refakatçiler arasındaki etkileşimleri engelleyebilirse, bu güçlendirilmiş sinyal azaltılacaktır (Şekil 1B). IC50’leri nicel ölçümle hesaplanabilir. Bu protokol herhangi bir refakatçiye genişletilebilir – TPR motifli ortak refakatçi etkileşimleri ilgi çekicidir ve özellikle Hsp90 ve FKBP51 veya FKBP52 arasındaki etkileşimi engelleyen yeni moleküllerin geliştirilmesinde büyük önem taşır.
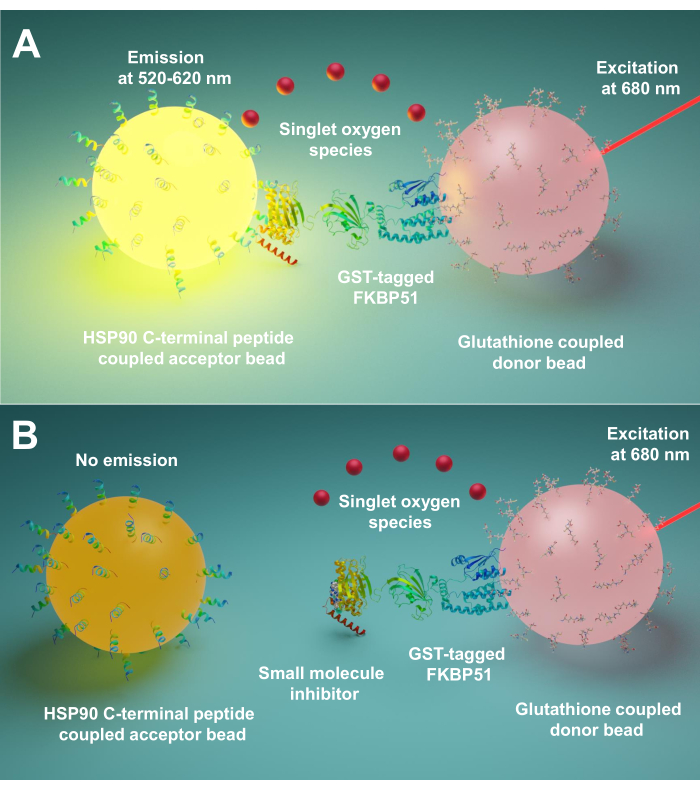
Şekil 1: Bu tahlilin temel prensibi. (A) Saflaştırılmış GST-FKBP51 glutatyon bağlantılı donör boncuklarla etkileşime girer. Hsp90’ın aşırı C-terminusuna karşılık gelen 10 amino asit uzunluğundaki peptitler kabul eden boncuklara bağlanır. Hsp90 türevi peptitler ile FKBP51’in TPR etki alanı arasındaki etkileşim, donör ve alıcı boncukları yakınlığa getirir. 680 nm’de, donör boncuktaki bir ışığa duyarlılıklayıcı oksijeni aydınlatır ve tek oksijene dönüştürür. Kabul eden boncuk üzerindeki tiyoksin türevi singlet oksijen ile reaksiyona sokur ve 370 nm’de chemiluminescence üretir. Bu enerji, 520-620 nm’de ışık yaymak için aynı kabul edici boncuktaki floroforları daha da aktive eder. (B) Küçük moleküller Hsp90 ve FKBP51 arasındaki etkileşimleri engellediğinde, donör ve alıcı boncuklar yakınlığa ulaşamaz. Daha sonra kısa ömürlü tek oksijen bozunur ve tespit edilebilir bir sinyal üretilmez. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Burada, başta FKBP51 ve FKBP52 olmak üzere Hsp90 ve TPR motifli yardımcı refakatçiler arasındaki etkileşimleri engelleyen küçük molekülleri taramak için test kullanan bir protokol açıklıyoruz. Yüksek Z’ puanı (>0,8), yüksek aktarım hızı formatının sağlamlığını ve güvenilirliğini gösterir. Sonuçlar bir saat içinde elde edilebilir ve az miktarda boncuk, protein ve bileşik gereklidir. Ayrıca, bu protokol herhangi bir Hsp90/Hsp70 – TPR motifli co-chaperone etkileşimlerine kolayca genişlet…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Bu çalışma İsveç Araştırma Konseyi (2018-02843), Beyin Vakfı (Fo 2019-0140), Karolinska Institutet Geriatrik Hastalıklar Vakfı, Gunvor ve Josef Anérs Vakfı, Magnus Bergvalls Vakfı, Gun ve Bertil Stohnes Vakfı, Tıbbi Araştırmalar için Tore Nilssons Vakfı, Margaretha af Ugglas vakfı ve Eski Hizmetliler Vakfı’nın hibeleriyle desteklendi.
Materials
| 384-well plates | Perkin Elmer | 6008350 | Assay volume 25 ml |
| Amicon 10.000 MWCO centrifugation unit | Millipore | UFC901008 | Concentrate protein |
| Ampicillin | Sigma | A0166 | Antibiotics |
| Bacteria shaker Unimax 1010 | Heidolph | Culture bacteria | |
| cDNA clones for human FKBP51 | Source BioScience | clone id: 5723416 | pCMV-SPORT6 vector |
| cDNA clones for human FKBP52 | Source BioScience | clone id: 7474554 | pCMV-SPORT6 vector |
| Chemically Competent E. coli | Invitrogen | C602003 | One Shot BL21 Star (DE3) |
| Data analysis software | GraphPad Prism | 9.0.0 | Analysis data and make figures |
| Data analysis software | Excel | Analysis data | |
| DMSO | Supelco | 1.02952.1000 | Dilute compounds |
| DPBS | Gibco | 14190-144 | Prepare solution |
| EDTA | Calbiochem | 344504 | Prevent proteolysis during sonication |
| Glutathione | Sigma | G-4251 | Elute GST-tagged proteins |
| Glutathione donor beads | Perkin Elmer | 6765300 | Donor bead |
| GST-trap column | Cytiva (GE Healthcare) | 17528201 | Purify GST-tagged proteins |
| Isopropyl-β-D-thiogalactoside | Thermo Fisher Scientific | R0392 | Induce protein expression |
| LB Broth (Miller) | Sigma | L3522 | Microbial growth medium |
| PCR instrument | BIO-RAD | S1000 Thermal Cycler | Amplification/PCR |
| PD-10 column | Cytiva (GE Healthcare) | 17085101 | Solution exchange |
| pGEX-6P-1 vector | Cytiva (GE Healthcare) | 28954648 | Plasmid |
| pGEX-6P-2 vector | Cytiva (GE Healthcare) | 28954650 | Plasmid |
| Plate reader | Perkin Elmer | EnSpire 2300 Multilabel Reader | Read alpha plate |
| Plate reader software | Perkin Elmer | EnSpire Manager | Plate reader software |
| Plate reader software protocol | Perkin Elmer | Alpha 384-well Low volume | Use this protocol to read plate |
| PMSF | Sigma | P7626 | Prevent proteolysis during sonication |
| protease inhibitor cocktail | Sigma | S8830 | Prevent proteolysis during sonication |
| Sodium azide | Sigma | S2002 | As a preservative |
| Sodium cyanoborohydride (NaBH3CN) | Sigma | 156159 | Activates matrix for coupling |
| Ten amino acid peptide NH2-EDASRMEEVD-COOH corresponding to amino acids 714-724 of human Hsp90 beta isoform | Peptide 2.0 inc | Synthesize Hsp90 C-terminal peptide | |
| Test-Tube Rotator | LABINCO | Make end-over-end agitation | |
| Tris-HCl | Sigma | 10708976001 | Block unreacted sites of acceptor beads |
| Tween-20 | Sigma | P1379 | Prevent beads aggregation |
| Ultra centrifuge Avanti J-20 XP | Beckman Coulter | Centrifuge to get bacteria cell pellets | |
| Ultrasonic cell disruptor | Microson | Sonicate cells to release protein | |
| Unconjugated acceptor beads | Perkin Elmer | 6762003 | Acceptor beads |
| XCell SureLock Mini-Cell and XCell II Blot Module | Invitrogen | EI0002 | SDS-PAGE |
Referenzen
- Muchowski, P. J., Wacker, J. L. Modulation of neurodegeneration by molecular chaperones. Nature Reviews Neuroscience. 6 (1), 11-22 (2005).
- Eckl, J. M., Richter, K. Functions of the Hsp90 chaperone system: lifting client proteins to new heights. International Journal of Biochemistry and Molecular Biology. 4 (4), 157-165 (2013).
- Yuno, A. Clinical evaluation and biomarker profiling of Hsp90 inhibitors. Methods in Molecular Biology. 1709, 426-441 (2018).
- Dutta Gupta, S., Bommaka, M. K., Banerjee, A. Inhibiting protein-protein interactions of Hsp90 as a novel approach for targeting cancer. European Journal of Medicinal Chemistry. 178, 48-63 (2019).
- Pavlov, P. F., Hutter-Paier, B., Havas, D., Windisch, M., Winblad, B. Development of GMP-1 a molecular chaperone network modulator protecting mitochondrial function and its assessment in fly and mice models of Alzheimer’s disease. Journal of Cellular and Molecular Medicine. 22 (7), 3464-3474 (2018).
- Young, J. C., Obermann, W. M., Hartl, F. U. Specific binding of tetratricopeptide repeat proteins to the C-terminal 12-kDa domain of hsp90. Journal of Biological Chemistry. 273 (29), 18007-18010 (1998).
- Scheufler, C., et al. Structure of TPR domain-peptide complexes: critical elements in the assembly of the Hsp70-Hsp90 multichaperone machine. Cell. 101 (2), 199-210 (2000).
- Storer, C. L., Dickey, C. A., Galigniana, M. D., Rein, T., Cox, M. B. FKBP51 and FKBP52 in signaling and disease. Trends in Endocrinology & Metabolism. 22 (12), 481-490 (2011).
- Ullman, E. F., et al. Luminescent oxygen channeling immunoassay: measurement of particle binding kinetics by chemiluminescence. Proceedings of the National Academy of Sciences of the United States of America. 91 (12), 5426-5430 (1994).
- Wigle, T. J., et al. Screening for inhibitors of low-affinity epigenetic peptide-protein interactions: an AlphaScreen-based assay for antagonists of methyl-lysine binding proteins. Journal of Biomolecular Screening. 15 (1), 62-71 (2010).
- Guenat, S., et al. Homogeneous and nonradioactive high-throughput screening platform for the characterization of kinase inhibitors in cell lysates. Journal of Biomolecular Screening. 11 (8), 1015-1026 (2006).
- Sabatucci, A., et al. A new methodological approach for in vitro determination of the role of DNA methylation on transcription factor binding using AlphaScreen(R) analysis: Focus on CREB1 binding at hBDNF promoter IV. Journal of Neuroscience Methods. 341, 108720 (2020).
- Mills, N. L., Shelat, A. A., Guy, R. K. Assay Optimization and Screening of RNA-Protein Interactions by AlphaScreen. Journal of Biomolecular Screening. 12 (7), 946-955 (2007).
- Huang, X., et al. A competitive alphascreen assay for detection of hyaluronan. Glycobiology. 28 (3), 137-147 (2018).
- Principles of alphascreen amplified luinescent proximmity homogenous assay. PerkinElmer Life Sciences Available from: https://www.perkinelmer.com/lab-solutions/resources/docs/APP_AlphaScreen_Principles.pdf (2021)
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).

