Fabricage en gebruik van droge macroporeuze alginaatsteigers voor virale transductie van T-cellen
Summary
Hierin is een protocol voor het maken van droge macroporeuze alginaatsteigers die efficiënte virale genoverdracht bemiddelen voor gebruik bij genetische manipulatie van T-cellen, inclusief T-cellen voor CAR-T-celtherapie. De scaffolds bleken geactiveerde primaire T-cellen te transduceren met >85% transductie.
Abstract
Genetische manipulatie van T-cellen voor CAR-T-celtherapie is de afgelopen jaren op de voorgrond van de behandeling van kanker gekomen. CAR-T-cellen worden geproduceerd door virale genoverdracht naar T-cellen. De huidige gouden standaard van virale genoverdracht omvat spinoculatie van retronectine-gecoate platen, wat duur en tijdrovend is. Er is een aanzienlijke behoefte aan efficiënte en kosteneffectieve methoden om CAR-T-cellen te genereren. Hier beschreven is een methode voor het fabriceren van goedkope, droge macroporeuze alginaatsteigers, bekend als Drydux-steigers, die efficiënt virale transductie van geactiveerde T-cellen bevorderen. De steigers zijn ontworpen om te worden gebruikt in plaats van gouden standaard spinoculatie van retronectine-gecoate platen bezaaid met virus en vereenvoudigen het proces voor het transduceren van cellen. Alginaat wordt verknoopt met calcium-D-gluconaat en ‘s nachts ingevroren om de steigers te creëren. De bevroren steigers worden gedurende 72 uur gevriesdroogd in een lyofilisator om de vorming van de droge macroporeuze steigers te voltooien. De scaffolds bemiddelen virale genoverdracht wanneer virus- en geactiveerde T-cellen samen bovenop de steiger worden gezaaid om genetisch gemodificeerde cellen te produceren. De steigers produceren >85% primaire T-celtransductie, wat vergelijkbaar is met de transductie-efficiëntie van spinoculatie op retronectine-gecoate platen. Deze resultaten tonen aan dat droge macroporeuze alginaatsteigers dienen als een goedkoper en handiger alternatief voor de conventionele transductiemethode.
Introduction
Immunotherapie is naar voren gekomen als een revolutionair paradigma voor de behandeling van kanker vanwege het vermogen om zich specifiek op tumoren te richten, off-target cytotoxiciteit te beperken en terugval te voorkomen. Met name chimere antigeenreceptor T (CAR-T) celtherapie heeft aan populariteit gewonnen vanwege het succes bij de behandeling van lymfomen en leukemieën. De FDA keurde de eerste CAR-T-celtherapie in 2017 goed en heeft sindsdien nog vier CAR-T-celtherapieëngoedgekeurd 1,2,3,4,5. CARs hebben een antigeenherkenningsdomein dat meestal bestaat uit een enkelketenvariabel fragment van een monoklonaal antilichaam dat specifiek is voor een tumorgeengeassocieerd antigeen 3,4. Wanneer een CAR interageert met zijn tumor-geassocieerde antigeen, worden de CAR-T-cellen geactiveerd, wat leidt tot een antitumorrespons met cytokine-afgifte, cytolytische degranulatie, transcriptiefactorexpressie en T-celproliferatie. Om CAR-T-cellen te produceren, wordt bloed verzameld van de patiënt om hun T-cellen te verkrijgen. CARs worden genetisch toegevoegd aan de T-cellen van de patiënt met behulp van een virus. De CAR-T-cellen worden in vitro gekweekt en terug toegediend aan patiënt 2,3,4,6. Succesvolle generatie van CAR-T-cellen wordt bepaald door de transductie-efficiëntie, die het aantal T-cellen beschrijft dat genetisch is gemodificeerd tot CAR-T-cellen.
Momenteel is de gouden standaard voor CAR-T-celgeneratie spinoculatie van geactiveerde T-cellen en virus op retronectine-gecoate platen 7,8. Transductie begint wanneer virale deeltjes zich bezighouden met het oppervlak van de T-cellen. Retronectine bevordert de colocalisatie van virus en cellen door de bindingsefficiëntie tussen de virale deeltjes en de cellen te verhogen, waardoor de transductie wordt verbeterd 7,8. Retronectine werkt op zichzelf niet goed en moet gepaard gaan met spinoculatie, wat de genoverdracht verbetert door de virale deeltjes te concentreren en de oppervlaktedoorlaatbaarheid van de T-cel te vergroten, waardoor virale infectie gemakkelijkerwordt 8. Ondanks het succes van spinoculatie op retronectine-gecoate platen, is het een complex proces dat meerdere spincycli en dure reagentia vereist. Daarom zijn alternatieve methoden voor virale genoverdracht die sneller en goedkoper zijn, zeer wenselijk.
Alginaat is een natuurlijke anionische polysaccharide die op grote schaal wordt gebruikt in de biomedische industrie vanwege de lage kosten, het goede veiligheidsprofiel en het vermogen om hydrogels te vormen bij het mengen met tweewaardige kationen 9,10,11,12. Alginaat is een GMP-conform polymeer en wordt algemeen erkend als veilig (GRAS) door de FDA13. Cross-linking alginaat met kationen creëert stabiele hydrogels die vaak worden gebruikt bij wondgenezing, levering van kleine chemische geneesmiddelen en eiwitten en celtransport 9,10,11,12,14,15,16. Vanwege de uitstekende geleereigenschappen is alginaat het voorkeursmateriaal om poreuze steigers te creëren door10,17 te vriesdrogen. Deze kenmerken van alginaat maken het een aantrekkelijke kandidaat voor het produceren van een steiger die virale genoverdracht van geactiveerde cellen kan bemiddelen.
Hier beschreven is een protocol voor het maken van droge macroporeuze alginaatsteigers, bekend als Drydux-steigers, die T-cellen statisch transduceren door virale genoverdracht17,18. Het proces voor het maken van deze steigers is weergegeven in figuur 1. Deze steigers elimineren de noodzaak van spinoculatie van retronectine-gecoate platen. De macroporeuze alginaatsteigers moedigen de interactie van virale deeltjes en T-cellen aan om efficiënte genoverdracht in één stap mogelijk te maken zonder de functionaliteit en levensvatbaarheid van de gemanipuleerde T-cellen te beïnvloeden17. Indien correct gevolgd, hebben deze macroporeuze alginaatsteigers een transductie-efficiëntie van ten minste 80%, waardoor het virale transductieproces wordt vereenvoudigd en verkort.
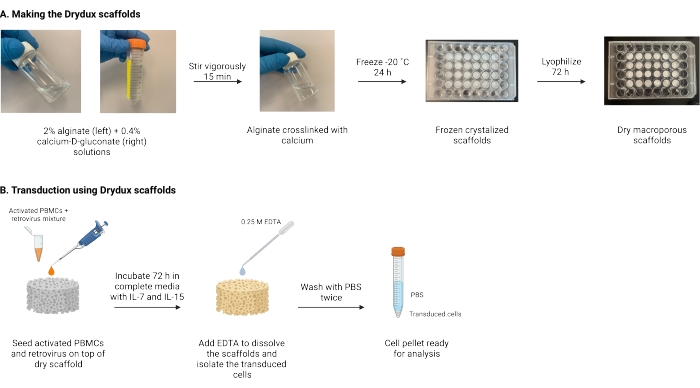
Figuur 1: Schema en tijdlijn van het protocol. (A) Tijdlijn voor het maken van de droge macroporeuze alginaatsteigers. Alginaat is verknoopt met calcium-D-gluconaat en wordt ‘s nachts ingevroren. De bevroren steigers worden gedurende 72 uur gelyofiliseerd om de Drydux-steigers te creëren. (B) Tijdlijn voor virale transductie van geactiveerde cellen. Geactiveerde cellen en virussen (MOI 2) worden bovenop de steiger gezaaid en geïncubeerd in volledige media aangevuld met IL-7 en IL-15. De steigers absorberen het mengsel en bevorderen de virale genoverdracht. EDTA wordt gebruikt om de steigers op te lossen en de getransduceerde cellen te isoleren. Na twee keer wassen met PBS kan de celpellet worden gebruikt voor analyse. Afkortingen: PBS = fosfaat-gebufferde zoutoplossing; PBMC’s = perifere mononucleaire bloedcellen. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
CAR-T-celtherapie blijft interesse wekken voor zowel onderzoek als commerciële toepassingen. Ondanks het succes dat CAR-T-celtherapie heeft gehad bij de behandeling van bloedkankers, beperken de hoge kosten van de procedure het gebruik ervan. Het hier gepresenteerde protocol introduceert een nieuwe methode voor virale genoverdracht van T-cellen zonder de noodzaak van spinoculatie van retronectine-gecoate platen. Het produceren van droge macroporeuze alginaatsteigers om transductie te bemiddelen is relatief eenvoudig en …
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door de National Institutes of Health via Grant Award Numbers R37-CA260223, R21CA246414. We danken de NCSU flowcytometriekern voor training en begeleiding bij flowcytometrie-analyse. Schema’s zijn gemaakt met Biorender.com
Materials
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | – | – | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | – | – | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | – | – | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | – | – | 1 x 106 TU/mL |
Referenzen
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O’Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 – Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).

