Изготовление и использование сухих макропористых альгинатных каркасов для вирусной трансдукции Т-клеток
Summary
Здесь представлен протокол для создания сухих макропористых альгинатных каркасов, которые опосредуют эффективный перенос вирусных генов для использования в генной инженерии Т-клеток, включая Т-клетки для терапии CAR-T-клетками. Было показано, что каркасы трансдуцируют активированные первичные Т-клетки с трансдукцией >85%.
Abstract
Генная инженерия Т-клеток для терапии CAR-T-клетками вышла на передний план лечения рака за последние несколько лет. CAR-T-клетки продуцируются путем переноса вирусных генов в Т-клетки. Нынешний золотой стандарт переноса вирусных генов включает в себя спинокуляцию пластин с ретронектиновым покрытием, что является дорогостоящим и трудоемким. Существует значительная потребность в эффективных и экономичных методах получения CAR-T-клеток. Здесь описан метод изготовления недорогих, сухих макропористых альгинатных каркасов, известных как каркасы Drydux, которые эффективно способствуют вирусной трансдукции активированных Т-клеток. Каркасы предназначены для использования вместо золотого стандарта спинокуляции пластин с ретронектиновым покрытием, засеянных вирусом, и упрощают процесс преобразования клеток. Альгинат сшивается с кальцием-D-глюконатом и замораживается на ночь для создания каркасов. Замороженные каркасы лиофилизируют в лиофилизаторе в течение 72 ч, чтобы завершить формирование сухих макропористых каркасов. Каркасы опосредуют перенос вирусных генов, когда вирусные и активированные Т-клетки сеются вместе поверх каркаса для производства генетически модифицированных клеток. Каркасы производят >85% первичной трансдукции Т-клеток, что сопоставимо с эффективностью трансдукции спинокуляции на пластинах, покрытых ретронектином. Эти результаты демонстрируют, что сухие макропористые альгинатные каркасы служат более дешевой и удобной альтернативой традиционному методу трансдукции.
Introduction
Иммунотерапия стала революционной парадигмой лечения рака из-за ее способности специфически нацеливаться на опухоли, ограничивать нецелевую цитотоксичность и предотвращать рецидив. В частности, клеточная терапия химерным антигенным рецептором Т (CAR-T) приобрела популярность благодаря ее успеху в лечении лимфом и лейкемий. FDA одобрило первую терапию CAR-T-клетками в 2017 году, и с тех пор одобрило еще четыре CAR-T клеточныетерапии 1,2,3,4,5. CARs имеют домен распознавания антигена, обычно состоящий из одного цепного переменного фрагмента моноклонального антитела, который является специфическим для опухолевого ассоциированного антигена 3,4. Когда CAR взаимодействует со своим опухолеассоциированным антигеном, CAR-T-клетки активируются, что приводит к противоопухолевому ответу, включающему высвобождение цитокинов, цитолитическую дегрануляцию, экспрессию фактора транскрипции и пролиферацию Т-клеток. Для производства CAR-T-клеток кровь собирается у пациента для получения их Т-клеток. CARs генетически добавляются к Т-клеткам пациента с помощью вируса. CAR-T-клетки выращивают in vitro и вводят обратно пациенту 2,3,4,6. Успешная генерация CAR-T-клеток определяется эффективностью трансдукции, которая описывает количество Т-клеток, которые генетически модифицированы в CAR-T-клетки.
В настоящее время золотым стандартом генерации CAR-T-клеток является спинокуляция активированных Т-клеток и вируса на пластинахс ретронектиновым покрытием 7,8. Трансдукция начинается, когда вирусные частицы взаимодействуют с поверхностью Т-клеток. Ретронектин способствует колокализации вируса и клеток за счет повышения эффективности связывания между вирусными частицами и клетками, усиливая трансдукцию 7,8. Ретронектин плохо работает сам по себе и должен сопровождаться спинокуляцией, которая усиливает перенос генов путем концентрации вирусных частиц и увеличения поверхностной проницаемости Т-клеток, что облегчает вирусную инфекцию8. Несмотря на успех спинокуляции на пластинах с ретронектиновым покрытием, это сложный процесс, который требует нескольких циклов вращения и дорогостоящих реагентов. Поэтому альтернативные методы переноса вирусных генов, которые являются более быстрыми и дешевыми, очень желательны.
Альгинат является природным анионным полисахаридом, широко используемым в биомедицинской промышленности из-за его низкой стоимости, хорошего профиля безопасности и способности образовывать гидрогели при смешивании с двухвалентными катионами 9,10,11,12. Альгинат является GMP-совместимым полимером и в целом признан безопасным (GRAS) FDA13. Сшивание альгината с катионами создает стабильные гидрогели, часто используемые для заживления ран, доставки небольших химических препаратов и белков и транспортировки клеток 9,10,11,12,14,15,16. Благодаря своим превосходным гелеобразующим свойствам, альгинат является предпочтительным материалом для создания пористых каркасов путем сублимационной сушки10,17. Эти характеристики альгината делают его привлекательным кандидатом для производства каркаса, который может опосредуть перенос вирусных генов активированных клеток.
Здесь описан протокол для создания сухих макропористых альгинатных каркасов, известных как каркасы Drydux, которые статически трансдуцируют Т-клетки путем переноса вирусных генов17,18. Процесс изготовления этих каркасов показан на рисунке 1. Эти каркасы устраняют необходимость в спинокуляции пластин с ретронектиновым покрытием. Макропористые альгинатные каркасы стимулируют взаимодействие вирусных частиц и Т-клеток, чтобы обеспечить эффективный перенос генов за один этап, не влияя на функциональность и жизнеспособность инженерных Т-клеток17. При правильном следовании эти макропористые альгинатные каркасы имеют эффективность трансдукции не менее 80%, упрощая и укорачивая процесс вирусной трансдукции.
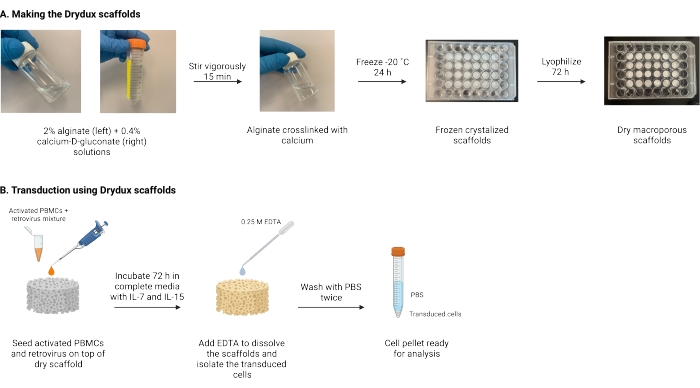
Рисунок 1: Схема и временная шкала протокола. (A) Временная шкала для создания сухих макропористых альгинатных каркасов. Альгинат сшивается с кальцием-D-глюконатом и замораживается на ночь. Замороженные каркасы лиофилизируются в течение 72 ч, чтобы создать каркасы Drydux. (B) Временная шкала для вирусной трансдукции активированных клеток. Активированные клетки и вирус (MOI 2) высеивают поверх каркаса и инкубируют в полной среде, дополненной IL-7 и IL-15. Каркасы поглощают смесь и способствуют переносу вирусных генов. ЭДТА используется для растворения каркасов и изоляции трансдуцированных клеток. После двойной промывки PBS гранулу ячейки можно использовать для анализа. Сокращения: PBS = фосфатно-буферный физиологический раствор; PBMCs = мононуклеарные клетки периферической крови. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
CAR-T-клеточная терапия продолжает вызывать интерес как для исследований, так и для коммерческих применений. Несмотря на успех CAR-T-клеточной терапии в лечении рака крови, высокая стоимость процедуры ограничивает ее использование. Представленный здесь протокол вводит новый метод перенос…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержана Национальными институтами здравоохранения через номера грантов R37-CA260223, R21CA246414. Мы благодарим ядро проточной цитометрии NCSU за обучение и руководство по анализу проточной цитометрии. Схемы были созданы с помощью Biorender.com
Materials
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | – | – | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | – | – | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | – | – | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | – | – | 1 x 106 TU/mL |
Referenzen
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O’Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 – Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).

