在微RNA在腹鸡中脑大毛表达
Summary
异位表达的是一种技术来阐明大脑发育的小分子RNA的作用。但是,使用在OVO电针对特定领域是具有挑战性的。这里,我们表明一个有效的方式来选择性电穿孔腹侧和背侧中脑区域。
Abstract
非编码RNA是另外玩家在调节基因表达。针对在特定领域OVO电提供了空间和时间的控制异位microRNA表达谱的独特工具。不过,腹脑结构,如中脑腹侧是相当难以达成任何操作。在这里,我们展示了使用薄的铂电极电穿孔的miRNA进入中脑腹侧一种有效的方式。这种方法提供了一种可靠的方法转染中脑和体内研究的有用工具的特定区域。
Introduction
小非编码RNA作为额外的球员基因表达的识别推出了新的复杂的基因组编程/基因调控。不同品种的非编码RNA在神经细胞,包括非编码小分子RNA 1-4功能的重要性。小分子RNA(MIR或miRNA)为例说明在开发大脑5个不同的和不断变化的表达谱。有针对性的鸡胚蛋内电穿孔提供了开发过程中的基因表达和沉默的时间和空间控制一个独特的机会。
本视频演示了不同的步骤,使用在OVO电6-10在鸡脑的特定区域进行miR的异位表达。为了确保在这些细胞中的小非编码RNA的效果持久,miR的DNA序列克隆到单或双顺反子载体。 在OVO电中,miR含v厄克托基是通过使一个小窗口,在蛋壳后露出的胚胎注入到中脑的神经管。转染的脑小加(阳极)和减号(阴极)的特定区域的铂电极被放置在特定的位置上。对于腹侧中脑的转染,所述阳极被置于左侧中脑腹侧和上面的中脑的右半边的阴极施加电流前下方。在蛋壳的开口被封闭,磁带和胚胎孵育只要所需的任何分析。该方法最初是由村松等 6所描述和特定区域的转染改善了由百濑等 8。
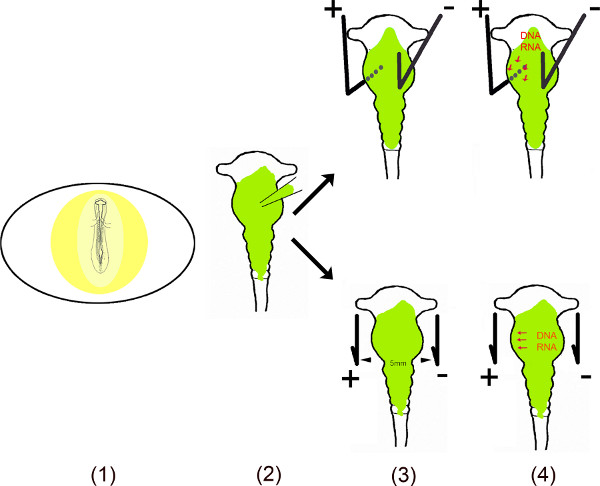
原理概述。
- 在鸡蛋胚胎是通过切割一个小窗口,进入次曝光Ë蛋壳。
- 溶解的载体(s)是注入到使用微毛细管中脑。
- 两个电极 – 平行放置,或根据与上面的胚胎 – 产生一个脉冲电场。
- 电场在时间上产生毛孔中的细胞膜,从而促进进入细胞由带负电荷的DNA(或RNA)被吸引到阳极11,12。
Protocol
Representative Results
Discussion
该视频演示了转染质粒转化的小鸡脑的特定区域的神经上皮细胞的有效方法。低电压的矩形电脉冲可以将DNA引入小鸡神经管细胞大毛 6,16。但是,DNA的定位精度由宽电场,其上升通过比较大的电极(Φ= 0.5mm)的经常受阻。我们试图通过下面的百濑等 8的指引,使用电极直径小,以解决这个问题。对于腹侧中脑转染,我们将阴极区带蛋白或膜下如果胚胎的年龄允许它正?…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
我们承认K.米基克,谁促成了这部电影和M.尼古列斯库为的miR图片的初始阶段。 C.胡贝尔是由Universtitätsklinikum蒂宾根大学的IZKF,A.奥威炳廷阿南德由Universtitätsklinikum图宾根的财富计划的奖学金支持。
Materials
| Name | Company | Model | |
| Borosillicate glass capillaries | Hartenstein | Model: 0.9 mm | |
| Microcapillary puller | WPI, Berlin | Model: Pul1-E | |
| Electroporator | Intracel | Model: TSSIC | |
| Stereomicroscope – fluorescence | LEICA | Model: MZFLIII | |
| Stereomicroscope | Zeiss | Model: Stemi | |
| Camera and software | Zeiss | Model: Axiocam MRc/ Axiovision Re. 4.8 |
Referencias
- Kutter, C., Svoboda, P. miRNA, siRNA, piRNA: Knowns of the unknown. RNA Biol. 5, 181-188 (2008).
- Szell, M., Bata-Csorgo, Z., Kemeny, L. The enigmatic world of mRNA-like ncRNAs: their role in human evolution and in human diseases. Semin. Cancer Biol. 18, 141-148 (2008).
- Li, X., Jin, P. Roles of small regulatory RNAs in determining neuronal identity. Nature reviews. Neuroscience. 11, 329-338 (2010).
- Riedmann, L. T., Schwentner, R. miRNA, siRNA, piRNA and argonautes: news in small matters. RNA Biol. 7, 133-139 (2010).
- Coolen, M., Bally-Cuif, L. MicroRNAs in brain development and physiology. Curr. Opin. Neurobiol. 19, 461-470 (2009).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochem. Biophys. Res. Commun. 230, 376-380 (1997).
- Itasaki, N., Bel-Vialar, S., Krumlauf, R. Shocking’ developments in chick embryology: electroporation and in ovo gene expression. Nat. Cell Biol. 1, 203-207 (1999).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Dev. Growth Differ. 41, 335-344 (1999).
- Nakamura, H., Watanabe, Y. Misexpression of genes in brain vesicles by in ovo electroporation. Dev. Growth Differ. 42, 199-201 (2000).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nat. Protoc. 3, 419-426 (2008).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Gene Hofschneider, P. H. transfer into mouse lyoma cells by electroporation in high electric fields. The EMBO journal. 1, 841-845 (1982).
- Potter, H., Weir, L., Leder, P. Enhancer-dependent expression of human kappa immunoglobulin genes introduced into mouse pre-B lymphocytes by electroporation. Proceedings of the National Academy of Sciences of the United States of America. 81, 7161-7165 (1984).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Dev. Dyn. 229, 433-439 (2004).
- Canto-Soler, M. V., Adler, R. Optic cup and lens development requires Pax6 expression in the early optic vesicle during a narrow time window. Developmental biology. , 294-2119 (2006).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev Dyn. 195, 231-272 (1992).
- Muramatsu, T., Nakamura, A., Park, H. M. In vivo electroporation: a powerful and convenient means of nonviral gene transfer to tissues of living animals (Review). Int J Mol Med. 1, 55-62 (1998).
- Agoston, Z., Li, N., Haslinger, A., Wizenmann, A., Schulte, D. Genetic and physical interaction of Meis2, Pax3 and Pax7 during dorsal midbrain development. BMC Dev Biol. 12, 10 (2012).
- De Pietri Tonelli, D., et al. Single-cell detection of microRNAs in developing vertebrate embryos after acute administration of a dual-fluorescence reporter/sensor plasmid. Biotechniques. 41, 727-732 (2006).

