Em Expression in ovo de microRNA em Ventral Pintinho Midbrain
Summary
A expressão ectópica é uma técnica para elucidar o papel microRNAs no desenvolvimento do cérebro. No entanto, em áreas específicas usando a eletroporação in ovo é um desafio. Aqui, vamos mostrar uma maneira eficiente para regiões do mesencéfalo ventral e dorsal seletiva electroporate.
Abstract
RNAs não-codificantes são jogadores adicionais na regulação da expressão gênica. Alvejado em eletroporação in ovo de áreas específicas fornece uma ferramenta única para o controle espacial e temporal da expressão do microRNA ectópica. No entanto, as estruturas cerebrais ventral como mesencéfalo ventral são bastante difíceis de alcançar por quaisquer manipulações. Aqui, nós demonstramos uma forma eficiente de electroporate miRNA em mesencéfalo ventral utilizando eletrodos de platina finas. Este método oferece uma maneira confiável de transfecção de áreas específicas do cérebro médio e uma ferramenta útil para estudos in vivo.
Introduction
O reconhecimento de pequenos RNAs não-codificantes como jogadores adicionais para a expressão do gene de lançar uma nova complexidade à regulamentação de programação / gene do genoma. Diferentes espécies de RNAs não-codificantes tem importância funcional em células neurais, incluindo pequeno RNAs não-codificantes 1-4. MicroRNAs (MIR ou miRNA), por exemplo, mostram perfis de expressão distintas e mutáveis em cérebros em desenvolvimento 5. Alvejado em eletroporação in ovo de embriões de galinha oferece uma oportunidade única para o controle temporal e espacial da expressão gênica e silenciamento durante o desenvolvimento.
Este vídeo demonstra as diferentes etapas da realização de expressão ectópica da RIM em áreas específicas do mesencéfalo garota usando eletroporação in ovo 6-10. Para assegurar um efeito de longa duração destes pequenos RNAs não-codificantes nas células, a sequência de ADN de RIM, foram clonados em vectores de mono-ou bi-cistronic. Pois em eletroporação in ovo, miR contendo vector é injectado no tubo neural mesencéfalo expondo o embrião depois de fazer uma pequena janela na casca do ovo. Para transfectar as áreas específicas do cérebro médio mais pequeno (ânodo) e negativo (cátodo) eléctrodos de platina são colocados em posições específicas. Para a transfecção do mesencéfalo ventral, o ânodo é colocado por baixo do mesencéfalo ventral esquerdo e o cátodo acima da metade direita do cérebro médio, antes de aplicar uma corrente. A abertura na casca do ovo é fechado com fita adesiva e os embriões foram incubados durante o tempo necessário para qualquer análise. Este método foi originalmente descrito por Muramatsu et al. 6 e melhorado por Momose et al. 8 para transfecção área específica.
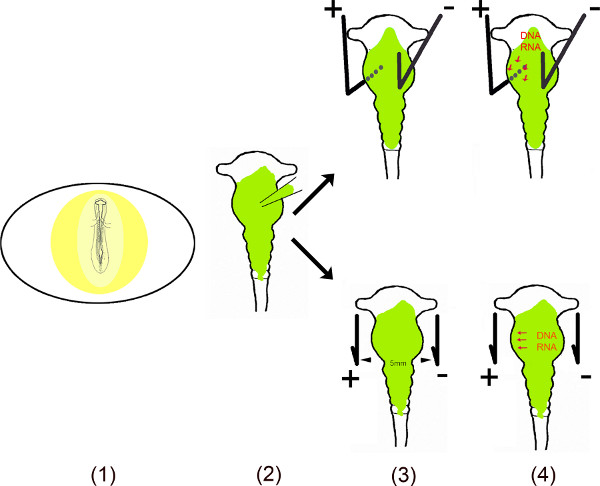
Visão esquemática.
- O embrião no ovo é exposta pelo corte de uma pequena janela em the casca de ovo.
- O vector dissolvido (s) é injectado no mesencéfalo usando um tubo capilar de micro.
- Dois eletrodos colocados – paralelo ou por baixo e por cima do embrião – gerar um campo elétrico pulsado.
- O campo eléctrico temporalmente cria poros na membrana da célula, que facilitam a entrada na célula de ADN carregadas negativamente (ou RNA) atraídos para o ânodo 11,12.
Protocol
Representative Results
Discussion
Este vídeo demonstra um método eficaz para transfectar plasmídeo nas células neuroepiteliais de áreas específicas do cérebro médio do pintainho. Pulsos elétricos retangulares de baixa tensão pode introduzir DNA em células do tubo neural garota em ovo 6,16. No entanto, a precisão da segmentação DNA é muitas vezes dificultada pela grande campo elétrico, que sobe através das relativamente grandes eletrodos (Φ = 0,5 mm). Nós tentamos resolver esse problema usando eletrodos menores em d…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Reconhecemos K. Mikic, que contribuiu para a fase inicial deste filme e M. Nicolescu para a imagem miR. C. Huber foi apoiado por uma bolsa da IZKF do Universtitätsklinikum Tübingen, A. Alwin Prem Anand pelo programa fortuna do Universtitätsklinikum Tübingen.
Materials
| Name | Company | Model | |
| Borosillicate glass capillaries | Hartenstein | Model: 0.9 mm | |
| Microcapillary puller | WPI, Berlin | Model: Pul1-E | |
| Electroporator | Intracel | Model: TSSIC | |
| Stereomicroscope – fluorescence | LEICA | Model: MZFLIII | |
| Stereomicroscope | Zeiss | Model: Stemi | |
| Camera and software | Zeiss | Model: Axiocam MRc/ Axiovision Re. 4.8 |
Referencias
- Kutter, C., Svoboda, P. miRNA, siRNA, piRNA: Knowns of the unknown. RNA Biol. 5, 181-188 (2008).
- Szell, M., Bata-Csorgo, Z., Kemeny, L. The enigmatic world of mRNA-like ncRNAs: their role in human evolution and in human diseases. Semin. Cancer Biol. 18, 141-148 (2008).
- Li, X., Jin, P. Roles of small regulatory RNAs in determining neuronal identity. Nature reviews. Neuroscience. 11, 329-338 (2010).
- Riedmann, L. T., Schwentner, R. miRNA, siRNA, piRNA and argonautes: news in small matters. RNA Biol. 7, 133-139 (2010).
- Coolen, M., Bally-Cuif, L. MicroRNAs in brain development and physiology. Curr. Opin. Neurobiol. 19, 461-470 (2009).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochem. Biophys. Res. Commun. 230, 376-380 (1997).
- Itasaki, N., Bel-Vialar, S., Krumlauf, R. Shocking’ developments in chick embryology: electroporation and in ovo gene expression. Nat. Cell Biol. 1, 203-207 (1999).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Dev. Growth Differ. 41, 335-344 (1999).
- Nakamura, H., Watanabe, Y. Misexpression of genes in brain vesicles by in ovo electroporation. Dev. Growth Differ. 42, 199-201 (2000).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nat. Protoc. 3, 419-426 (2008).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Gene Hofschneider, P. H. transfer into mouse lyoma cells by electroporation in high electric fields. The EMBO journal. 1, 841-845 (1982).
- Potter, H., Weir, L., Leder, P. Enhancer-dependent expression of human kappa immunoglobulin genes introduced into mouse pre-B lymphocytes by electroporation. Proceedings of the National Academy of Sciences of the United States of America. 81, 7161-7165 (1984).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Dev. Dyn. 229, 433-439 (2004).
- Canto-Soler, M. V., Adler, R. Optic cup and lens development requires Pax6 expression in the early optic vesicle during a narrow time window. Developmental biology. , 294-2119 (2006).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev Dyn. 195, 231-272 (1992).
- Muramatsu, T., Nakamura, A., Park, H. M. In vivo electroporation: a powerful and convenient means of nonviral gene transfer to tissues of living animals (Review). Int J Mol Med. 1, 55-62 (1998).
- Agoston, Z., Li, N., Haslinger, A., Wizenmann, A., Schulte, D. Genetic and physical interaction of Meis2, Pax3 and Pax7 during dorsal midbrain development. BMC Dev Biol. 12, 10 (2012).
- De Pietri Tonelli, D., et al. Single-cell detection of microRNAs in developing vertebrate embryos after acute administration of a dual-fluorescence reporter/sensor plasmid. Biotechniques. 41, 727-732 (2006).

