Konfokale Mikroskopie zeigt Zelle Oberfläche Rezeptor Aggregation über Bild Korrelation Spektroskopie
Summary
Antikörper, die Ziel-Rezeptoren auf der Zelloberfläche binden können Konformation und clustering Veränderungen verleihen. Diese dynamischen Veränderungen haben Auswirkungen für die Charakterisierung von Arzneimittelentwicklung in Zielzellen. Dieses Protokoll nutzt konfokalen Mikroskopie und Bild Korrelation Spektroskopie durch ImageJ/Fidschi, das Ausmaß des Rezeptors auf der Zelloberfläche clustering zu quantifizieren.
Abstract
Konfokale Mikroskopie bietet eine zugängliche Methode zur subzelluläre Interaktionen entscheidend für die Charakterisierung und Weiterentwicklung der präklinischen Agenten beschriftet mit fluoreszierenden Sonden zu erfassen. Mit neuen Zuführungen in Antikörper-basierte zytotoxischen Droge ist Trägersysteme, Verständnis der Veränderungen induziert durch diese Mittel im Bereich der Rezeptor-Aggregation und Internalisierung von entscheidender Bedeutung. Dieses Protokoll nutzt die etablierten Verfahren der fluoreszierenden Immunocytochemistry und die open-Source Fidschi Verteilung von ImageJ, mit seinen eingebauten Autokorrelation und Bild mathematische Funktionen, räumliche Bildkorrelation durchführen Spektroskopie (ICS). Dieses Protokoll quantitates die fluoreszente Intensität der beschrifteten Rezeptoren als Funktion des Gebiets Strahl confocal Mikroskop. Dies bietet ein quantitatives Maß für den Zustand der Ziel-Molekül Aggregation auf der Zelloberfläche. Diese Methode konzentriert sich auf die Charakterisierung der statischen Zellen mit Potenzial in zeitlichen Untersuchungen der Rezeptor Aggregation zu expandieren. Dieses Protokoll stellt eine zugänglich Methode zur Quantifizierung der clustering-Ereignisse an der Zelloberfläche gut nutzen Techniken und nicht-spezialisierten bildgebenden Geräte eingerichtet bieten.
Introduction
Die Entwicklung von therapeutischen Antikörpern hat bemerkenswerte Erfolge bei der Behandlung von mehreren Tumor Arten1gezeigt. Die jüngsten Fortschritte der Antikörper-Wirkstoff-Konjugate (ADC) Oberfläche als Bereitstellungsmechanismen für Zytotoxische Substanzen erweitert die Anforderungen für das Verständnis der Dynamik der Antikörper: Rezeptor-Wechselwirkungen auf der Zelle2. Im Anschluss an die erfolgreiche Ausrichtung eines Antikörpers an die Zelle Oberfläche Rezeptor können diese komplexe ähnliche Aggregation Muster bei Ligand: Antikörper Interaktionen3induzieren. Veränderungen im Rezeptor Aggregation können Änderungen an der Membran und führen die Internalisierung der Rezeptor und seine Entfernung von der Zelloberfläche induzieren. Im Rahmen einer Antikörper-Wirkstoff-Konjugate löst dabei anschließend die zytotoxische Nutzlast in verinnerlichten Endosomen und anschließend das Zytoplasma, wodurch effektive Zelle Tötung.
Konfokale Mikroskopie hat ein wirksames Mittel zur Visualisierung dieser wichtigen Wechselwirkungen von Antikörpern und ihre Ziel-Rezeptoren4zur Verfügung gestellt. Um die Änderungen der Aggregation des Zielmoleküls an der Zelloberfläche erkunden nutzt dieses Protokoll Nachbearbeitung der konfokalen Mikroskopie Bilder über ein räumliches Bild Korrelation Spektroskopie (ICS) Technik 5,6,7 .
Die Stiftung der Bild Korrelation Spektroskopie ist die Beobachtung, dass räumliche Fluoreszenz intensitätsschwankungen eine Beziehung in der Dichte und Aggregation Zustand der beschrifteten Strukturen teilen. Diese Beziehung wird nach der Berechnung einer räumlichen Autokorrelation Funktion eines aufgenommenen Bildes5hergestellt.
Alle Varianten des Bildes Korrelation Spektroskopie erfordern die Berechnung der Autokorrelation ein Bild. Danach erfolgt durch den Einbau dieser Funktion zu einer zweidimensionalen Gaußschen Kurve für die Extraktion von quantitativen Aggregation Zustandsparameter innerhalb des Abbilds. In einfachen Worten die Berechnung eines Bildes Autokorrelation erfolgt ein Vergleich alle Paare möglich Pixel innerhalb eines Abbilds und Berechnung der Wahrscheinlichkeit, dass beide gleich hell wie jeder andere. Dies wird als eine Funktion des Abstandes und Richtungen der Pixel Trennung8visualisiert.
Der theoretische Rahmen für das Bild Korrelation Spektroskopie gegründet und von Petersen und Wiseman Et al.definiert. 5 , 6. in diesem Protokoll sind die Autokorrelation Berechnungen in Fidschi/ImageJ sowie einem Tabellenkalkulationsprogramm, die Grundlage für die Intensität Fluktuation räumliche Autokorrelationsfunktion kann als (Eq 1)beschrieben werden:
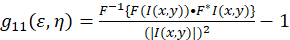
wobei F die Fourier-Transformation darstellt; F−1 die Inverse Fourier transformieren; F * seine konjugiert Komplex; und die räumlichen Sträfling Variablen ε und η. In räumlichen ICS kann wie in diesem Protokoll beschrieben die Autokorrelationsfunktion berechnet werden mit einer 2D schnelle Fourier-Transformation Algorithmus7,9. Die Autokorrelation bei Null räumliche Trennung bekannt als NULL-Verzögerung, g11(0,0), bietet die inverse mittlere Anzahl von Partikeln pro Strahl Bereich des Mikroskops. Es kann durch den Einbau der räumlichen Autokorrelationsfunktion auf eine zweidimensionale Gaußsche Funktion (Eq 2)bezogen werden:
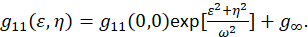
Da die Pixel in einem Bild erfasst innerhalb eines festgelegten Bereichs enthalten sind und diese Messungen nicht bis ins Unendliche zu verlängern, wird der Begriff G∞ als Offset verwendet, um Langstrecken räumliche Zusammenhänge innerhalb des Abbilds zu berücksichtigen. Für Molekulare Größe Aggregate ω ist die Point-Spread Funktion des Mikroskops und durch die durchgehenden Hälfte-höchstens der räumlichen Autokorrelationsfunktion beschrieben. Der Bereich innerhalb der Point-spread-Funktion des Gerätes kann durch den Einsatz von Sub-Auflösung fluoreszierenden Perlen kalibriert werden.
Für das Bild Korrelation Spektroskopie Protokoll beschriebenen Autokorrelation und mathematische Funktionen erforderlich, um ICS zu vervollständigen erfolgt über das Open-Source-Imaging-Verarbeitung-Plattform, Fidschi10, eine Verteilung der ImageJ Programm11,12. Fiji/ImageJ nutzt die vorinstallierte schnelle Fourier-Transformation in das FFT mathematische Funktion. Diese Funktion reduziert die Rechenzeit benötigt dieser Berechnung durch die Reduzierung der Datenbereich um einen Faktor von zwei in jeder Dimension13. Wie die 2D Autokorrelationsfunktion ungefähr symmetrisch in X, y-Achse, ist kann ein einzelnes Profil Liniendiagramm durch Autokorrelation Bild verwendet werden, um die rohen Autokorrelation in Abhängigkeit von der räumlichen Lag zu messen. NULL-Verzögerung Lärm wird vor weiteren Berechnung, mit der sich daraus ergebenden Autokorrelation Amplitude (Spitzenwert, g(0)T) korrigiert für den Hintergrund mit dem Ausdruck (Eq 3)entfernt:
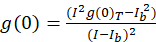
wo ichb ist die mittlere Intensität aus einer Hintergrund-Region mit Ausnahme der Zelle. Die Cluster-Dichte oder Dichte von fluoreszierenden Objekten wird durch (Eq 4)definiert:
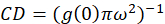
In dem hier beschriebenen Protokoll fördern wir einfach die Berechnung der Dichte Cluster (CD), unter der Annahme, basierend auf der Beobachtung, die einer normierten Autokorrelationsfunktion auf einen Wert nähert sich 1.0 mit zunehmender räumlicher Verzögerung zerfallen wird. Mit maximale räumliche Lag, gibt es nicht mehr eine Korrelation der Fluoreszenz Intensitätswerte und somit ohne eine Korrelation sind die Berechnungen in dieser Region computing den Wert einer Intensität multipliziert mit dieser Intensität, die anschließend durch geteilt wird die Quadrat der, dass die Intensität, die definitionsgemäß 1,0 entspricht. Cluster-Dichte von einem normierten Autokorrelationsfunktion kann so berechnet werden, durch Subtraktion 1.0 von der normierten Autokorrelationsfunktion vor der Einnahme ihren gegenseitigen (Eq-5):
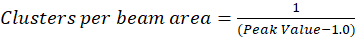
Weitere Kalibrierung des Bereichs Strahl kann durchgeführt werden, um die Anzahl der Cluster im Bereich der Point-spread-Funktion des Gerätes enthalten quantitate. Diese Kalibrierung muß mit den gleichen optischen Bedingungen während der Bildanalyse Korrelation Spektroskopie verwendet durchgeführt werden.
Protocol
Representative Results
Discussion
Die Technik des Bildes Korrelation Spektroskopie (ICS), die wir in diesem Protokoll zu beschreiben verwendet standard konfokale Mikroskope ohne die Notwendigkeit für spezielle Detektoren. Die beschriebene ICS-Technik nutzt etablierte Immunocytochemistry Methoden für schnelle Probenahme von mehreren Behandlungsbedingungen für erhöhte statistische Analysen zu. Diese Methodik tut dies mit einem leichten Rückgang der absoluten Präzision im Vergleich zu alternativen Einzelmolekül-Techniken basierend auf Korrelation der…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Die Autoren erkennen finanzielle Unterstützung von NHMRC (Fellowship 1084178 und Zuschüsse 1087850, 1030469, 1075898 (AMS)), Krebs Australien, Ludwig Cancer Research, John Reid T vertraut, Heilung Brain Cancer Foundation, La Trobe University und der Victoria-Krebs-Agentur. Mitteln aus der operativen Infrastruktur Support-Programm von der Staatsregierung zur Verfügung gestellt, wird Australien auch anerkannt.
Materials
| Nunc Lab-Tek II Chambered Coverglass – 8 well | ThermoFisher Scientific | 155409 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 10099141 | |
| TrypLE Express Enzyme (1x), no phenol red | ThermoFisher Scientific | 12604021 | |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Goat anti-Human IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | ThermoFisher Scientific | A11013 | |
| TetraSpeck Fluorescent Microsphere Standards 0.1µm | ThermoFisher Scientific | T7279 | |
| Cetuximab | Merck Serono | 3023715501 | |
| Parafilm M 38mx100mm | Merck Millipore | BRND701605 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | ProSciTech | C004 | |
| Recombinant Human EGF | R&D System | 236-EG |
Referencias
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature reviews. Cancer. 12 (4), 278-287 (2012).
- Parslow, A. C., Parakh, S., Lee, F. -. T., Gan, H., Scott, A. Antibody-Drug Conjugates for Cancer Therapy. Biomedicines. 4 (3), 14 (2016).
- Sorkin, A., Waters, C. M. Endocytosis of growth factor receptors. BioEssays. 15 (6), 375-382 (1993).
- Pawley, J. . Handbook of Biological Confocal Microscopy. , (2006).
- Petersen, N. O., Höddelius, P. L., Wiseman, P. W., Seger, O., Magnusson, K. E. Quantitation of membrane receptor distributions by image correlation spectroscopy: concept and application. Biophysical Journal. 65 (3), 1135-1146 (1993).
- Wiseman, P. W., Petersen, N. O. Image Correlation Spectroscopy. II. Optimization for Ultrasensitive Detection of Preexisting Platelet-Derived Growth Factor-β Receptor Oligomers on Intact Cells. Biophysical Journal. 76 (2), 963-977 (1999).
- Costantino, S., Comeau, J. W. D., Kolin, D. L., Wiseman, P. W. Accuracy and Dynamic Range of Spatial Image Correlation and Cross-Correlation Spectroscopy. Biophysical Journal. 89 (2), 1251-1260 (2005).
- Claire Robertson, S. C. G. Theory and practical recommendations for autocorrelation-based image correlation spectroscopy. Journal of Biomedical Optics. 17 (8), 080801 (2012).
- Ciccotosto, G. D., Kozer, N., Chow, T. T. Y., Chon, J. W. M., Clayton, A. H. A. Aggregation Distributions on Cells Determined by Photobleaching Image Correlation Spectroscopy. Biophysical Journal. 104 (5), 1056-1064 (2013).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43 (1 Suppl), 25-30 (2007).
- Rappaz, B., Wiseman, P. W. Image correlation spectroscopy for measurements of particle densities and colocalization. Current protocols in cell biology. , (2013).
- tferr/Scripts: BAR 1.5.1. Zenodo Available from: https://zenodo.org/record/495245 (2017)
- Elson, E. L. Fluorescence Correlation Spectroscopy: Past, Present, Future. Biophysical Journal. 101 (12), 2855-2870 (2011).
- Jares-Erijman, E. A., Jovin, T. M. Imaging molecular interactions in living cells by FRET microscopy. Current opinion in chemical biology. 10 (5), 409-416 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-Resolution Fluorescence Microscopy. dx.doi.org.ez.library.latrobe.edu.au. 78 (1), 993-1016 (2009).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190 (2), 165-175 (2010).
- Nohe, A., Petersen, N. O. Image Correlation Spectroscopy. Sci. Signal. (417), pl7 (2007).

