共焦点顕微鏡を明らかに細胞表面受容体画像相関分光法による凝集
Summary
ターゲット細胞表面受容体に結合する抗体は、コンフォメーションとクラスタ リングの変化を与えることができます。これらの動的な変更には、標的細胞で医薬品開発を特徴付けるための含意があります。このプロトコルは、共焦点顕微鏡、細胞表面の受容体の程度を定量化する ImageJ/フィジーから画像相関分光法を利用しています。
Abstract
共焦点顕微鏡は、特性評価および蛍光プローブの付いた前臨床のエージェントの更なる発展の重要な細胞内の対話をキャプチャにアクセス可能な方法論を提供します。抗体による細胞毒性薬の最近の進歩と配信システム、受容体の集約と内面のレルム内でこれらの剤によって誘発された変化を理解することは非常に重要です。このプロトコルは蛍光免疫細胞化学の確立された方法論と作り付け自己相関とイメージ数学関数、空間イメージの相関を実行する ImageJ、オープン ソースのフィジー分布を活用します。分光 (ICS)。このプロトコルは、共焦点顕微鏡のビーム領域の関数としてラベル付けされた受容体の蛍光強度を quantitates します。これは細胞表面上のターゲット分子の凝集状態の定量的測定を提供します。この方法論は受容体集合の時間調査に拡大する可能性を持つ静的セルの特性評価に焦点を当てた。このプロトコルは、技術と非専門イメージング装置に確立よく利用した細胞表面で発生するイベントをクラスタ リングの定量化を提供するアクセス可能な方法論を提示します。
Introduction
抗体医薬の開発は、複数の腫瘍のタイプ1の治療で顕著な成功を示しています。抗体薬物複合体 (ADC) の最近の進歩、細胞毒性物質の配信メカニズムは、細胞での抗体: 受容体相互作用のダイナミクスを理解するための要件を拡大している2 を表面します。次の細胞表面受容体に対する抗体が成功したターゲット、これらの複合体はリガンド: 抗体の相互作用3で観察された同じような集計パターンを引き起こすことができます。受容体の凝集の変化が細胞表面から膜、受容体とその除去の内面化の結果への変更を誘発します。抗体薬物複合体においては、このプロセスはその後内面エンドソームとその後効果的な細胞の殺害の結果、細胞質に細胞毒性のペイロードを解放します。
共焦点顕微鏡は、抗体とそのターゲット受容体4のこれらの重要な相互作用を可視化する効果的な手段を提供しています。細胞表面のターゲット分子の集合の変更を検討するには、このプロトコル利用空間イメージ相関分光法 (ICS) テクニック5,6,7 を介して共焦点顕微鏡画像の後処理.
画像相関分光法の基礎は、空間の蛍光強度のゆらぎを共有ラベルの構造の密度と凝集状態に関係すること観察です。この関係を確立するには、次の画像5の空間的自己相関関数の計算。
画像相関分光法のすべての亜種は、画像相関の計算を必要とします。画像内に含まれる定量凝集状態パラメーターの抽出のための二次元ガウス曲線にはこの関数をフィッティングが続きます。簡単な言葉でイメージ自己相関の計算を含むすべての画像内に含まれる可能性を計算可能なピクセル ペアを比較する両方均等に互いのように明るい。これはピクセル分離8の方向と距離の関数として可視化します。
画像相関分光法の理論的枠組みは、ペーターゼンとワイズマンらによって定義および設立されました。5,6。 このプロトコルで自己相関計算はスプレッドシート アプリケーションと同様に、フィジー/ImageJ で行われます、 (式 1)として強度変動の空間的自己相関関数のための基礎を記述できます。
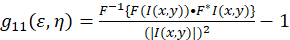
Fがフーリエ変換を表しますF− 1逆フーリエ変換;F *その複素共役;空間のラグ変数εとη。空間の ICS でこのプロトコルで説明するよう自己相関関数で計算できます 2次元高速フーリエ変換アルゴリズム7,9。ゼロ ゼロ遅延、 g11(0, 0) として知られている空間的な分離で自己相関は、粒子ビーム顕微鏡の面積あたりの逆の平均数を提供します。二次元ガウス関数(Eq 2)空間的自己相関関数のあてはめによる取得できます。
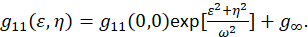
キャプチャ イメージ内のピクセルは設定エリア内で含まれているし、これらの測定値が無限大に拡張しない用語 g∞ は、イメージ内に含まれている長距離の空間相関を考慮してオフセットとして使用されます。分子サイズ集計、ω は顕微鏡の点広がり関数と空間的自己相関関数の最大値の半分で全角で記述。サブ解像度蛍光ビーズを使用して器械の点広がり関数内にある領域を適合できます。
記載画像相関分光法によるプロトコルの自己相関および ICS を完了するために必要な数学の関数を使用して実行、ImageJ の分布、フィジー10オープン ソース画像処理プラットフォームプログラム11,12。フィジー/ImageJ は、プレインストールされた高速フーリエ変換 FFT 数学関数を利用しています。この関数は、各寸法13の 2 つの要因によってデータの範囲を減らすことによってこの計算の計算時間を短縮します。2次元自己相関関数は x 軸と y 軸で対称で約自己相関イメージを介して一行プロフィール プロットは空間のラグの関数として生の自己相関を測定する使用できます。計算の前にさらに、自己相関振幅 (ピーク値、 g(0)T) と式(式 3)背景を補正したゼロ遅延物音が削除されます。
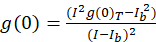
どこ私bはセルを除く背景領域からの平均強度。クラスター密度または蛍光物体の密度は、 (Eq 4)によって定義されます。
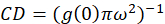
記載プロトコル値に近づいた空間の遅れに伴い 1.0 に正規化自己相関関数が崩壊観測に基づく仮定単にクラスター密度 (CD) の計算が更に。最大空間遅れで相関があるもはや蛍光の強度値とこうして相関なしこの地域で計算、この強度で割ってその後掛けた強度の値の計算、1.0 に等しくは、定義によって、その強度の正方形。したがって、正規化自己相関関数からクラスター密度はその相互(Eq 5)を撮影する前に正規化自己相関関数から 1.0 を減算することによって計算できます。
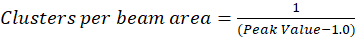
ビーム領域のさらなる校正は、計測器の点拡がり関数の領域内に含まれるクラスターの数を量的に実行できます。このキャリブレーションは、画像相関分光解析中に使用される同じ光の条件を使用して行われなければなりません。
Protocol
Representative Results
Discussion
このプロトコルで説明されている画像相関分光法 (ICS) の技術は、特殊な検出器を必要とせず標準的な共焦点顕微鏡を使用します。記載されている ICS 技術は、増加の統計分析のために複数の治療条件の急速なサンプリングを提供する老舗の各種メソッドを利用しています。この方法論は、蛍光などの共焦点ボリュームを介して拡散モバイル分子蛍光揺らぎの相関に基づく代替単一分子技術と?…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
著者認める資金 (奨学金 1084178 と助成金 1087850、1030469、1075898 (AMS)) NHMRC がんオーストラリア、ルートヴィヒがん研究、ジョン ・ T ・ リードを信頼、治療脳がん財団、ラトローブ大学、ビクトリアがん庁。ビクトリア朝の政府によって提供される運用インフラストラクチャ サポート プログラムからの資金調達、オーストラリアはまた認められています。
Materials
| Nunc Lab-Tek II Chambered Coverglass – 8 well | ThermoFisher Scientific | 155409 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 10099141 | |
| TrypLE Express Enzyme (1x), no phenol red | ThermoFisher Scientific | 12604021 | |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Goat anti-Human IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | ThermoFisher Scientific | A11013 | |
| TetraSpeck Fluorescent Microsphere Standards 0.1µm | ThermoFisher Scientific | T7279 | |
| Cetuximab | Merck Serono | 3023715501 | |
| Parafilm M 38mx100mm | Merck Millipore | BRND701605 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | ProSciTech | C004 | |
| Recombinant Human EGF | R&D System | 236-EG |
Referencias
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature reviews. Cancer. 12 (4), 278-287 (2012).
- Parslow, A. C., Parakh, S., Lee, F. -. T., Gan, H., Scott, A. Antibody-Drug Conjugates for Cancer Therapy. Biomedicines. 4 (3), 14 (2016).
- Sorkin, A., Waters, C. M. Endocytosis of growth factor receptors. BioEssays. 15 (6), 375-382 (1993).
- Pawley, J. . Handbook of Biological Confocal Microscopy. , (2006).
- Petersen, N. O., Höddelius, P. L., Wiseman, P. W., Seger, O., Magnusson, K. E. Quantitation of membrane receptor distributions by image correlation spectroscopy: concept and application. Biophysical Journal. 65 (3), 1135-1146 (1993).
- Wiseman, P. W., Petersen, N. O. Image Correlation Spectroscopy. II. Optimization for Ultrasensitive Detection of Preexisting Platelet-Derived Growth Factor-β Receptor Oligomers on Intact Cells. Biophysical Journal. 76 (2), 963-977 (1999).
- Costantino, S., Comeau, J. W. D., Kolin, D. L., Wiseman, P. W. Accuracy and Dynamic Range of Spatial Image Correlation and Cross-Correlation Spectroscopy. Biophysical Journal. 89 (2), 1251-1260 (2005).
- Claire Robertson, S. C. G. Theory and practical recommendations for autocorrelation-based image correlation spectroscopy. Journal of Biomedical Optics. 17 (8), 080801 (2012).
- Ciccotosto, G. D., Kozer, N., Chow, T. T. Y., Chon, J. W. M., Clayton, A. H. A. Aggregation Distributions on Cells Determined by Photobleaching Image Correlation Spectroscopy. Biophysical Journal. 104 (5), 1056-1064 (2013).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43 (1 Suppl), 25-30 (2007).
- Rappaz, B., Wiseman, P. W. Image correlation spectroscopy for measurements of particle densities and colocalization. Current protocols in cell biology. , (2013).
- tferr/Scripts: BAR 1.5.1. Zenodo Available from: https://zenodo.org/record/495245 (2017)
- Elson, E. L. Fluorescence Correlation Spectroscopy: Past, Present, Future. Biophysical Journal. 101 (12), 2855-2870 (2011).
- Jares-Erijman, E. A., Jovin, T. M. Imaging molecular interactions in living cells by FRET microscopy. Current opinion in chemical biology. 10 (5), 409-416 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-Resolution Fluorescence Microscopy. dx.doi.org.ez.library.latrobe.edu.au. 78 (1), 993-1016 (2009).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190 (2), 165-175 (2010).
- Nohe, A., Petersen, N. O. Image Correlation Spectroscopy. Sci. Signal. (417), pl7 (2007).

