Nano-capteurs pour détecter l’activité protéase In Vivo pour le diagnostic non invasif
Summary
Protéases sont étroitement réglementées des enzymes impliquées dans les processus biologiques fondamentaux et la dysrégulation protéase activité disques progression des maladies complexes telles que le cancer. Objectif de cette méthode consiste à créer des nano-capteurs qui mesurent l’activité protéase dans vivo en produisant un signal de clivage qui est détectable dans l’urine de l’hôte et la maladie est discriminatoire.
Abstract
Protéases sont des enzymes multifonctionnels qui se spécialisent dans l’hydrolyse des liaisons peptidiques et contrôlent les processus biologiques larges incluant l’homéostasie et allostasie. En outre, dysrégulation de l’activité protéase disques pathogenèse et est un biomarqueur fonctionnel des maladies comme le cancer ; par conséquent, la capacité de détecter l’activité protéase dans vivo peut fournir des renseignements cliniquement pertinents pour le diagnostic biomédical. Le but du présent protocole est de créer des nano-capteurs qui sonde de protéase activité in vivo en produisant un signal quantifiable dans l’urine. Ces Nano-capteurs de protéase se composent de deux éléments : une NANOPARTICULE et le substrat. Les fonctions de nanoparticules pour augmenter le débit Half-Life et substrat de circulation sur les sites de maladies cibles. Le substrat est une séquence de peptide court (6-8, AA), qui est conçue pour être spécifique à un groupe de protéases ou de protéase de la cible. Le substrat est conjugué à la surface de la NANOPARTICULE et se termine par un journaliste, comme un marqueur fluorescent, pour la détection. Comme dysrégulation protéases cleave le substrat de peptide, le journaliste est filtré dans l’urine pour la quantification comme biomarqueurs de l’activité de la protéase. Dans les présentes, nous décrivons la construction d’un NANOCAPTEUR pour métalloprotéinase matricielle 9 (MMP9), qui est lié à la progression tumorale et les métastases, pour le dépistage du cancer colorectal dans un modèle murin.
Introduction
Protéases sont des enzymes multifonctionnels qui se spécialisent dans l’hydrolyse des liaisons peptidiques et ont un contrôle important sur nombreux processus biologiques, y compris l’homéostasie, allostasie et maladie1. Une altération de l’état d’activité de la protéase a été corrélée à une variété de maladies, notamment le cancer et les maladies cardiovasculaires, rendant les candidats attrayants protéases pour le développement en biomarqueurs cliniques2,3. En outre, une activité protéase est pathogenèse fonctionnellement lié à distinctes, des patients et le pronostic de la maladie4. De façon générale, biocapteurs ont été développés pour détecter différents phénomènes biologiques et d’autres maladies comme le cancer, des maladies neurodégénératives et transfert d’électron processus5,6,7,8 , 9. plus précisément, les capteurs de protéase axée sur le substrat ont été mis au point pour détecter l’activité de la protéase et incluent des sondes fluorogéniques pour diagnostic imaging10 et isotopiquement étiquetés substrats peptidiques de in vitro détection par spectrométrie de masse à11. En outre, fondé sur l’activité des sondes ont été développés, qui contiennent des régions comme substrat qui lient ou modifient la cible protéase12. Avec cette méthode, la protéase cible est irréversiblement inhibée lorsque le site actif est modifié et analyse nécessite la récolte de tissus, ce qui limite les applications in vivo . Toutefois, il est important de détecter l’activité protéase dans vivo, parce que la régulation de l’activité de la protéase est fortement tributaire du cadre d’autres activités biologiques telles que la présence d’inhibiteurs endogènes.
L’objectif de ce travail est de décrire la formulation de nano-capteurs basés sur les activités qui détectent l’activité protéase dans vivo en produisant un signal mesurable dans l’urine. Cette plateforme est utilisée comme diagnostic non invasif de discriminer les maladies complexes telles que le cancer à l’aide de dysrégulation de l’activité protéase comme biomarqueur fonctionnel. Notre plateforme NANOCAPTEUR se compose des nanoparticules d’oxyde de fer (IONP) conjugués à des substrats de protéase. Ces substrats sont terminées par un journaliste fluorescent qui s’échappe lorsque protéases clivent le substrat. Ces IONPs circulent en vivo, localiser les sites de la maladie et exposent les substrats aux protéases d’associés à la maladie actives. Après clivage, reporters fluorescents sont libérés et, en raison de leur petite taille, sont filtrés dans l’urine, tandis que les substrats clivés sur le IONP restent dans le corps. Par conséquent, une augmentation des activités de protéase en vivo se traduira par des concentrations plus élevées de journaliste dans l’urine (Figure 1). Notre plate-forme étant une analyse d’urine, aucune plateforme d’imagerie n’est nécessaire et signaux de diagnostic sont enrichies dans l’urine.
Cette plate-forme peut être conçue pour détecter une variété de maladies dont le cancer, la fibrose et thrombose13,14. Nous décrivons ici la conception de nano-capteurs pour détecter les altitudes dans la matrice metallopeptidase 9 (MMP9) activité comme biomarqueur du cancer colorectal. Le cancer colorectal est la deuxième cause de décès par cancer aux États-Unis, avec environ 136 800 nouveaux cas et 50 300 décès en 2014 seulement15. Les cellules tumorales colorectal produisent MMP9, qui s’est avérée pour piloter la progression maligne, dégradation de la matrice, ainsi que16de la métastase. En outre, nous avons identifié un substrat adapté de peptide (PLGVRGK) pour MMP9 de la littérature17. Cette plate-forme peut être utilisée pour la détection précoce du cancer et de faible coût point-of-care diagnostic13,14,18,19,20,21.
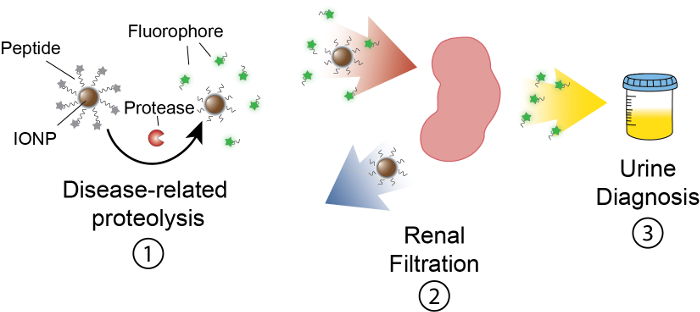
Figure 1 : schéma de NANOCAPTEUR activité In vivo. Nano-capteurs circulent dans le corps et localiser les sites de la maladie. Ensuite, liée à la maladie des protéases clivent substrats peptidiques présentés par IONPs. La taille des fragments clivées permet la clairance rénale, obligeant à localiser dans l’urine. Après que l’animal urine, ces fragments peptidiques peuvent être analysés par leur molécule de journaliste. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Cette méthode décrit le développement de nano-capteurs basés sur les activités consistant en protéase substrats conjugués à un noyau de nanoparticules. L’événement de clivage protéolytique est surnommé le « switch pharmacocinétique », parce que produits peptidiques clivées sont plus petites que la taille de filtration rénale de 5 nm23 et filtre dans l’urine pour produire un signal non invasif. Par conséquent, il est important d’utiliser des nanoparticules ou transporteurs…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Ce travail a été financé par un directeur de NIH New Innovator Award (prix no DP2HD091793). Q.D.M. est pris en charge par le programme de bourses de recherche recherche supérieures de NSF (Grant No. DGE-1650044). B.A.H est pris en charge par les instituts nationaux de santé GT BioMAT formation Grant sous attribution numéro 5T32EB006343 ainsi que du Président Georgia Tech Fellowship. G.A.K. est titulaire d’une bourse de carrière à l’Interface scientifiques du fonds Burroughs Bienvenue. Le contenu est la seule responsabilité des auteurs et ne représente pas nécessairement l’opinion officielle de la National Institutes of Health.
Materials
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
Referencias
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).

