Одновременное электрической и механической стимуляции для повышения потенциала клеток Cardiomyogenic
Summary
Здесь мы представляем протокол для подготовки популяции клеток с помощью электрических и механических раздражителей, подражая физиологии сердца. Это электромеханический стимуляции усиливает потенциал cardiomyogenic лечение клеток и является перспективной стратегией для дальнейшего клеточной терапии, моделирование болезней и наркотиков скрининг.
Abstract
Сердечно-сосудистые заболевания являются основной причиной смерти в развитых странах. Следовательно спрос на эффективные сердечно клеточной терапии побудило исследователей в области стволовых клеток и биоинженерии для разработки в vitro высокой верности человека миокарда для фундаментальных исследований и клинического применения. Однако незрелых фенотип сердечной клетки является ограничение на получение тканей, которые функционально имитировать взрослых миокарда, который характеризуется главным образом механических и электрических сигналов. Таким образом целью настоящего Протокола является подготовить и зрелые целевой популяции клеток через электромеханический стимуляции, изложив физиологических параметров. Инженерии сердечной ткани эволюционирует в сторону более биологические подходы и стратегии, основанные на биофизические раздражители, таким образом, набирают силу. Устройство, разработанной для этой цели является уникальной и позволяет индивидуальных или одновременное электрических и механических стимуляции, тщательно характеризуется и проверены. Кроме того хотя методология была оптимизирована для этот стимулятор и населением в определенную ячейку, она может быть легко адаптирована к другим устройствам и клеточных линий. Результаты здесь предлагают доказательства увеличение сердца приверженности популяции клеток после электромеханические стимуляции. Электрои-механическ стимулируется клетки показывают увеличение выражение основных сердца маркеров, в том числе ранних, структурных и кальция регулирующие генов. Это кондиционирование ячейки может быть полезной для дальнейшего восстановительной клеточной терапии, моделирование болезней и наркотиков высокопроизводительного скрининга.
Introduction
Сердце функция основана на сцепное устройство электрического возбуждения и механическое сокращение. Вкратце cardiomyocyte межклеточные соединения позволяют распространение электрического сигнала производить почти синхронного сокращений сердца что качать кровь, системно и через систему дыхания. Сердечной клетки, таким образом, проходят электрических и механических сил, которые регулируют выражение и клеточной функции гена. Соответственно многие группы пытаются развивать культуру платформы, которые имитируют сердца физиологической среды чтобы понять роль механической и электрической стимуляции сердечной развития, функции и созревания. Электрические и механические раздражения в vitro индивидуально применялись широко в инженерии сердечной ткани повышения функциональных свойств, увеличить созревания клеток или улучшить Связывание ячеек и кальция, обработка1 , 2 , 3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 , 19 , 20 , 21. Тем не менее, синхронные электромеханические принадлежности остается неиспользованными из-за задача разработки стимулятор и протокол и обязательная оптимизация22.
Предварительные работы рассмотрены электромеханические стимуляции, как сочетание электрической стимуляции и перфузии СМИ; Однако поток не связаны на основе штамма деформации, типичных для наполнения желудочков23,24,25. Позже более физиологических подходов Комбинированные электрические стимулы с физической деформации или стрейч, чтобы имитировать isovolumetric сокращения26,27,28,29,30 ,31. Фэн et al. описал первой демонстрации электромеханических стимуляции в 2005 году, отчетности, повысить размер и сократительных свойств cardiomyocyte26. Ван et al., предварительно обработанных мезенхимальных стволовых клеток с 5-azacytidine и применяется синхронный электрические и механические принадлежности, улучшение recellularization, жизнеспособность клеток, сердечной дифференциации и тканей ремоделирования27. После этих публикаций, более групп сообщили на электромеханические стимуляции клеток монослои или инженерии тканей (например, черный28, Vunjak-Новакович29,31и наша группа30) с Первые клетки кондиционером протестированы в естественных условиях30. Вкратце Морган и черный испытаны несколько комбинаций электрических и механических раздражителей, отчетности, что сроки между стимуляцию имеет решающее значение, поскольку задержки комбинированных электромеханические стимуляции принесли лучшие результаты28. Далее Godier-Furnémont и коллаборационистов оптимизированный протокол электромеханические стимуляции для инженерии сердца мышца конструкций из клеток сердца новорожденных крыс и достигнута в первый раз, положительная сила частота отношения29. Потом наша группа сообщила, что электрои-механическ оговоренную клетки увеличилось выражение основных сердца маркеров в пробирке и широкой полезных эффектов в естественных условиях, таких как улучшение сердечной функции или увеличение плотности судна при инфаркте границы региона30. Самые последние публикации продемонстрировал, что сердечных тканей из стволовых клеток, полученных кардиомиоцитов подвергнут электромеханические принадлежности, достигли созревания уровня ближе к человека взрослых сердечной структуры и функции31. Кроме того альтернативные трехмерной стимуляции платформы составляют Электроактивные леса, которые обеспечивают электрические, механические и топографические подсказки для ячейки придает32. Кроме того механические деформации (клетки однослойная растяжения и сжатия) может также быть наведено с растягивающийся электроды подражая нормальных физиологических условиях, а также экстремальных условиях33.
Таким образом объясняется тем, что в пробирке электромеханические стимулы, основанные на физиологических условиях может повысить потенциал cardiomyogenic клетки. Действительно Эта стимуляция может пользу дальнейшей интеграции терапевтических клеток в миокарде в клинической ситуации или увеличить созревания тканей для наркотиков скрининг приложений.
Кроме того, мы изолированы и характеризуется население человека жировой ткани производные прародитель клеток сердечной происхождения (сердечной ATDPCs)34. Эти клетки расположены в жировой эпикардиальной. Эти клетки отображать выгодно функциональные и гистопатологические эффекты лечения инфаркта миокарда, а также поддерживать сердечной и эндотелиальной дифференцировки потенциал. 30 , 35. Мы предположили, что эти преимущества возрастет после биофизических стимуляции.
Следовательно мы разработали устройство и режима стимуляции для популяции клеток интерес и исследованы эффекты. Этот электромеханические протокол является новой стратегии, чтобы заставить активной ячейки, растяжения образом стерильные и неинвазивно по сравнению с предыдущей публикации36, в сочетании с электрическим полем стимуляции. Техника, сообщили здесь подробно объясняет устройство и метод, используемый для электрических, механических и электромеханических стимуляции клеток.
Это устройство может обеспечить электрической и механической стимуляции, независимо или одновременно. Стимулирование осуществляется с неинвазивной и асептических новаторский подход, который включает в себя поддержку presterilized клеток, электродов, расположенных внутри стандартного культуры пластины и платформа, которая побуждает механических и электрических сил (рис. 1).
Платформа может вместить до шести культуры пластин и состоит из сэндвичевой конструкции poly(methyl methacrylate) лазерного надреза и печатных плат. Прототип платформы опирается на сочетание монофазные программируемые компьютерным управлением Электростимуляторы, печатная плата для надежного подключения электродов, и шесть 10 мм х 10 мм x 5 мм из никелированной неодим Исправлена магниты помещены возле одной стороне плиты культуры. Есть также бар алюминия с шестью вождения магнитами (же модель) перед другой стороне плиты культуры и переехала с линейной серводвигателя. Двигатель управляется контроллер двигателя, выполняемых через порт RS-232 коммерческого программного обеспечения (см. Таблицу материалов). Через интерфейс пользователя и программируемые стимулятор можно запрограммировать интенсивность электрического, длительность импульса и частота, частота механической стимуляции, его Скважность импульсов, количество импульсов, амплитуда импульса (экскурсия на магнит), и наклон.
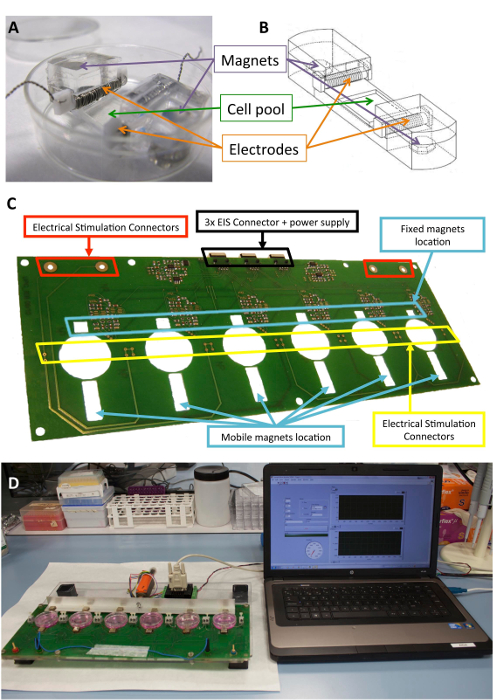
Рисунок 1 : Электромеханические стимулятор. (A) PDMS конструкция, используемая для кондиционирования ячейки. (B) рисунок PDMS конструкции, в том числе электродов и магниты. (C) деталь печатной платы (платформа) используется для выполнения электромеханические принадлежности. Эта группа была изменена с Llucià-Valldeperas et al.30. (D) картина электромеханические стимуляции и пользовательский интерфейс (компьютер). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Стимулятор и метод для электромеханических кондиционирования полностью описаны в двух международных патентов, WO-2013185818-А137 и38WO-2017125159-А1.
Биосовместимых силикона, конструкции, призванных обеспечить структурную поддержку для клетки, электроды и магниты были описаны ранее10,21. Вкратце они состоят из полидиметилсилоксан (PDMS), формованных и вылечить при комнатной температуре, с Юнга 1,3 МПа, рядом физиологических уровнях. Конструкция содержит пул культуры клеток в зоне гибкие (10 x 10 x 2 мм), два внутренних поперечных слотов провести электродов и два встроенных 6 мм х 2 мм x 4 мм никелированные неодимовые магниты. Электроды строятся с 0,2 мм Платиновая Проволока витая вокруг 2 мм x 3 мм x 12 мм из политетрафторэтилена (ПТФЭ) основные бар (21 см за электродом, примерно 23 повороты) и размещены на противоположных сторонах области гибкой для создания электрического поля для стимулирования Электрическая стимуляция. Механического растяжения достигается за счет магнитного притяжения между магнитами, встроенные в поддержку и внешние магниты помещены рядом с пластину культуры и на движущихся алюминия руку. Таким образом поддержка клеток может быть продлен без нарушения стерильного барьера. Этот подход подходит для монослое клеток, но могут быть адаптированы к трехмерной конструкции, а также.
Кроме того шаблон регулярного могут быть отпечатаны, где клетки являются семенами, используя правит дифракционной решетки (1250 канавки/мм). Из-за своей прозрачности и толщиной 0,5 мм возможна прямая визуализация клетки культивировали на PDMS конструкции под brightfield и люминесцентные микроскопы. В данном случае бассейн PDMS культура имеет вертикальные поверхности шаблон, перпендикулярно растяжения силы, чтобы выровнять клетки перпендикулярно к электрического поля, которая уменьшает электрическое поле градиента через ячейку.
Рисунок 1 показывает подробное описание конструкции и устройства, используемые для стимуляции. Построить PDMS и характеристики оптимизированы для ячейки, растяжения (рис. 1A, B). Стимулятор разработан и апробирован для эффективного применения желаемого электрической и механической стимуляции клеток, придает конструкции PDMS. Этот процесс включает в себя обеспечение хорошего соединения и пользователя работоспособность через программный интерфейс (рис. 1 c, D).
Процедура стимуляции клеток, используя этот заказ устройства описан в разделе протокол.
Protocol
Representative Results
Discussion
Электромеханические стимуляции, как представляется, является безопасной альтернативой для подготовки клетки сердечной обстановке враждебности и повышения их сердца обязательство. Здесь протокол, описанный для сердца прогениторных клеток выражение основных сердца маркеров и состав…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Авторы хотели бы поблагодарить членов исследовательской программы ICREC (IGTP, Бадалона) и электронной биомедицинской аппаратуры группы (СКП, Барселона), особенно профессор J. Розе́ль-Феррер. Кроме того авторы признают журнал трансляционная Медицина стволовых клеток и AlphaMed Пресс для разрешения адаптации ранее опубликованные цифры (Llucià-Valldeperas, и др. 30). Разработка этого прототипа и дизайн протокола были поддержаны Ministerio de Educación y науки (SAF 2008-05144), y Ministerio де Economía развитию (SAF 2014-59892), Европейской Комиссии (7-й Рамочной программе RECATABI, NMP3-SL-2009-229239), Marató де ла Fundació TV3 (080330, 201516, 201502) и Фонд пункт ла ла Prospectiva Innovación y Salud ан Испании (FIPSE; 00001396-06-15).
Materials
| Stimulator | |||
| nickel plated neodymium magnets | Supermagnete | Q-10-10-05-N | |
| nickel-plated neodymium magnets | Supermagnete | Q-06-04-02-HN | |
| polydimethylsiloxane (PDMS) SYLGAR 184 Silicone Elastomer Kit | Dow Corning Corp | 184 | |
| ruled diffraction grating (1250 grooves/mm) | Newport | 05RG150-1250-2 | |
| Motor controller | Faulhaber | MCLM-3006-S | |
| Labview | National Instruments | ||
| Cell culture | |||
| phosphate-buffered saline (PBS) | Gibco | 70013-065 | |
| 0.05% trypsin-EDTA | Gibco | 25300-120 | |
| 35 mm cell culture dish | BD Falcon | 45353001 | |
| fetal bovine serum (FBS) | Gibco | 10270-106 | |
| L-Glutamine 200 mM, 100x | Gibco | 25030-024 | |
| Penicilina/Streptomicine, 10.000 U/mL | Gibco | 15140-122 | |
| Minimum essential medium eagle (alfa-MEM) | Sigma | M4526-24x500ML | |
| Protein & RNA analyses | |||
| protease inhibitor cocktail | Sigma | P8340 | |
| QIAzol Lysis Reagent | Qiagen | 79306 | |
| AllPrep RNA/Protein Kit | Qiagen | 50980404 | |
| Rneasy mini kit | Qiagen | 74104 | |
| iTaq Universal Probes One-Step Kit | Bio-Rad Laboratories | 172-5140 | |
| Random hexamers | Qiagen | 79236 | |
| TaqMan PreAmp MasterMix 2X | Applied Biosystems | 4391128 | |
| TaqMan Universal PCR MasterMix | Applied Biosystems | 4324018 | |
| Immunostaining | |||
| 10% formalin | Sigma | HT-501128-4L | |
| horse serum | Sigma | H1138 | |
| Triton X-100 | Sigma | X100-500ML | |
| Bovine Serum Albumina (BSA) | Sigma | A7906-100G | |
| PARAFILM | Sigma | P6543 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| Phalloidin Alexa 568 | Invitrogen | A12380 | |
| sodium azide | Sigma | S8032-100g | |
| Hoechst 33342 | Sigma | 14533 | |
| Connexin-43 rabbit primary antibody | Sigma | C6219 lot#061M4823 | |
| sarcomeric α-actinin mouse primary antibody | Sigma | A7811 lot#080M4864 | |
| GATA-4 goat primary antibody | R&D | AF2606 VAZ0515101 | |
| MEF2 rabbit primary antibody | Santa Cruz | sc-313 lot#E0611 | |
| SERCA2 goat primary antibody | Santa Cruz | sc-8095 lot#D2709 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 711-165-152 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 715-165-151 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 712-165-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 715-225-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 711-225-152 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 705-225-147 |
Referencias
- McDonough, P. M., Glembotski, C. C. Induction of atrial natriuretic factor and myosin light chain-2 gene expression in cultured ventricular myocytes by electrical stimulation of contraction. Journal of Biological Chemistry. 267, 11665-11668 (1992).
- Tandon, N., et al. Electrical stimulation systems for cardiac tissue engineering. Nature Protocols. 4, 155-173 (2009).
- Serena, E., et al. Electrical stimulation of human embryonic stem cells: cardiac differentiation and the generation of reactive oxygen species. Experimental Cell Research. 315, 3611-3619 (2009).
- Tandon, N., et al. Optimization of electrical stimulation parameters for cardiac tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 5, 115-125 (2011).
- Zhang, X., Wang, Q., Gablaski, B., Lucchesi, P., Zhao, Y. A microdevice for studying intercellular electromechanical transduction in adult cardiac myocytes. Lab on a Chip. 13, 3090-3097 (2013).
- Chan, Y. C., et al. Electrical stimulation promotes maturation of cardiomyocytes derived from human embryonic stem cells. Journal of Cardiovascular Translational Research. 6, 989-999 (2013).
- Pietronave, S., et al. Monophasic and biphasic electrical stimulation induces a precardiac differentiation in progenitor cells isolated from human heart. Stem Cells and Development. 23, 888-898 (2014).
- Pavesi, A., et al. Electrical conditioning of adipose-derived stem cells in a multi-chamber culture platform. Biotechnology and Bioengineering. 111, 1452-1463 (2014).
- Baumgartner, S., et al. Electrophysiological and morphological maturation of murine fetal cardiomyocytes during electrical stimulation in vitro. Journal of Cardiovascular Pharmacology and Therapeutics. 20, 104-112 (2015).
- Llucià-Valldeperas, A., et al. Electrical stimulation of cardiac adipose tissue-derived progenitor cells modulates cell phenotype and genetic machinery. Journal of Tissue Engineering and Regenerative Medicine. 9 (11), 76-83 (2015).
- Llucià-Valldeperas, A., et al. Physiological conditioning by electric field stimulation promotes cardiomyogenic gene expression in human cardiomyocyte progenitor cells. Stem Cell Research and Therapy. 5, 93 (2014).
- Radisic, M., et al. Functional assembly of engineered myocardium by electrical stimulation of cardiac myocytes cultured on scaffolds. Proceedings of the National Academy of Sciences of the United States of America. 101 (52), 18129-18134 (2004).
- Fink, C., et al. Chronic stretch of engineered heart tissue induces hypertrophy and functional improvement. FASEB Journal. 14, 669-679 (2000).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature Medicine. 12 (4), 452-458 (2006).
- Birla, R. K., Huang, Y. C., Dennis, R. G. Development of a novel bioreactor for the mechanical loading of tissue-engineered heart muscle. Tissue Engineering. 13, 2239-2248 (2007).
- Salameh, A., et al. Cyclic mechanical stretch induces cardiomyocyte orientation and polarization of the gap junction protein connexin43. Circulation Research. 106, 1592-1602 (2010).
- Galie, P. A., Stegemann, J. P. Simultaneous application of interstitial flow and cyclic mechanical strain to a three-dimensional cell-seeded hydrogel. Tissue Engineering Part C: Methods. 17 (5), 527-536 (2011).
- Leychenko, A., Konorev, E., Jijiwa, M., Matter, M. L. Stretch-induced hypertrophy activates NFkB-mediated VEGF secretion in adult cardiomyocytes. PLoS One. 6, 29055 (2011).
- Tulloch, N. L., et al. Growth of engineered human myocardium with mechanical loading and vascular coculture. Circulation Research. 109, 47-59 (2011).
- Mihic, A., et al. The effect of cyclic stretch on maturation and 3D tissue formation of human embryonic stem cell-derived cardiomyocytes. Biomaterials. 35, 2798-2808 (2014).
- Llucià-Valldeperas, A., et al. Unravelling the effects of mechanical physiological conditioning on cardiac adipose tissue-derived progenitor cells in vitro and in silico. Scientific Reports. 8, 499 (2018).
- Stoppel, W. L., Kaplan, D. L., Black, L. D. Electrical and mechanical stimulation of cardiac cells and tissue constructs. Advanced Drug Delivery Reviews. 96, 135-155 (2016).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10, 781-787 (2013).
- Barash, Y., et al. Electric field stimulation integrated into perfusion bioreactor for cardiac tissue engineering. Tissue Engineering Part C: Methods. 16, 1417-1426 (2010).
- Maidhof, R., et al. Biomimetic perfusion and electrical stimulation applied in concert improved the assembly of engineered cardiac tissue. Journal of Tissue Engineering and Regenerative Medicine. 6, 12-23 (2012).
- Feng, Z., et al. An electro-tensile bioreactor for 3-D culturing of cardiomyocytes. A bioreactor system that simulates the myocardium’s electrical and mechanical response in vivo. IEEE Engineering in Medicine and Biology Magazine. 24 (4), 73-79 (2005).
- Wang, B., et al. Myocardial scaffold-based cardiac tissue engineering: application of coordinated mechanical and electrical stimulations. Langmuir. 29 (35), 11109-11117 (2013).
- Morgan, K. Y., Black, L. D. Mimicking isovolumic contraction with combined electromechanical stimulation improves the development of engineered cardiac constructs. Tissue Engineering Part A. 20 (11-12), 1654-1667 (2014).
- Godier-Furnémont, A. F., et al. Physiologic force-frequency response in engineered heart muscle by electromechanical stimulation. Biomaterials. 60, 82-91 (2015).
- Llucià-Valldeperas, A., et al. Electromechanical Conditioning of Adult Progenitor Cells Improves Recovery of Cardiac Function After Myocardial Infarction. Stem Cell Translational Medicine. 6 (3), 970-981 (2017).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Gelmi, A., et al. Direct Mechanical Stimulation of Stem Cells: A Beating Electromechanically Active Scaffold for Cardiac Tissue Engineering. Advanced Healthcare Materials. 5 (12), 1471-1480 (2016).
- Poulin, A., et al. An ultra-fast mechanically active cell culture substrate. Scientific Reports. 8 (1), 9895 (2018).
- Bayes-Genis, A., et al. Human progenitor cells derived from cardiac adipose tissue ameliorate myocardial infarction in rodents. Journal of Molecular and Cellular Cardiology. 49 (5), 771-780 (2010).
- Bagó, J. R., et al. Bioluminescence imaging of cardiomyogenic and vascular differentiation of cardiac and subcutaneous adipose tissue-derived progenitor cells in fibrin patches in a myocardium infarct model. International Journal of Cardiology. 169, 288-295 (2013).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
- Rosell Ferrer, F. X., Sánchez Terrones, B., Bragós Bardia, R., Bayés Genís, A., Llucià Valldeperas, A. Methods and devices for mechanical and electrical stimulation of stem cell monolayer and 3d cultures for tissue engineering applications. Spanish patent. , (2013).
- Bayés Genís, A., Llucià Valldeperas, A., Soler Botija, C., Bragós Bardia, R., Rosell Ferrer, F. X. Method for Conditioning Stem Cells. Spanish patent. , (2017).
- Roura, S., Gálvez-Montón, C., Bayes-Genis, A. Myocardial healing using cardiac fat. Expert Review of Cardiovascular Therapy. 16 (4), 305-311 (2018).
- Zhang, Y. M., Hartzell, C., Narlow, M., Dudley, S. C. Stem cell-derived cardiomyocytes demonstrate arrhythmic potential. Circulation. 106 (10), 1294-1299 (2002).
- Liu, J., Fu, J. D., Siu, C. W., Li, R. A. Functional sarcoplasmic reticulum for calcium handling of human embryonic stem cell-derived cardiomyocytes: insights for driven maturation. Stem Cells. 25 (12), 3038-3044 (2007).
- Wipff, P. J., et al. The covalent attachment of adhesion molecules to silicone membranes for cell stretching applications. Biomaterials. 30 (9), 1781-1789 (2009).
- Kim, C. iPSC technology–Powerful hand for disease modeling and therapeutic screen. Biochemistry and Molecular Biology Reports. 48 (5), 256-265 (2015).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A Fast Track for Engineered Human Tissues in Drug Development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Bruyneel, A. A., McKeithan, W. L., Feyen, D. A., Mercola, M. Will iPSC-cardiomyocytes revolutionize the discovery of drugs for heart disease. Current Opinion inPharmacology. 42, 55-61 (2018).
- Farley, A., Johnstone, C., Hendry, C., McLafferty, E. Nervous system: part 1. Nursing Standard. 28 (31), 46-51 (2014).
- Brotto, M., Bonewald, L. Bone and muscle: Interactions beyond mechanical. Bone. 80, 109-114 (2015).
- Park, S. J., et al. Neurogenesis Is Induced by Electrical Stimulation of Human Mesenchymal Stem Cells Co-Cultured With Mature Neuronal Cells. Macromolecular Bioscience. 15 (11), 1586-1594 (2015).
- Vianney, J. M., Miller, D. A., Spitsbergen, J. M. Effects of acetylcholine and electrical stimulation on glial cell line-derived neurotrophic factor production in skeletal muscle cells. Brain Research. 1588, 47-54 (2014).
- Shima, A., Morimoto, Y., Sweeney, H. L., Takeuchi, S. Three-dimensional contractile muscle tissue consisting of human skeletal myocyte cell line. Experimental Cell Research. 370 (1), 168-173 (2018).

