Eine 3D-Schwanz-Explant-Kultur zur Untersuchung der Wirbeltiersegmentierung bei Zebrafischen
Summary
Hier stellen wir das Protokoll für die 3D-Gewebekultur der hinteren Körperachse des Zebrafischs vor, das eine Live-Untersuchung der Wirbeltiersegmentierung ermöglicht. Dieses Explant-Modell bietet Kontrolle über die Achsenverlängerung, die Veränderung von Morphogenquellen und die Subzellularauflösung auf Gewebeebene.
Abstract
Wirbeltierembryonen strukturieren ihre Hauptkörperachse als sich wiederholende Somiten, die Vorläufer von Wirbeln, Muskeln und Haut. Somites segmentieren sich progressiv vom präsomitischen Mesoderm (PSM), da sich das Schwanzende des Embryos nach hinterde verlängert. Somites bilden sich mit regelmäßiger Periodizität und Skalierung in der Größe. Zebrafisch ist ein beliebter Modellorganismus, da er genetisch handhabbar ist und transparente Embryonen hat, die Eine Live-Bildgebung ermöglichen. Dennoch werden während der Somitogenese Fischembryonen um ein großes, abgerundetes Eigelb gewickelt. Diese Geometrie schränkt die Live-Bildgebung von PSM-Gewebe in Zebrafischembryonen ein, insbesondere bei höheren Auflösungen, die einen engen objektiven Arbeitsabstand erfordern. Hier stellen wir eine abgeflachte 3D-Gewebekulturmethode zur Live-Bildgebung von Zebrafischschwanz-Explantierungen vor. Schwanzentspannen ahmen intakte Embryonen nach, indem sie eine proportionale Verlangsamung der Achsenverlängerung und eine Verkürzung der rostrocaudalen Somitenlängen zeigen. Wir sind außerdem in der Lage, die Achsendehnungsgeschwindigkeit durch Explant-Kultur zu stoppen. Dies ermöglicht es uns erstmals, den chemischen Eingang von Signalgradienten vom mechanistischen Eingang der axialen Dehnung zu entwirren. In zukünftigen Studien kann diese Methode mit einem mikrofluidischen Aufbau kombiniert werden, um zeitkontrollierte pharmazeutische Störungen oder ein Screening der Wirbeltiersegmentierung ohne Bedenken hinsichtlich der Arzneimittelpenetration zu ermöglichen.
Introduction
Die metamere Segmentierung von Organismen ist in der Natur weit verbreitet. Wiederholte Strukturen sind essentiell für die Funktionalität von Seitenorganen wie Wirbeln, Muskeln, Nerven, Gefäßen, Gliedmaßen oder Blättern in einem Körperplan1. Als Ergebnis solcher physiologischen und geometrischen Einschränkungen der axialen Symmetrie weisen die meisten Phyla von Bilateria – wie Anneliden, Arthropoden und Chordaten – eine Segmentierung ihres embryonalen Gewebes (z. B. Ektoderm, Mesoderm) antero-posterior auf.
Wirbeltierembryonen segmentieren ihr paraxiales Mesoderm entlang der Hauptkörperachse sequenziell in Somiten mit artspezifischen Intervallen, Zählungen und Größenverteilungen. Trotz dieser Robustheit bei einzelnen Embryonen innerhalb einer Art ist die somite Segmentierung zwischen Wirbeltierarten vielseitig. Die Segmentierung erfolgt in einem riesigen Regime von Zeitintervallen (von 25 min bei Zebrafischen bis 5 h beim Menschen), Größen (von ~20 μm bei Schwanz somiten von Zebrafischen bis zu ~200 μm bei Stamm somites von Mäusen) und Anzahl (von 32 bei Zebrafischen bis ~300 bei Kornschlangen)2. Interessanterweise können sich Fischembryonen in einem weiten Temperaturbereich entwickeln (von ~ 20,5 ° C bis zu 34 ° C für Zebrafische), während sie ihre Somiten mit den richtigen Größenverteilungen intakt halten, indem sie sowohl Segmentierungsintervalle als auch axiale Dehnungsgeschwindigkeiten ausgleichen. Über diese interessanten Merkmale hinaus bleibt Zebrafisch ein nützlicher Modellorganismus, um die Segmentierung bei Wirbeltieren aufgrund der äußeren, synchronen und transparenten Entwicklung einer Fülle von Geschwisterembryonen sowie ihrer zugänglichen genetischen Werkzeuge zu untersuchen. Aus mikroskopischer Sicht entwickeln sich Teleost-Embryonen auf einem sperrigen kugelförmigen Eigelb, dehnen und runden das gastrulierende Gewebe um es herum (Abbildung 1A). In diesem Artikel stellen wir eine abgeflachte 3D-Gewebe-Explant-Kultur für Zebrafischschwänze vor. Dieses Explant-System umgeht die sphärischen Einschränkungen der Dottermasse und ermöglicht den Zugang zu hochauflösenden Live-Imagings von Fischembryonen für die somite Musterung.
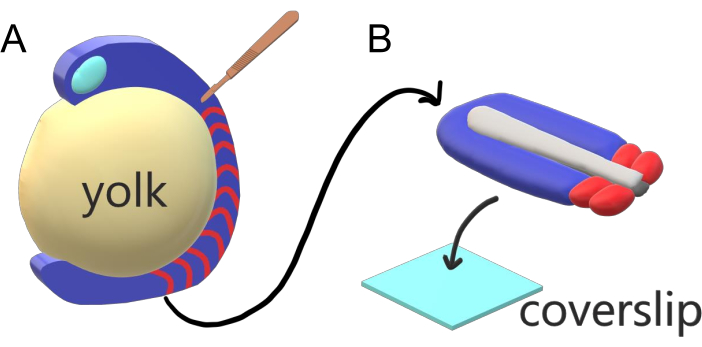
Abbildung 1: Diakammer-Explant-System für Zebrafischembryonen. (A) Zebrafischembryonen haben Vorteile für die Live-Bildgebung, wie die Transparenz von gastrulierendem embryonalem Gewebe (blau), aber das Gewebe bildet sich um eine sperrige kugelförmige Eigelbmasse (gelb), die eine nahezu objektive, hochauflösende Bildgebung in intakten Embryonen verhindert. Schwanzentstellungen können seziert werden, beginnend mit einem mikrochirurgischen Messer (braun), das aus dem Gewebe vor somites (rot) geschnitten wird und an der Grenze mit dem Eigelb posterior fortgesetzt wird. (B) Sezierte Schwanzausscheidungen können dorsoventral auf einen Abdeckungsrutsch (hellblau) gelegt werden; hält Neuralgewebe (hellgrau) oben und Notochord (dunkelgrau) unten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protocol
Representative Results
Discussion
Dieser Artikel stellt ein detailliertes Protokoll einer Gewebekultur-Explantierungstechnik vor, die wir entwickelt und kürzlich5 für Zebrafischembryonen verwendet haben. Unsere Technik baut auf den bisherigen Explantierungsmethoden in Küken8 undZebrafischen 9,10,11 Modellorganismen auf. Mit diesem Protokoll hergestellte Schwanzentspannungen können bis >12 h in einer einfachen G…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Wir danken der AECOM Zebrafish Core Facility und Cincinnati Children’s Veterinary Services für die Fischpflege, dem Cincinnati Children’s Imaging Core für die technische Unterstützung, Didar Saparov für die Unterstützung bei der Videoproduktion und Hannah Seawall für die Bearbeitung des Manuskripts. Die in dieser Veröffentlichung berichtete Forschung wurde vom National Institute of General Medical Sciences der National Institutes of Health unter der Vergabenummer R35GM140805 an E.M.Ö. Der Inhalt liegt allein in der Verantwortung der Autoren und stellt nicht unbedingt die offiziellen Ansichten der National Institutes of Health dar.
Materials
| 1 mL Sub-Q Syringe with PrecisionGlide Needle | Becton, Dickinson and Co. | REF 309597 | for dechorionating embryos and manipulations |
| 200 Proof Ethanol, Anhydrous | Decon Labs | 2701 | for immunostaining |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | for tissue dissection media |
| Calcium Chloride Anhydrous, Powder | Sigma-Aldrich | 499609 | for tissue dissection media |
| Dimethylsulfoxide | Sigma-Aldrich | D5879 | for immunostaining |
| Disposable Scalpel, #10 Stainless Steel | Integra-Miltex | MIL4-411 | for preparing tape slide wells |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | 886-86-2 | (optional) for anesthesizing tissues older than 20 somites stage |
| Fetal Bovine Serum (FBS) | ThermoFisher | A3160601 | additional for tissue culture media |
| Goat anti-Mouse IgG2b, Alexa Fluor 594 | Invitrogen | Cat#A-21145; RRID: AB_2535781 | secondary antibody for immunostaining |
| L-15 Medium with L-Glutamine w/o Phenol Red | GIBCO | 21083-027 | for tissue dissection media |
| Methanol | Sigma-Aldrich | 179337 | for immunostaining |
| Microsurgical Corneal Knife 2.85 mm Angled Tip Double Bevel Blade | Surgical Specialties | 72-2863 | for tissue dissection |
| Mouse monoclonal anti-ppERK | Sigma-Aldrich | Cat#M8159; RRID:AB_477245 | for ppERK immunostaining |
| NucRed Live 647 ReadyProbes Reagent | Invitrogen | R37106 | (optional) for live staining of cell nuclei |
| Paraformaldehyde Powder, 95% | Sigma-Aldrich | 158127 | for fixation of samples for immunostaining |
| Rat Tail Collagen Coating Solution | Sigma-Aldrich | 122-20 | (optional) for chemically activating slide chambers |
| Stage Top Incubator | Tokai Hit | tokai-hit-stxg | (optional) for temperature control during live imaging |
| Transparent Tape 3/4'' | Scotch | S-9782 | for preparing tape slide wells |
| Triton X-100 | Sigma-Aldrich | X100 | for immunostaining |
| Tween 20 | Sigma-Aldrich | P1379 | for immunostaining |
| Zebrafish: Tg(actb2:2xMCP-NLS-EGFP) | Campbell et al., 2015 | ZFIN: ZDB-TGCONSTRCT-150624-4 | transgenic fish with nuclear localized EGFP |
| Zebrafish: Tg(Ola.Actb:Hsa.HRAS-EGFP) | Cooper et al., 2005 | ZFIN: ZDB-TGCONSTRCT-070117-75 | transgenic fish with cell membrane localized EGFP |
Referencias
- Assheton, R. . Growth in length: Embryological Essays. , (1916).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454 (7202), 335-339 (2008).
- Westerfield, M. . The Zebrafish Book: a guide for the laboratory use of zebrafish (Danio rerio), 3rd edition. , (1995).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (1700003), (2017).
- Simsek, M. F., Ozbudak, E. M. Spatial fold change of Fgf signaling encodes positional information for segmental determination in zebrafish. Cell Reports. 24 (1), 66-78 (2018).
- Dubrulle, J., Pourquié, O. fgf8 mRNA decay establishes a gradient that couples axial elongation to patterning in the vertebrate embryo. Nature. 427 (6973), 419-422 (2004).
- Diez del Corral, R., et al. Opposing FGF and Retinoid Pathways Control Ventral Neural Pattern, Neuronal Differentiation, and Segmentation during Body Axis Extension. Neuron. 40 (1), 65-79 (2003).
- Stern, H. M., Hauschka, S. D. Neural tube and notochord promote in vitro myogenesis in single somite explants. Biología del desarrollo. 167 (1), 87-103 (1995).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics. 228 (3), 464-474 (2003).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546 (11), 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Biología del desarrollo. 406 (2), 172-185 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).

